电项针疏、密波对AD模型大鼠空间记忆能力及海马区BDNF/TrkBmRNA的影响
2013-10-11吕小笑
周 围,吕小笑,张 巍
(1.温州市中西医结合医院,浙江温州325001;2.永康市中医院,浙江永康321300;3.云阳县人民医院,重庆404500)
阿尔茨海默病(Alzheimer’s disease,AD)是以记忆减退、认知功能障碍等为主症的中枢神经系统退行性疾病,其发病机制尚不明确。研究表明神经元的凋亡可能是导致神经元丢失的主要原因。TrkB是脑神经营养因子(brain-derived neurotrophic factor,BDNF)调节突触活性与细胞分化进而影响大鼠海马结构和神经行为的一个重要蛋白靶点[1]。BDNF与受体TrkB结合后对发育过程中神经元的存活、分化以及成年神经元的存活和功能发挥重要作用。本研究拟通过D-半乳糖联合AlCl3制作AD模型大鼠,采用电项针疏、密波治疗后观察其行为学改变,以及BDNF及其TrkB受体的mRNA的影响,探讨电项针疏、密波改善AD学习记忆能力的可能作用机制。
1 材料与方法
1.1 实验动物及分组
将40只雄性、健康 Sprague-Dawley(SD)大鼠(黑龙江中医药大学动物实验中心),根据体重(320±50)g从小到大编号,从随机数字表[2]中任意选取起始数求余数(除以组数),经过调整后分为空白组、模型组、治疗1组,治疗2组,每组10只。
1.2 主要试剂及实验仪器
AlCl3(天津市永大化学试剂开发中心);D-半乳糖(上海阳光生物科技有限公司);BDNFmRNA、Trk-BmRNA试剂盒(武汉博士德生物工程有限公司);DAB显示剂(北京中山生物技术有限公司)。德国莱卡2135型切片机;美国moticam3000显微摄影成像系统;中国DM S-2型Morris水迷宫;DJ-6805D型脉冲电针仪。
1.3 造模方法
空白组仅给予正常饮食和饮水。模型组与治疗组每天给予胃饲20 mg·ml-1的 AlCl3水溶液 2 ml,腹腔注射48 mg·kg-1的 D - 半乳糖,连续8 周[3]。
1.4 治疗方法
常规消毒穴位与针具,取大鼠双侧“风池”、“供血”,Φ0.40 mm ×25 mm 毫针直刺 10 mm,后接 DJ-6805D型脉冲电针仪,一组导线同侧上下连接,“风池”为正极,“供血”为负极。治疗 1组即疏波组(2 Hz),治疗2组即密波组(50 Hz)。持续脉冲刺激20 min,每周6次,连续治疗4周。空白组、模型组采取治疗组同样的抓取、绑定(20 min),但不予治疗。
1.5 行为学测试
各组大鼠分别于造模前、成模后5天和治疗后5天进行Morris水迷宫行为学测试[4]。每次实验历时5天,每天上、下午各训练1次。记录大鼠找到平台所需要的时间,即逃避潜伏期。设定最长游动时限为60 s,如果大鼠60 s内未能找到平台,逃避潜伏期记为60 s,同时将其引至平台上,在平台上停留15 s。
1.6 阳性细胞表达分析
原位杂交检测各组大鼠海马BDNF/TrkBmRNA阳性表达,并采用美国motica3000显微摄影成像,于400倍镜下选取海马CA1-CA3区摄影,每组选取10例照片,在Motic image 3.2图像分析软件下进行分析,计算阳性细胞数。
1.7 统计学处理
2 结果
2.1 水迷宫检测各组大鼠空间学习记忆能力的变化
表1 各组大鼠空间学习记忆能力潜伏期比较(¯±s,s)
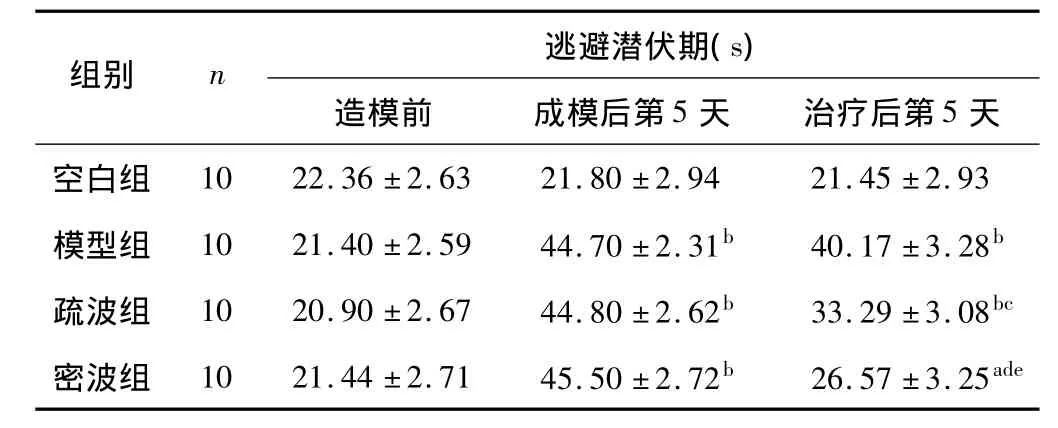
表1 各组大鼠空间学习记忆能力潜伏期比较(¯±s,s)
注:与空白组比较,aP <0.05,bP <0.01;与模型组比较,cP <0.05,dP <0.01,与疏波组比较,eP <0.05。
组别n 逃避潜伏期(s)造模前 成模后第5天 治疗后第5天空白组10 22.36 ±2.63 21.80 ±2.94 21.45 ±2.93模型组 10 21.40 ±2.59 44.70 ±2.31b 40.17 ±3.28b疏波组 10 20.90 ±2.67 44.80 ±2.62b 33.29 ±3.08bc密波组 10 21.44 ±2.71 45.50 ±2.72b 26.57 ±3.25ade
由表1统计结果可见,各组大鼠造模前,逃避潜伏期无统计学意义(P>0.05)。成模后,与空白组比较其它组逃避潜伏期有显著统计学意义(P<0.01),表明造模成功。治疗后,与空白组比较,密波组有统计学意义(P<0.05),疏波组有显著统计学意义(P<0.01);与模型组比较,疏波组有统计学意义(P<0.05),密波组有显著统计学意义(P<0.01);与疏波组比较,密波组有统计学意义(P<0.05)。
2.2 各组大鼠海马组织BDNF/TrkBmRNA阳性细胞表达
表2 各组大鼠海马组织BDNF/TrkBmRNA阳性细胞表达(¯±s个,400倍视野)

表2 各组大鼠海马组织BDNF/TrkBmRNA阳性细胞表达(¯±s个,400倍视野)
注:与空白组比较,aP <0.05,bP <0.01;与模型组比较,cP <0.05,dP <0.01,与疏波组比较,eP <0.05,fP <0.01。
组别 n BDNFmRNA阳性表达 TrkBmRNA 阳性表达空白组10 45.81 ±4.16 39.38 ±3.02模型组 10 21.38 ±3.51b 25.75 ±1.85b疏波组 10 27.43 ±2.75bc 30.63 ±1.39bd密波组 10 32.50 ±4.19ade 37.88 ±1.28df
由表2统计结果可见,与空白组比较,密波组BDNF mRNA阳性细胞表达,有统计学意义(P<0.05), 横型组、疏波组BDNF/TrkBmRNA阳性细胞表达均有显著统计学意义(P<0.01);与模型组比较,疏波组BDNF mRNA阳性表达有统计学意义(P<0.05),疏波组TrkB mRNA阳性表达与密波组BDNF/TrkB mRNA阳性细胞表达均有显著统计学意义(P<0.01);与疏波组比较,密波组BDNF mRNA阳性表达有统计学意义(P<0.05),密波组TrkB mRNA阳性表达有显著统计学意义(P <0.01)。
3 讨论
学习与记忆是认知的基础。近年研究表明,BDNF在学习记忆过程的多个方面发挥着关键性的作用[5]。其作用发挥主要依赖与其特异性受体TrkB的结合,形成配体/受体复合物,再通过细胞质途径激活多种蛋白质和酶[6],使信号从胞质转入核内,最后引起 DNA、RNA表达的改变,完成蛋白质的合成,从而发挥神经元支持、营养、再生等生物学功能[7]。BDNF具有防止受损神经元死亡、改善神经元的病理状态、促进受损伤神经元再生及分化[8]、维持正常神经元的生存,维持突触可塑性[9],从而达到改善AD模型大鼠空间记忆能力。
本实验通过Morris水迷宫观察D-半乳糖联合AlCl3对AD模型大鼠记忆功能的影响,结果发现,模型大鼠潜伏期较空白组明显延长,表明其学习记忆能力显著减退。有研究表明该造模方法既能较好的模拟AD发生的渐进性衰老表现[10-11],出现与自然衰老相似的代谢紊乱特征[12-13],又能更接近 AD的病理特征[14]。经过治疗后,疏波组和密波组的潜伏期较模型组有很大改善(分别为P<0.05和 P<0.01),表明电项针能够改善AD模型大鼠的学习记忆能力,而且密波组疗效优于疏波组。原位杂交检测结果表明,疏波组与密波组的BDNF/TrkBmRNA阳性表达较模型组均有增加(P<0.05和P<0.01),而且治疗组之间具有差异性(P<0.05),提示密波疗效优于疏波疗效。
[1] Li XZ,Yan J,Huang SH,et al.Identification of a key motif that determines the differential surface levels of RET and TrkB tyrosine kinase receptors and controls depolarization enhanced RET surface insertion[J].Biol Chem,2012,287(3):1932 -1945
[2] 孙振球.医学统计学[M].2版.北京:人民卫生出版社,2010:832
[3] 汪泽栋,周围,王淑慧,等.不同频率电项针对AD模型大鼠空间记忆能力及海马区pCREB1和BDNF的影响[J].针灸临床杂志,2013,29(1):66 -69
[4] Morris R.Developments of a water-maze procedure for studying spatial learning in the rats[J].J Neurosci Mehods,1984,11(1):47 - 60
[5] Bekinschtein P,Cammarota M,Izquierdo L,et al.BDNF and memory formation and storage[J].Neuroscientist,2008,14(2):147 - 156
[6] Patapoutian A,Reichardt LF.Trk receptors:mediators of neurotrophin action[J].Curr Opin Neurobiol,2001,11:272 -280
[7] Marini AM,Jiang X,Wu X,et al.Role of brain - derived neurotrophic factor and NF-kappaB in neuronal plasticity and survival From genes to phenotype[J].Restor Neurol Neurosci,2004,22(2):121 -130
[8] Dunham JS,Deakin JF,Miyajima F,et al.Expression of hippocampal brain-derived neurotrophic factor and its receptors in Stanleyconsortiumbrains[J].J Psychiatry research,2009,43(14):1175 - 1184
[9] Vecsey CG,Hawk JD,Lattal KM,et al.Histone deacetylase inhibitors enhance memory and synaptic plasticity via CREB:CBP-dependent transcriptional activation[J].Neurosci,2007,27(23):6128 -6140
[10] 李文彬,韦丰,范明,等.D-半乳糖在小鼠上诱导的拟脑老化效应[J].中国药理学与毒理学杂志,1995,9(2):93 -95
[11] 余资江,康朝胜,李宏伟.D-半乳糖致衰老小鼠学习记忆行为改变对海马神经发生的影响[J].中国老年学杂志,2009,29(7):1672-1673
[12] 钱小明,吴振国,施志明,等.衰老小鼠组织牛磺酸含量与脂质过氧化损伤的关系[J].基础医学与临床,1995,15(5):390
[13] Guo GW,Wu YL,Yang XH,et al.Effects of aluminum chloride on amyloid βprotein precursor and glial fibrillary acidic protein expression in rat cortex[J].chin J Pharmacol Toxicol,1999,13(3)227 -30
[14] 周原.两种阿尔茨海默病大鼠模型比较的实验研究[D].延吉:延边大学,2007
