大豆分离蛋白与甜菜果胶静电复合过程的研究
2013-10-10谢晶晶章轶锋李玉辉孔慧玲方亚鹏
谢晶晶,章轶锋,李玉辉,孔慧玲,方亚鹏
(湖北工业大学轻工学部食品与制药工程学院,菲利普斯亲水胶体研究中心,湖北武汉430068)
蛋白质和多糖是两类重要的天然高分子,单独使用时其性能无法满足实际需要,而蛋白质与多糖的复合物显示出更为优越的性能[1]。研究者利用蛋白质与多糖的相互作用设计和制作出新颖且具有更多功能(比如组织结构、质地、形态、气味等)的食品[2-3]。蛋白质与多糖的相互作用特别是静电复合被证实受一系列因素的影响,包括pH、离子强度、离子类型、蛋白质与多糖比例、电荷密度、高分子的形状和尺寸等。在诸多因素中,蛋白质与多糖比例、pH和离子强度是关键因素,因为它们决定了蛋白质与多糖携带的电荷数量[4-6]。在一定的pH下,作为电解质的蛋白质与多糖可能发生静电相互作用,且随着蛋白质与多糖比例的不同,形成不同的复合物:包括可溶复合物,液态凝聚物或固体沉淀[7-8]。在国内,利用蛋白质与多糖的相互作用研究复合物的凝胶质构特性、起泡性、乳化稳定性等已有一些报道[9-11],但有关蛋白质和多糖的相互作用机理及具体结构演变的实验鲜有报道。本文研究了GDL在线酸化诱导SPI与SBP之间的静电复合,探讨复合物的形成机理及结构演变过程,建立静电复合物在pH-混合比率坐标下的详细相图。该研究为蛋白质与多糖混合体系的复合凝聚提供了进一步的理论补充,为提高和扩展蛋白质-多糖体系的功能性提供了依据。在低pH时,SPI接近等电点而发生溶解性不好的现象,限制了SPI在食品中的应用,拟通过向SPI中添加一定量的SBP提高SPI在低pH情况下的可溶性[12]。SBP含有一定量的蛋白质,具有很好的乳化活性,但缺乏良好的乳化稳定性,拟通过向SBP中添加大豆分离蛋白提高SBP的乳化稳定性[13]。
1 材料与方法
1.1 材料与仪器
SPI 安阳漫天雪食品制造有限公司,MW=5.216×104u,90%蛋白质,9%水分,1%灰分;SBP 日本三荣源有限公司,MW=2.263×106u;GDL 美国Sigma公司;微孔滤膜 上海半岛实业有限公司净化器材厂;叠氮化钠、盐酸、氢氧化钠均为分析纯 国药集团化学试剂有限公司。
SRT202滚轴式混合器 厦门市其林贝尔仪器制造有限公司;GL21M智能高速冷冻离心机 长沙平凡仪器仪表有限公司;EL204分析天平、ORION 4 STAR pH酸度计 梅特勒-托利多仪器(上海)有限公司;Zetasizer Nano-ZS激光粒度及电位滴定分析仪 英国马尔文仪器有限公司;TU-1900双光束紫外可见分光光度计 北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 SPI和SBP溶液制备 分别取1g粉末溶于100g去离子水(加入0.005wt%叠氮化钠防止微生物生长),置于滚轴式混合器上摇匀过夜,待溶解充分后,在10000r/min下冷冻离心50min后取上清液,SPI上清液用0.22μm过滤膜(混合纤维素酯膜)过滤,SBP上清液用0.45μm过滤膜(混合纤维素酯膜)过滤。取5~6g过滤后样品称得质量为W1,通过烘干干重法烘干后称得质量为W2,测定其样品浓度,浓度(%)=(W2/W1)×100。
1.2.2 SPI/SBP混合物制备 根据所需不同混合比例,配制 SPI与 SBP混合液共 40g(总浓度为0.1wt%),从混合液中称取3份,每份10g,用0.1mol/L NaOH和0.1mol/L HCl将混合液pH调为8.0,待用。1.2.3 ξ-电位测定 分别称取0.1wt%SPI、0.1wt%SBP及不同混合比例的SPI/SBP溶液(总浓度为0.1wt%)12g左右,使用Zetasizer Nano-ZS激光粒度及电位滴定分析仪在温度为25℃时测定不同pH下的ξ-电位(光散射检测角度为 17°,激光器波长633nm,He/Ne气体激光器功率4mW)。设置pH从10.0降至2.0,pH每变化0.5时记录ξ-电位。
ξ-电位可以用来表征体系的带电情况,在施加电场下,带电粒子会发生电泳迁移,Henry方程描述了ξ-电位和电泳迁移率UE间的关系:
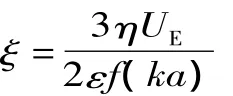
式中:ξ(mV):体系 ξ-电位,η(Pa ﹒ s):分散体系粘度,ε:分散体系介电常数,f(ka)为 Henry 函数[14]。
1.2.4 GDL在线酸化过程 将1.2.2配制好的10g混合物,根据需要,添加不同质量的GDL。GDL在水溶液中水解为葡萄糖酸,形成葡萄糖酸和葡萄糖酸内酯的平衡溶液,葡萄糖酸可释放H+,使得溶液酸化。其水解过程和酸化过程缓慢,可以自动监测溶液pH的连续变化。迅速摇匀后,采用ORION 4 STAR pH酸度计连续测定200min内混合物在酸化过程中pH随时间的变化,测定温度为25℃。
1.2.5 在线酸化过程中散射光强和流体力学半径的测定 将1.2.2配制好的10g混合物,添加GDL迅速摇匀后,取1mL样品置于样品池中,用Zetasizer Nano-ZS激光粒度仪(光散射检测角度为173°,激光器波长633nm,He/Ne气体激光器功率4mW)连续测定200min内混合物在酸化过程中散射光强(I173)和流体力学半径(Rh)随时间的变化,每分钟读取数值一次,测定温度为25℃。
1.2.6 在线酸化过程中浊度的测定 将1.2.2配制好的10g混合物,添加GDL迅速摇匀后,取3mL样品置于样品池中,用去离子水做空白对照,用紫外可见分光光度计在500nm波长下连续测定200min内混合物在酸化过程中浊度(τ)随时间的变化,每分钟读取数值一次,测定温度为25℃。
2 结果与讨论
2.1 SPI/SBP体系的ξ-电位
pH滴定过程中ξ-电位的变化可以反映整个体系在不同pH下的带电情况。ξ-电位是粒子间静电相互作用的标尺,可以用来预测分散体系的稳定性。体系稳定与否通常以ξ-电位的绝对值是否大于30mV为标准。图1反映了SPI、SBP和SPI/SBP混合体系(SPI/SBP=2/1)pH滴定过程中ξ-电位的变化。当pH降至6.0时,SPI体系ξ-电位急剧增加,至pH3.0时趋于平缓。由图可知,纯SPI的等电点为4.4。蛋白质分子同时含有羧基和氨基,在pH高于等电点一侧时,蛋白质带有净负电荷,在低于等电点一侧时,蛋白质带有净正电荷。当pH降至5.0时,SBP的ξ-电位急剧增加。纯SBP溶液在pH>5.0时,ξ-电位值大约为-40mV,当pH降至2.0时,体系的ξ-电位值接近0,这是由SBP所带羧基基团在酸化过程中发生质子化所致[4]。对于 SPI/SBP=2/1,其等电点约为2.9,介于SPI和SBP的等电点之间。
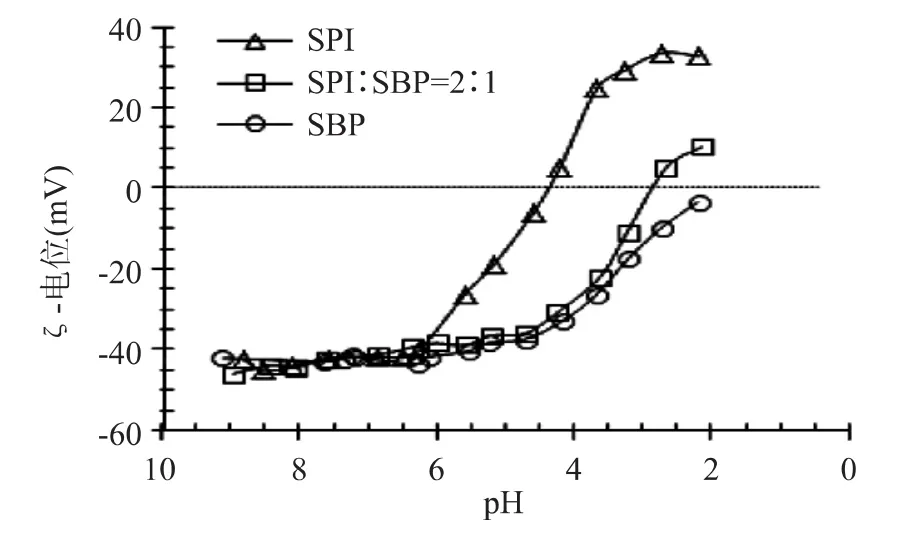
图1 ξ-电位随pH的变化Fig.1 ξ-potential as a function of pH
表1给出了不同混合比例下SPI/SBP的等电点。由表可知,随着混合体系中SBP含量的增加,等电点逐渐降低。这是因为较多SBP存在时,SPI需要在更加酸性的条件下,增加自身所带正电荷,才能中和SBP。当pH高于混合体系的等电点时,整个体系呈负电状态,说明体系中SPI所带的正电荷还不足以完全中和SBP所带的负电荷,当pH低于混合体系的等电点时,蛋白质所带正电荷多于SBP所带的负电荷,整个体系呈正电性。

表1 不同混合比例下SPI/SBP体系的等电点Table 1 Isoelectric point of SPI/SBP mixtures as a function of mixing ratio
很多报道证实当体系中蛋白质与多糖带相反电荷时,会发生静电吸引,生成复合物[7,15]。所以对于SPI/SBP混合物,复合物的形成应该发生在pH<4.4,即低于SPI的等电点。
2.2 SPI/SBP静电复合过程中散射光强与浊度的变化
散射光强可反映胶体粒子的大小,浊度则是因样品的吸收或颗粒的散射而造成透射光的衰减,同样可以反映粒子的大小。散射光强对分子水平上的结构变化比较敏感,而浊度则相对于大颗粒(如微米级别)比较敏感。因此,综合散射光强和浊度的变化趋势可以用来反映不同尺寸、不同结构以及不同稳定性的复合物的形成过程。酸化过程中SPI/SBP混合体系的散射光强和浊度变化如图2和图3所示。在不同混合比例下,散射光强和浊度随pH的降低都出现先缓慢增加后急剧上升再迅速下降的过程。随着SBP含量的增加,即SPI/SBP的降低,达到最大散射光强和浊度所对应的pH逐渐下降,这与不同比例混合体系等电点的变化趋势是相似的。
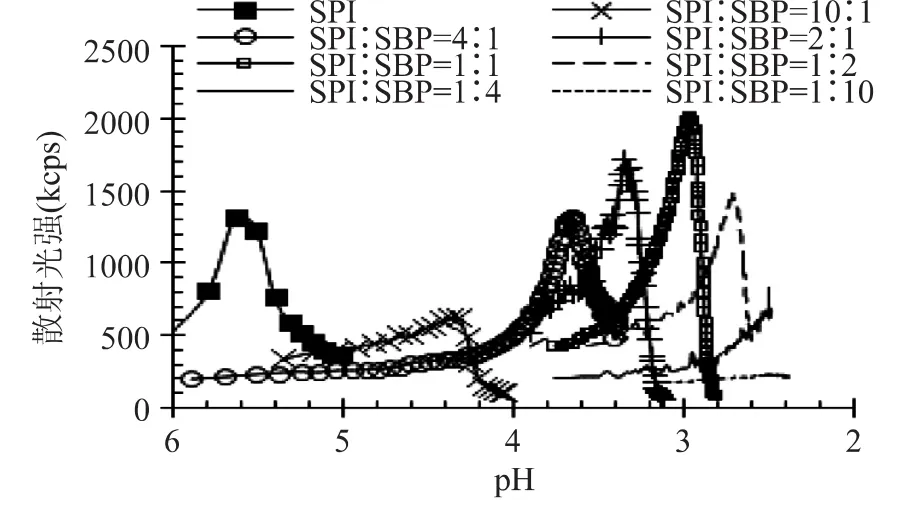
图2 GDL酸化过程中不同混合比例的SPI/SBP散射光强(173°,I173)随pH的变化Fig.2 Scattered light intensity at 173°(I173)as a function of pH during GDL-induced acidification for SPI/SBP mixtures with different mixing ratios
在连续测试过程中,散射光强先增加意味着溶液中可溶粒子发生了复合,随后散射光强的减弱可能是粒子颗粒尺寸增大、颗粒数量减少所致[16]。浊度的增加意味着颗粒的尺寸已增大至可见光波长范围,比如500nm,随着颗粒尺寸的进一步增大,浊度急剧上升至最大,之后由于重力影响,颗粒沉降,浊度减小。
2.3 SPI/SBP静电复合过程中特征结构转变点的确立
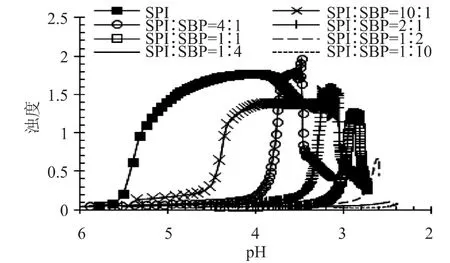
图3 GDL酸化过程中不同混合比例的SPI/SBP浊度(500nm,τ)随pH的变化Fig.3 Turbidity at 500nm as a function of pH during GDL-induced acidification for SPI/SBP mixtures with different mixing ratios
比较SPI/SBP=2/1体系的散射光强、浊度和流体力学半径随pH的演变,如图4所示。pH5.5~4.3这个区间,散射光强和浊度值都很低,并基本保持不变。当pH<4.3时,散射光强开始出现增加,该初始点定义为pHc。当4.3<pH<3.6时,散射光强显著增加并迅速到达最大值,说明多糖和蛋白质发生了显著的复合,散射光强达到最大值时的pH定义为pHφ。同时在该pH区间内,浊度无显著变化,说明形成的复合尺寸仍然小于可见光的波长,为纳米级别的可溶复合物。当pH<3.6时,浊度急剧增加并随后降低,说明体系开始形成尺寸较大的复合物,并发生了沉降。当pH<3.3时,浊度达到最大的同时流体力学半径迅速增大,并保持增长趋势,形成了肉眼明显可见的沉淀,说明体系形成了微米级别的不可溶复合物。
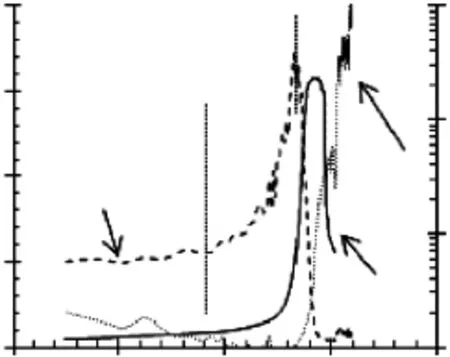
图4 GDL酸化过程中SPI/SBP=2/1混合体系散射光强,浊度以及流体力学半径的演变比较Fig.4 Comparison of the evolutions of scattered light intensity,turbidity and hydrodynamic radius during GDL-induced acidification for SPI/SBP=2/1
2.4 SPI/SBP静电复合物的相图
特征pH,如上述定义的pHc和pHφ对确定分子复合物的结构和性质至关重要。传统意义上,pHc表示散射光强开始缓慢增加,相互作用变得明显,形成了可溶分子复合物。pHφ表示散射光强达到最大,不可溶分子复合物开始形成。结合不同比例下SPI/SBP混合体系的pHc,pHφ以及SPI的等电点,绘制了SPI/SBP静电复合物在pH-混合比率坐标下的相图,如图5所示。
该相图分为四个区域:
(I):共溶高分子稳定区,该区域位于SPI等电点及pHc之上,SPI与SBP都带有较多的负电荷,两者之间的相互作用力以静电排斥为主,因此它们不能形成静电复合物。SPI和SBP以共溶的单个分子存在。
(Ⅱ):分子内可溶复合物稳定区,该区域处于SPI的等电点以下及pHc之上。由于pH在SPI等电点以下,SPI带有净的正电荷,因此SPI与SBP可通过静电吸引力形成复合物。在该区域内,SBP相对于SPI过量,因此形成的复合物以SBP分子内复合物占主导[17]。此时,混合体系的ξ-电位小于-30mV(如图1),分子内复合物之间静电排斥力仍然较强,使它们彼此分开而不至于形成分子间复合物。
(Ⅲ):分子间可溶复合物亚稳态区,该区域处于pHc和pHφ之间。随着pH的降低,SPI所带正电荷增加,超出了SBP提供的复合位点,此时过量的SPI可作为桥连点,连接不同的SBP分子进而形成SBP分子间复合物。在该区域内,混合体系的ξ-电位处于-30~-15mV之间,复合物之间的静电排斥力变弱,SPI与SBP间的短程静电吸引力可克服SBP分子内复合物之间的远程静电排斥力,通过SPI的桥连作用,SBP分子内复合物转化为SBP分子间复合物。在该区域内分子间复合物的尺寸增长仍然受静电排斥力的限制,复合物保持可溶性,但是已经出现不稳定性,为亚稳态结构。
(IV)分子间不可溶复合物,该区域的pH处于pHφ以下。随着pH的进一步降低,SPI携带更多的正电荷,混合体系的ξ-电位>-15mV,分子复合物间的静电排斥力进一步减弱,体系稳定性显著变弱,在SPI桥连的作用下,SBP分子间复合物进一步发生交联、聚集,形成尺寸更大的复合物,并最终出现相分离或絮状沉淀。通过光学显微镜可观察到SPI/SBP体系形成了絮状沉淀。
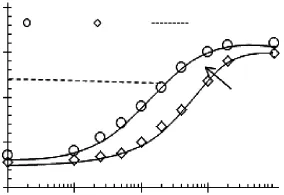
图5 SPI/SBP静电复合物的相图Fig.5 Phase diagram for the electrostatic complex of SPI/SBP
3 结论
本文利用动态光散射、浊度法以及电位滴定等多种互补手段,系统研究了GDL在线酸化诱导的SPI与SBP之间的静电复合。通过散射光强和浊度变化过程中的特征pH,并结合ξ-电位,建立了SPI/SBP静电复合物的详细相图,讨论了不同相区中复合物的性质、结构及稳定性。该研究为蛋白质与多糖混合体系的复合凝聚提供了进一步的理论补充,为提高和扩展蛋白质-多糖体系的功能性提供了依据,比如可用来指导蛋白质-多糖复合物作为新型食品乳化剂的应用[17]。
[1]王延青,郭兴凤.蛋白多糖共价复合物及其应用研究进展[J].中国食品添加剂,2009(5):151-155.
[2]林园,黄庆荣,苏朝晖.QCM-D研究蛋白质与多糖的相互作用[J].应用化学,2010,27(5):505-509.
[3]McClements D J.Non-covalent interactions between proteins and polysaccharides[J].Biotechnology Advances,2006(24):621-625.
[4]Li X Y,Fang Y P,Al-assaf S,et al.Complexation of bovine serum albumin and sugar beet pectin:structural transitions and phase diagram[J].Langmuir,2012,28(27):10164-10176.
[5]Perez A A,Carrara C C,Sánchez C C,et al.Interactions between milk whey protein and polysaccharide in solution[J].Food Chemistry,2009(116):104-113.
[6]Liu S,Low N H,Nickerson M T.Effect of pH,salt,and biopolymer ratio on the formation of pea protein isolate-gum arabic complexes[J].Journal of Agricultural and Food Chemistry,2009,57(4):1521-1526.
[7]Vinayhan T,Williams P A,Phillips G O.Electrostatic interaction and complex formation between gum arabic and bovine serum albumin[J].Biomacromolecules,2010(11):3367-3374.
[8]Fang Y P,Li L B,Inoue C,et al.Associative and segregative phase separations of gelatin/k-carrageenan aqueous mixtures[J].Langmuir,2006(22):9532-9537.
[9]熊拯.大豆分离蛋白阴离子多糖复合体系凝胶质构特性研究[J].粮油加工,2010(9):133-136.
[10]熊拯,黄贵.秋大豆分离蛋白阴离子多糖复合体系起泡性能研究[J].农业机械,2011(17):61-64.
[11]郭兴凤,熊拯,王延青,等.SPI-阴离子多糖复合体系乳化稳定性研究[J].河南工业大学学报,2010,31(3):32-34.
[12]Lam M,Richard S,Paul P,et al.Pectin stabilization of soy protein isolates at low pH[J].Food Research Interaction,2007(40):102-110.
[13]Nakauma M,Funami T,Noda S,et al.Comparison of sugar beet pectin,soybean soluble polysaccharide and gum arabic as food emulsifiers.1.Effect of concentration,pH,and salts on the emulsifying properties[J].Food Hydrocolloids,2008(22):1254-1267.
[14]Mirhosseini H,Tana CP,Hamid NSA,et al.Effect of arabic gum,xanthan gum and orange oil contents on zeta-potential,conductivity,stability,size index and pH of orange beverage emulsion[J].Colloids and Surfaces A-Physicochemical and Engineering aspects,2007,315(1-3):47-56.
[15]Park J M,Muhoberac B B,Dubin P L.Effects of proten charge heterogeneity in protein-polyelectrolyte complexation[J].Macromolecules,1992(25):290-295.
[16]Mekhloufi G,Sanchez C,Renard D,et al.pH-induced structural transitions during complexation and coacervation of β-lactoglobulin and acacia gum[J].Langmuir,2005(21):386-394.
[17]Li X Y,Fang Y P,Al-assaf S,et al.Complexation of bovine serum albumin and sugar beet pectin:Stabilising oil-in-water emulsions[J].Journal of Colloid and Interface Science,2012,388(1):103-111.
