氨基脲对雄性小鼠生殖功能的影响
2013-10-10邹学敏李东阳
袁 萍 周 艳 邹学敏 刘 晶 李东阳
(长沙医学院 湖南 衡阳 421001)
氨基脲(semicarbazide,SEM)是偶氮甲酰胺、角叉胶、次氯酸盐、蛋粉及溶解酵素等食品添加剂类的分解产物,酸奶洛、冰淇淋、蛋的加工、虾类的漂白及肉品生产等环节中含有氨基脲[1-3]。近年来,许多研究者还在蜂蜜、果汁、儿童食品、泡菜、啤酒、芥末和番茄酱及硝基呋喃类药物的代谢产物中检测出SEM[4-6]。研究表明,氨基脲具有胚胎、免疫、染色体畸变等器官毒性及致癌性[7-8]。有实验证实,氨基脲可使雄性小鼠精子精子活动降低、畸形率升高、数量减少,睾丸中酸性磷酸酶(ACP)活性升高,乳酸脱氢酶(LDH-X)活性下降,各级生精细胞的变性坏死,造成雄性动物不育[9]。本实验用SEM对雄性小鼠染毒,探讨SEM对雄性小鼠生殖功能的影响及其机制,旨在为防治SEM致男性生殖毒性损伤提供数据。
1 材料与方法
1.1 动物:SPF清洁级健康成年KM种雄性小鼠40只,体重为26±6克,由南华大学实验动物中心提供,实验动物合格证书编号:SCXK(湘)2005-0010。
1.2 主要试剂与仪器:纯度>99%SEM采购于天津北联精细化学品开发有限公司;LDH-X试剂盒、ACP试剂盒均购于南京建成生物工程研究所;CK40光学显微镜购于日本OLYMPUS公司;80℃,SLT-13V-85型超低温冰箱购于美国HARRIS公司;AB204-N型电子分析天平购于METTLER公司;80-2型台式低速离心机购于上海手术器械厂。
1.3 配制主要试剂:10%福尔马林:量取40%分析纯甲醛溶液,用新鲜去离子水稀释,甲醛溶液:新鲜去离子水为1∶9。SEM混悬液:按30、60、120mg/kg.bw 秤取 SEM 颗粒,按10ml/kg.bw 计算灌胃体积,把SEM灌胃液浓度确定为 3、6、12mg/ml。秤取 SEM3、6、12g搅溶于1000ml去离子水中,制成低、中、高剂量(3、6、9mg/ml)SEM 混悬液,即用现配。PH6.8的磷酸盐缓冲液:量取l/15mol/磷酸二氢钾(KH2PO4)溶液50.5ml和1/15mol/L磷酸氢二钠(Na2HPO4)溶液49.5ml完全混合。
1.4 动物分组、饲养与处理:40只SPF清洁级健康成年KM种雄性小鼠,随机分为4组,10只/组,分组如下:溶剂对照组、低剂量SEM染毒组、中剂量SEM染毒组、高剂量SEM染毒组。溶剂对照组灌胃去离子水,连续6周;SEM 染毒组按30、60、120mg/kg.bwSEM 溶液灌胃体积为10ml/kg·bw,连续灌胃6周。以上各组灌胃溶液的溶剂均用去离子水稀释,各组均每天上午9点至10点进行灌胃,1次/日,各组雄性小鼠均按体重1/10给予全价颗粒饲料分笼喂养,饮水自由。最后一次灌胃24h后,摘取眼球采血,用颈椎脱臼法处死小鼠,对双侧睾丸、附睾进行仔细分离,检测相关生殖指标。
1.5 检测方法和观察指标:迅速夹取一侧新鲜附睾尾置于5mL生理盐水(37℃预热)中,用眼科剪纵向剪开,吸管吹打,37℃水浴中静置5min。用4层擦镜纸过滤,取滤液1mL,用9mL 37℃生理盐水混匀制成10mL精子悬液。将精子悬液放在60℃水浴,时间5min,吸取1滴精子悬液涂片,置于空气中晾干,用甲醇固定、干燥,用1%的伊红Y染液染色,时间30min,用流水冲洗,自然晾干,在400倍油镜下观察1000个精子形态(包括胖头、双头、无钩、不定形、香蕉形、折体、双尾、尾折叠等)。计算畸形率:精子畸形率(%)=[精子畸形总数÷总精子数(1000)]×100。取睾丸实质部分制备组织匀浆液,按试剂盒说明操作分别测定LDH-X、ACP酶的活性量;常规病理学切片,HE染色观察睾丸组织形态学变化。
2 结果
2.1 不同剂量SEM对雄性小鼠睾丸、附睾脏器系数和精子畸形率的影响见表1。高剂量SEM染毒组雄性小鼠睾丸和附睾脏器系数低于溶剂对照组(P<0.05);与溶剂对照组比较,不同剂量SEM染毒组雄性小鼠精子畸形率均增高,差异具有统计学意义(P<0.05);精子畸形主要以弯颈、双头、胖头、不定型、折体、卷尾为主。
表1 不同剂量SEM对雄性小鼠睾丸和附睾脏器系数及精子畸形率的影响()

表1 不同剂量SEM对雄性小鼠睾丸和附睾脏器系数及精子畸形率的影响()
*:P<0.05υs溶剂对照组
组别 例数 睾丸/体(%) 附睾/体(%) 畸形率(%)10 1.80±0.140.51±0.13 1.15±0.13低剂量SEM 染毒组 10 0.87±0.09 0.24±0.07 9.22±0.86*中剂量SEM 染毒组 10 0.85±0.13 0.23±0.12 16.17±0.78*高剂量SEM染毒组 100.798±0.08* 0.22±0.09* 18.16±0.98溶剂对照组*
2.2 不同剂量SEM对雄性小鼠睾丸组织形态学影响:睾丸病理组织学观察显示:溶剂对照组雄性小鼠睾丸曲细精管上皮细胞层次未见异常,外壁光滑无褶皱,曲细精管充实饱满,管腔中无脱落的细胞,管腔中可见到大量成熟精子;低剂量组睾丸部分曲细精管上皮细胞层次排列紊乱,有少许上皮细胞层与基底细胞层部分离甚至缺失脱落,中、高剂量SEM染毒组除了有上述病变外,曲细精管腔扩张,管内细胞排列疏松紊乱,腔内精子稀少甚至无精子(见图1)。

图1 不同剂量SEM对雄性小鼠睾丸组织形态观察。
2.3 不同剂量SEM对雄性小鼠睾丸LDH-X、ACP含量的影响见表2。与溶剂对照组比较,不同剂量SEM染毒组小鼠睾丸组织LDH-X降低、低剂量SEM染毒组小鼠睾丸组织ACP含量升高,差异具有统计学意义(P<0.05)。
表2 不同剂量SEM对雄性小鼠睾丸中LDH-X和ACP酶活性的影响()
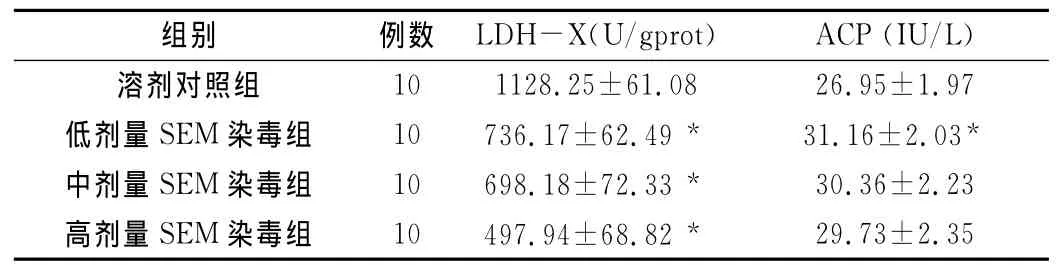
表2 不同剂量SEM对雄性小鼠睾丸中LDH-X和ACP酶活性的影响()
*:P<0.05υs溶剂对照组
10 1128.25±61.08 26.95±1.97低剂量SEM染毒组 10 736.17±62.49* 31.16±2.03*中剂量SEM染毒组 10 698.18±72.33* 30.36±2.23高剂量SEM 染毒组 10 497.94±68.82*29.73±2.35溶剂对照组
3 讨论
不同剂量SEM对雄性小鼠染毒实验形态学结果:睾丸病理组织学检查显示,睾丸部分曲细精管上皮细胞层次排列紊乱,有少许上皮细胞层与基底细胞层部分离甚至缺失脱落,曲细精管腔扩张,管内细胞排列疏松紊乱,腔内精子稀少甚至没有;其中精子的活动度大多降低,精子畸形率不同程度增多,精子畸形主要以弯颈、双头、胖头、不定型、折体、卷尾为主。特别是中、高剂量SEM染毒组雄性小鼠精子畸形率增高更明显。有实验研究证明,睾丸支持细胞是一些睾丸毒物作用的原始靶点。睾丸毒物可以使生精细胞不同程度地从支持细胞上脱落缺失,SEM染毒实验结果也证明,SEM通过灌胃染毒可能对睾丸支持细胞的直接损伤作用和或不同程度影响LDH-X和ACP的活性,从而使生精细胞从支持细胞脱落缺失,干扰精子的生成与成熟,导致染毒雄性小鼠睾丸脏器系数降低,因而影响染毒雄性小鼠的生殖功能。
睾丸中的许多酶在精子发生和精子成熟过程中起着很重要的作用。精子的发生与成熟依赖于其生存内环境的稳定及相关激素和酶类的调节[10]。LDH-X属于糖酵解酶系,主要是生精细胞 )糖代谢产生能量的其中一种酶,主要位于精子细胞胞质、精母细胞、精子尾中段线粒体上,是生精细胞成熟的标志酶之一[11-12];ACP为精子特异酶,是精细胞溶酶体的前体,ACP活性可能与其吞噬功能很有关,可以作为衡量能否有生精功能障碍的指标[13]。
LDH-X主要存在于线粒体上,能进行无氧代谢催化丙酮酸转化为乳酸。因睾丸曲细精管精母细胞粗线后期的各级生精细胞位于睾丸支持细胞的上方,很难直接通过基膜从间质获取营养,而主要通过糖酵解进行,故LDH-X是生精细胞糖代谢产生能量的主要酶,LDH-X活性与生精过程、精子活动、获能及受精有关,因而可以作为预测生精能力的重要指标。如果抑制LDH-X的活性,可能会影响生精细胞生成和成熟,使精子数量减少甚至没有,活动力下降,引起精子畸形率增加,导致雄性生育能力下降。SEM染毒实验结果显示,LDH-X活性降低,其精子数量减少甚至没有、精子畸形率增加。
精液中ACP是前列腺的特征性分泌物,是检验有无精液最敏感的方法。睾丸ACP为支持细胞溶酶体的特异酶,其可催化糖磷酸酯脱磷酸转化成果糖,给精子提供游动的能量。人精浆中富含ACP酶,有实验证实其能抑制NK细胞和中性粒细胞的活性,具有免疫抑制作用,可以使精子在女性生殖道中不被排斥。本实验证明低剂量SEM染毒组能使睾丸ACP活性升高,低剂量SEM染毒组是阻碍精子获得能量和其他活动能力的敏感剂量,有可能是导致雄性生育能力下降甚至不育的重要原因。
综上所述,接触SEM的雄性小鼠,SEM可能是通过影响睾丸组织酶的活性,抑制精子的生成与成熟,直接作用于支持细胞使生精细胞不同程度地从支持细胞上脱落缺失,从而影响雄性小鼠生殖功能。
[1] Maranghi F,Tassinari D,Altieri I,et al.The food contaminant semicarbazide acts as an endocrine disrupter:Evidence from an integrated in vivo/in vitro approach[J].Chemistry Biologe Interact,2010,183(1):40-48
[2] Bendall JG.Semicarbazide is non-specific as a marker metabolite to reveal nitrofurazone abuse as it can form under Hofmann condi-tions[J].Food Additives and contaminants,2009,26(1):47-56
[3] Van Pouke C,Detavernier C,Wille Kwakman,et al.Investigation into the Possible Natural Occurence of Semicarbazide in Macrobrachium rosenbergii Prawns[J].Journal of agricartur and food chemistry,2011,2(7):53-58
[4] Vass M,Diblikova L,Kok E,et al.In-house validation of an ELISA method for screening of semicarbazide in eggs[J].Food Additives and contaminants,2008,25(8):930-936
[5] Maranghi F,Tassinari R,Lagatta V,et al.Effects of the food contaminant semicarbazide following oral administration in juvenile Sprague-Dawley rats[J].Food chemistry Toxicol,2009,47(2):427-429
[6] 王文枝,陈志锋,孙利.包装食品中氨基脲风险评估[J].食品工业科技,2009,30(3):282-283
[7] 朱沙,樊剑鸣,陈宗德,等.氨基脲敏感胺氧化酶对弓形虫感染小鼠组织器官毒性作用研究[J].现代预防医学,2008,35(17):3384-3387
[8] 贾庆军,郭魁亮,刘天鹏等.环磷酞胺染毒小鼠精子形态及精细胞微核变化[J].中国职业医学,2006,33(5):396-397
[9] 李嘉.食品添加剂副产物氨基脲的毒理学研究[D].吉林农业大学,2008,28(3):34-36
[10] 葛秦生.临床生殖内分泌学[M].北京:科学技术文献出版社,2001:789
[11] 王水明,王德文,彭瑞云,等.电磁脉冲辐射对小鼠生精细胞能量代谢的影响[J].中华物理医学及康复杂志,2003,25(9):516-519
[12] 江泉观.雄性生殖毒理学[M].北京:北京医科大学中国协和医科大学联合出版,1994:225
[13] 杨麦贵,杨阳,等.男性不育者精液中一氧化氮和顶体酶、透明质酸酶、酸性磷酸酶的变化[J].检验医学,2005,25(5):431-433
