肝细胞生长因子基因修饰的骨髓间充质干细胞对糖尿病大鼠下肢缺血肌肉损害的保护作用
2013-10-08哈小琴邓芝云董菊子彭俊华李晓云杨志华
哈小琴,邓芝云,董菊子,惠 玲,彭俊华,李晓云,杨志华
糖尿病目前在我国的发病率位居第三位,其导致的肢体血管动脉缺血和缺血性肌肉损伤发病率也日益增高,在病理性缺血截肢的病例中51%是糖尿病性下肢缺血性损伤和动脉硬化闭塞症[1]。其发病机制主要与高血糖引起的代谢紊乱、血管损伤、神经营养障碍、氧化应激等因素有关,但微血管病变导致的肌肉纤维缺血、缺氧是最重要的原因之一[2]。研究表明糖尿病神经肌肉病变是糖尿病最常见并发症之一,严重时可发生肢体坏疽甚至截肢,后果相当严重[3]。当前,组织工程及基因工程技术的迅速发展,细胞治疗和基因治疗的兴起对神经肌肉损伤修复产生了深远的影响。而干细胞由于其具有多向分化潜能备受各国研究人员的关注,其中中胚层来源的间充质干细胞(mesenchymal stem cell,MSCs)可跨胚层分化为各类细胞,如心肌细胞、神经细胞、内皮细胞[4]等,已被国内外学者用于心肌、神经修复等多种疾病的细胞治疗[5-6],但由于单独应用MSCs存在如缺血环境移植细胞不易存活等缺陷,由此需要探索一条MSCs应用的新途径以提高MSCs细胞治疗效果。肝细胞生长因子(hepatocyte growth factor,HGF)是一多功能生长因子,除促进血管新生外[7],对包括肌肉、神经[8]等的器官或组织损伤有一定的修复作用,但存在其单独应用修复保护作用较弱的缺陷。有研究报道将HGF和MSCs联合应用,HGF可以抑制缺血及低营养引起的MSCs细胞凋亡[9],提高移植存活率,同时研究结果也显示MSCs可以作为HGF基因理想的细胞表达载体。因此,本研究采用构建的携带HGF基因的重组腺病毒(Ad-HGF)转染大鼠骨髓MSCs,以实验性2型糖尿病大鼠肢体缺血为模型,观察Ad-HGF修饰的骨髓MSCs对糖尿病大鼠下肢缺血性肌肉损伤的保护作用。
1 材料与方法
1.1 实验动物及主要试剂、仪器 健康成年雄性Wistar大鼠,体重200~220 g,由甘肃省中医学院提供。胰蛋白酶(Gibco公司,美国),低糖 DMEM(DMEM-LG)培养基(Gibco公司,美国),Percoll分离液(Hyclone公司),胎牛血清(FBS,Gibco公司,美国)。高脂、高糖饲料(由兰州军区总医院动物实验中心配制,配方:基础饲料67.5%、蛋黄2.5%、蔗糖20.0%、猪油 10.0%);STZ(Sigma 公司,美国);Ad-HGF(携带HGF基因的重组腺病毒)、Ad-GFP(携带绿色荧光蛋白基因重组腺病毒)由本实验室构建、扩增、纯化。便携式血糖仪(雅培公司,美国);酶标仪(Labsysems公司,芬兰);F24500荧光分光光度计(Hitachi公司,日本);倒置荧光相差显微镜(Olympus);光学显微镜及成像系统(Olympus公司,日本)。
1.2 MSCs体外培养 Wistar大鼠3只,1%的戊巴比妥钠麻醉致死,之后用75%乙醇浸泡消毒;无菌分离股骨、胫骨并剪去两端,用 PBS冲出骨髓,1600 r/min离心8 min,吸弃脂肪;PBS重悬细胞;小心加于60%梯度的Percoll工作液之上,1500 r/min离心30 min;吸管小心吸出白色细胞层,之后PBS重悬细胞,洗2次,1800 r/min离心8 min;用培养基(10%FBS+DMEM-LG+双抗)重悬细胞,接种于细胞培养瓶;24~48 h后换液,去除未贴壁细胞,之后每3天换液1次。7~10 d后贴壁细胞长出明显的细胞克隆,用0.25%胰酶-乙二胺四乙酸(EDTA)消化,按1×105/25 cm2接种培养瓶,记为第一代。本实验使用细胞为传代培养的第3~5代细胞。
1.3 Ad-HGF转染修饰骨髓MSCs及基因表达的检测 将生长旺盛的第3~5代骨髓MSCs以1×106个/孔接种于6孔板,24 h后弃去培养上清,按照最佳转染复数(multiplicity of infection,MOI)100[10],加入含Ad-HGF病毒颗粒的于无血清LG-DMEM培养基,37℃下孵育2 h,吸弃病毒培养基,再加5%FBS的L-DMEM培养基继续培养48 h后备用。酶联免疫吸附法(ELISA)同时检测上清液中HGF表达水平。
1.4 动物模型制备及细胞治疗 取20只健康Wistar大鼠,给予高脂、高糖饲料饲养加小剂量STZ(30 mg/kg)腹腔注射,建立实验性2型糖尿病大鼠模型[11]。选择血糖水平持续为21~24 mmol/L时的大鼠模型16只进行实验。实验当日禁食,1%戊巴比妥钠(30 mg/kg)麻醉,无菌手术暴露左侧后肢股动脉起始端及其分支,并均以细手术线结扎,造成急性后肢缺血。右侧后肢未做手术结扎。并将模型大鼠随机分为2组:Ad-HGF修饰的骨髓MSCs治疗组(1×106个/只,A 组),溶剂对照组(B组),每组8只。将A组于手术后10 min内将修饰细胞一次性分点注射于手术部位四周,具体是在左大腿肌内侧注射3点,左大腿肌外侧注射2点,剂量为0.1 ml/点,B组注射同体积PBS缓冲液。
1.5 组织病理学观察 2组均于手术注射后6周,取结扎后肢的内与外侧肌肉组织标本,行常规组织病理切片染色,光学显微镜下观察。
2 结果
2.1 ELISA法检测 Ad-HGF转染骨髓 MSCs后HGF的表达 将Percol密度梯度分离的骨髓单个核细胞接种培养瓶中,培养4 h后弃去未贴壁细胞,更换新鲜培养液。继续培养72 h时出现纺锤状贴壁细胞,在培养10 d左右时细胞呈克隆样生长,12 d左右达到细胞融合时传代培养,记为P1代细胞。第3代骨髓MSCs呈典型的纤维状细胞结构,形态较均一。在Ad-HGF转染骨髓MSCs后48 h,ELISA法检测培养上清中每1×106个细胞HGF表达水平为(96.57 ±5.26)ng/ml。
2.2 大鼠下肢肌肉的组织学观察结果 病理组织学观察显示,B组大鼠下肢肌肉标本结扎侧肌纤维变性、横纹不清晰;肌纤维及细胞核变细、断裂、染色淡,肌束内水肿,以及出现脂肪;A组大鼠下肢肌肉标本组织中上述病变不明显(图1)。
2.3 大鼠下肢肌束间血管及组织学观察结果 B组大鼠下肢肌束间动脉管壁变厚,管腔变小甚至消失,少见新生的小血管,还可见多处肌纤维变性、横纹不清晰,肌纤维及细胞核变细、断裂、染色淡,肌束内水肿。A组大鼠下肢肌束内中小动脉管壁未见增厚,管壁无缩小,肌束间可见一些新生小血管(图2)。

图1 2型糖尿病模型大鼠下肢肌肉组织学观察(HE×100)
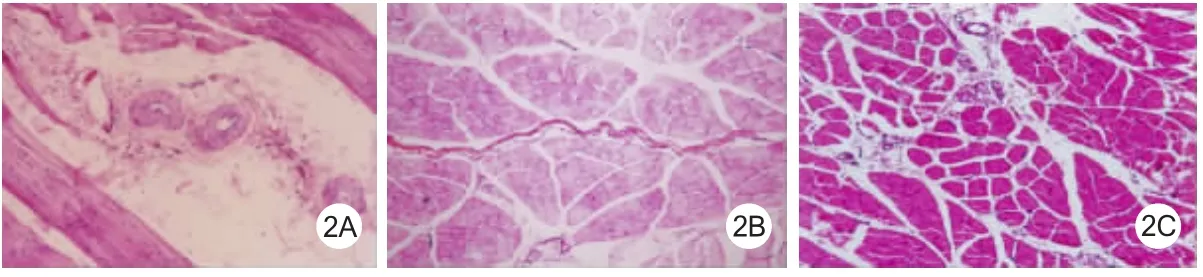
图2 2型糖尿病模型大鼠下肢组织学观察(HE×100)
3 讨论
糖尿病是一组以血糖水平增高为特征,近年来发病率急剧升高的代谢性疾病群。目前全世界约有糖尿病患者2亿,据WHO估计到2030年这一数字将达到3.66亿,中国目前糖尿病患者已超过4000万,已成为世界第二大糖尿病国。随着人口老龄化和肥胖发生率的增加,糖尿病患病率将会日益增加。糖尿病的危害主要在于其慢性并发症,其中血管病变是糖尿病慢性并发症的基础病变[12],也是糖尿病致死的主要原因。
糖尿病肌肉神经病变是糖尿病最常见的并发症之一,其发生率也随着糖尿病发病率的急剧增加而逐年上升,严重影响患者的生活质量。研究表明糖尿病肌肉神经损害的发生可能与患者微血管病变、体内代谢紊乱等因素密切相关,是多因素共同作用的结果[2]。机体微血管病变发生后将影响周围微循环,使肌肉缺血缺氧,进一步引起肌纤维受损[13]。目前虽然治疗药物种类繁多,但尚无确切有效的治疗方法,通常在控制饮食、应用降糖药物的基础上辅以神经系统药物治疗。
当前,随着组织工程和基因工程技术的迅速发展,细胞治疗和基因治疗开始应用在肌肉神经损伤修复中。而干细胞具有多向分化潜能,其中中胚层来源的MSCs,可跨胚层分化为各类细胞。在国内外已有用于心肌[14]、关节缺损[15]、神经修复[16]等多种疾病细胞治疗的报道。另外MSCs作为基因治疗理想的载体细胞,易分离和培养扩增,具有可移植性,易于外源基因转染和表达的特点。HGF作为一种多功能生长因子,除促进血管新生外,对包括肌肉、神经等在内的器官(组织)损伤有一定的修复作用。本研究构建了携带HGF基因的重组腺病毒Ad-HGF,并用其感染修饰骨髓MSCs,将骨髓MSCs作为载体细胞分泌表达一定时间的HGF活性蛋白,使局部移植的Ad-HGF修饰的骨髓MSCs同时发挥HGF蛋白的作用和骨髓MSCs的多向分化潜能。
本研究结果表明,2型糖尿病大鼠被结扎的肢体移植了Ad-HGF修饰的骨髓MSCs后,肌肉组织得到了充分的血液供应,进而肌肉获得了足够的氧气及必需的营养物质,从而促使其恢复因缺氧和营养物质而造成的结构与功能的损伤。本研究组织病理学观察结果也为此提供了形态学依据,结扎股动脉后B组患肢肌肉出现肌纤维变细、断裂或某些肌束中有缺失肌组织以及脂肪组织浸润的现象,A组肌束中则少见这种现象。提示随着血运的逐渐重建,已发生变性的肌肉可能得到了逐渐的修复,肌组织缺失处也会有新生的肌纤维予以补充。因已有报道表明,HGF对能够形成新生肌纤维的肌卫星细胞有刺激增殖的作用[17]。MSCs也在一定环境下可分化为肌纤维细胞而起修复作用[18]。
[1] Akbari C M,Macsata R,Smith B M,et al.Overview of the diabetic foot[J].Semi Vasc Surg,2003,16(1):3-11.
[2] Cameron N E,Cotter M A.Vascular changes in animal models of diabetic neuropathy[J].J Neurochem,2003,85(Suppl 2):14.
[3] 朱憙星.现代糖尿病学[M].上海:复旦大学出版社,2000:333.
[4] Mundra V,Gerling I C,Mahato R I.Mesenchymal stem cell-based therapy[J].Mol Pharm,2013,10(1):77-89.
[5] Grosheva M,Guntinas-Lichius Q,Arnhold S,et al.Bone marrow-derived mesenchymal stem cell transplantation does not improve quality of muscle reinnervation or recovery of motor function after facial nerve transaction in rats[J].Biol Chem,2008,389(7):873-888.
[6] Shin L,Peterson D A.Human mesenchymal stem cell grafts enhance normal and impaired wound healing by recruiting existing endogenous tissue stem/progenitor cells[J].Stem cells Transl Med,2013,2(1):33-42.
[7] Ha X Q,Ren J P,Bi J J,et al.Therapeutic angiogenesis induced by human hepatocyte growth factor gene in dog hindlimb ischemia models[J].Chinese Science Bulletin,2003,48(7):676-680.
[8] Ha X,Liu B,Qian Z,et al.Hepatocyte growth factor gene transfer effects on the fermal and intramuscular nerve in a canine model of lower limb ischemia[J].Neural Regen Res,2008,3(6):625-628.
[9] Forte G,Minieri M,Cossa P,et al.Hepatocyte growth factor affects on mesenchymal stem cells:proliferation,migration,and differentiation[J].Stem Cells,2006,24(1):23-33.
[10] 哈小琴,董芳,吕同德.肝细胞生长因子基因对BMSCs的修饰及活性观察[J].中国修复重建外科杂志,2010,24(5):613-617.
[11] 张汝学,贾正平,王娟,等.实验性2型糖尿病大鼠模型的建立和评价(Ⅰ)——体重、血糖和肝糖原的变化[J].西北国防医学杂志,2007,28(3):161-163.
[12] Yang W,Lu J.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[13] Uchiyama S,Tsukamoto H,Yoshimura S,et al.Relationship between oxidative stress in muscle tissue and weigh-lifting induced muscle damage[J].Pflugers Arch,2006,452(1):109-116.
[14] Ishukane S,Hosoda H,Yamahara K,et al.Allogeneic transplantation of fetal membrane-derived mesenchymal stem cell sheets increases neovascularization and improves cardiac function after myocardial infarction in rats[J].Transplantation,2013[Epub ahead of print].
[15] J Centeno C,D Freeman M.Percutaneous injection of autologous,culture-expanded mesenchymal stem cells into carpometacarpal hand joints:a case series with an untreated comparison group[J].Wien Med Wochenschr,2013[Epub ahead of print].
[16] Wang Y,Xue M,Xuan Y L,et al.Mesenchymal stem cell therapy improves diabetic cardiac autonomic neuropathy and decreases the inducibility of ventricular arrhythmias[J].Heart Lung and Cir,2013[Epub ahead of print].
[17] Sheehan S M,Tatsumi R,Temm-Grove C J,et al.HGF is an autocrine growth factor for skeletal muscle satellite cells in vitro[J].Muscle Nerve,2000,23(2):239-245.
[18] Haghighipour N,Heidarian S,Shokrgozar M A,et al.Differential effects of cyclic uniaxial stretch on human mesenchymal stem cell into skeletal muscle cell[J].Cell Biol Int,2012,36(7):669-675.
