绿色荧光蛋白和胰岛素基因共表达重组腺病毒载体的构建及感染人脐带间充质干细胞的实验研究
2013-10-08惠玲,刘毅,宋枚
惠 玲,刘 毅,宋 枚
间充质干细胞是一群具有多向分化潜能的多能干细胞,这些细胞能分化为脂肪细胞、肌细胞、骨和软骨细胞等中胚层来源的细胞[1]。人骨髓间充质干细胞(human bone mesenchymal stem cells,hBMSCs)由于取材时需行骨髓穿刺,给患者带来痛苦,限制了其在临床的应用。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)可在体外分离、扩增、培养,被腺病毒高效感染,经诱导分化为脂肪细胞,是新的组织工程脂肪种子细胞。有报道表明,胰岛素(insulin,INS)是前脂肪细胞转化为成熟脂肪细胞的关键诱导因子之一[2-4],但胰岛素是否在多能干细胞的脂肪分化过程中发挥作用尚不清楚。本实验构建含人胰岛素基因的腺病毒载体,并将其感染进入hUCMSCs,利用增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)基因实现目的基因在体内外表达的示踪定位,研究胰岛素诱导干细胞脂肪分化的作用及机制,为今后组织工程脂肪的构建与体内回植研究奠定基础。
1 材料与方法
1.1 主要试剂及仪器 含胰岛素基因的原始质粒、pShuttle-GFP-CMV穿梭质粒、pAdxsi重组腺病毒骨架载体、DH5α菌株(北京诺赛基因组研究中心有限公司);限制性内切酶(New England Biolabs公司,英国);T4 DNA连接酶(深圳晶美生物工程有限公司);小牛肠碱性磷酸酶单酯酶(calf intestinal alkaline phosphatase,CIP)、琼脂糖(Promega公司,美国);Trizol、真核转染试剂 Lipofectamine 2000(Invitrogen公司,美国);dNTPs(上海生工生物工程技术服务有限公司);DNA纯化试剂盒(柱离心型)、DNA凝胶回收与纯化试剂盒(柱离心型)、质粒小/中量提取纯化试剂盒(北京威格拉斯生物技术有限公司);DNA Marker DL2000(大连宝生物工程有限公司);人胚肾细胞系HEK293细胞(HyClone公司,美国);CsCl2、DMEM培养基、LG-DMEM培养基、FBS、胰蛋白酶、乙二胺四乙酸二钠(EDTA)(Sigma公司,美国);RT-PCR试剂(QiaGen公司,荷兰)。
1.2 材料 兰州军区兰州总医院妇产科助产师于无菌条件下留取足月产儿富含胶质的脐带20 cm,立即储存于0.9%氯化钠注射液中并及时处理。产妇均知情同意并得到医院伦理委员会批准。
1.3 pShuttle-EGFP-INS重组穿梭质粒的构建与鉴定 将pShuttle-EGFP-CMV穿梭质粒用EcoRI/XhoI酶切,CIP去磷酸化处理,切胶回收5.1 kb载体片段。含目的基因胰岛素的原始质粒用EcoRI/XhoI双酶切,切胶回收约0.6 kb目的基因片段,将制备的穿梭质粒片段和胰岛素片段用T4 DNA连接酶连接。取3 μl连接产物转化DH5α感受态细菌,涂布到卡那抗性固体培养基,37℃培养箱中培养过夜。挑取单克隆菌落接种、扩增,提取质粒。提取的重组穿梭质粒用EcoRI/XhoI酶切,电泳鉴定。
1.4 pAdxsi-EGFP-INS重组腺病毒载体的构建 将pAdxsi载体用I-CeuI和I-SceI双酶切后用CIP做去磷酸化处理,乙醇沉淀法回收;pShuttle-EGFP-INS质粒用I-CeuI和I-SceI双酶切后胶回收EGFP-INS片段;将上述处理好的pAdxsi和EGFP-INS片段用T4 DNA连接酶连接,转化DH5α感受态细菌,挑选单克隆菌落,提取质粒,用XhoI酶切电泳鉴定,鉴定正确后大量扩增重组腺病毒载体。
1.5 重组腺病毒载体的包装、扩增及病毒滴度测定人胚肾细胞系HEK293细胞以5×105个/孔接种于6孔板中,次日,待细胞生长至底面积的80%~90%时,将鉴定正确的pAdxsi-EGFP-INS用PacI限制性内切酶线性化,用Lipofectamine 2000脂质体按其说明书进行转染。当细胞大部分病变后,收集2个孔内的所有细胞及培养液于15 ml离心管中,在干冰、乙醇及37℃水浴反复冻融3次后,3000 r/min离心5 min,收集含病毒的上清液(pAdxsi-EGFP-INS第1代毒种P1),弃沉淀。取2 ml P1代毒种继续感染人胚肾细胞系HEK293细胞,病毒扩增2 d后将脱落的细胞连同培养液收入15 ml离心管中,2000 r/min离心5 min,弃上清,沉淀中加入1 ml ST buffer(含10%血清和2.5%甘油的 DMEM培养液),涡旋混匀。按上述方法,冻融3次,-80℃保存待用。按此方法反复进行病毒扩增及收集。测定OD260,按照公式:VP/ml=OD260 ×1.1 ×1012,计算每毫升制品中病毒颗粒数,TCID50测定病毒滴度[5]。
1.6 pAdxsi-EGFP-INS感染hUCMSCs的初步研究
1.6.1 最适MOI值的筛选研究:原代培养并鉴定的hUCMSCs[6]传至第3代时接种于96孔板中,每孔5000个细胞,设置5个浓度梯度,分别加入病毒上清 0、1、5、10、20 μl,37℃、5%CO2的培养箱培养,1 h后更换为完全培养基。分别于24、72 h通过荧光表达确定病毒的感染效率。
1.6.2 pAdxsi-EGFP-INS感染hUCMSCs及鉴定:实验分两组,将hUCMSCs以2×105个/孔接种于6孔板中,待细胞生长至85%融合时,按照最佳MOI值(100)分别加入含 pAdxsi-EGFP-INS(感染组)和pAdxsi-EGFP(对照组)的无血清 LG-DMEM 1 ml,37℃孵育6 h,期间每15分钟震荡细胞1次,6 h后加入1 ml含10%FBS的LG-DMEM,24 h后更换为含10%FBS的LG-DMEM。每天用荧光显微镜观察荧光蛋白的表达。
1.6.3 qRT-PCR检测胰岛素基因表达:感染组及对照组细胞培养3 d后,应用Trizol法提取细胞总RNA,常规反转录为cDNA,设计INS引物:上游5'-AACACCTGTGCGGCTCTGAC-3',下 游 5'-TTCCACAATGCCACGCTTCT-3',内参基因GAPDH:上游5'-ACCACAGTCCATGCCATCAC-3',下 游 5'-TCCACCACCCTGTTGCTGTA-3'。PCR 反 应 条 件:95℃、2 min,95℃、10 s,60℃、30 s,70℃、45 s,30 个循环。采用ΔΔCt的方法进行相对定量。
1.7 诱导hUCMSCs向脂肪细胞分化 将感染组和对照组hUCMSCs细胞以5×104个/孔的密度接种于12孔板,培养3 d后加入成脂诱导培养液,成脂诱导培养液为含10%FBS、地塞米松10-6mol/L、IBMX 0.5 mmol/L、吲哚美辛 60 μm/L、胰岛素5 mg/L的LG-DMEM培养基,每3或4天换液1次,第18天采用油红O染色,于倒置显微镜下观察脂肪滴的形成情况。
2 结果
2.1 pAdxsi-EGFP-INS重组腺病毒载体的构建、鉴定及包装 构建的pShuttle-EGFP-INS重组穿梭质粒,经 EcoRI/XhoI双酶切电泳鉴定,在 0.6和5.1 kb可见2条带(图 1A),其中 0.6 kb 条带为含有目的基因胰岛素的片段,与预期结果相同。将构建的pAdxsi-EGFP-INS重组腺病毒载体与pAdxsi空载体分别用XhoⅠ酶切,1%琼脂糖凝胶电泳观察显示,pAdxsi由以下 6 个条带组成:14.0、11.8、4.0、2.47、1.45、0.60 kb(图1B),而 pAdxsi-EGFP-INS 由以下 7 个条带组成:14.00、11.80、3.10、2.66、2.47、1.45、0.60 kb(图 1C),结果与预期序列分析相同。将pAdxsi-EGFP-INS用人胚肾细胞系HEK293细胞进行包装,获得的病毒进行扩增,用经典TCID50方法进行滴度测定,获得的病毒滴度达到4×1011pfu/ml。
2.2 pAdxsi-EGFP-INS感染hUCMSCs最佳MOI值的确定及绿荧光蛋白表达情况 pAdxsi-EGFP-INS病毒感染hUCMSCs的最适MOI值约为100,感染效率>95%。当MOI值>100时,感染效率无明显升高(图2)。用最佳MOI值感染hUCMSCs后4 h,感染组及对照组细胞均可观察到绿荧光蛋白表达,48~72 h后表达趋于稳定。两组细胞形态无明显差别,绿荧光蛋白在胞浆及胞核均有表达。qRTPCR检测结果显示感染组INS mRNA的表达量是对照组的431.29倍,表明感染的EGFP-INS在细胞内表达。
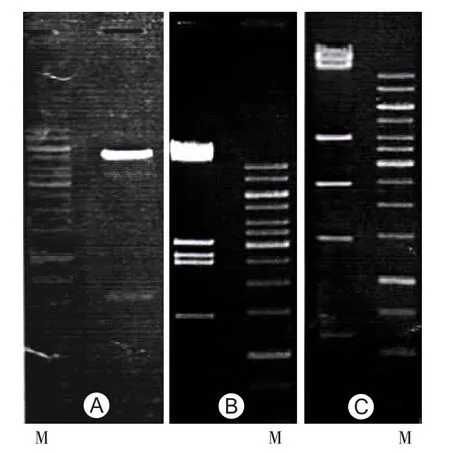
图1 pAdxsi-EGFP-INS重组腺病毒载体的构建、鉴定
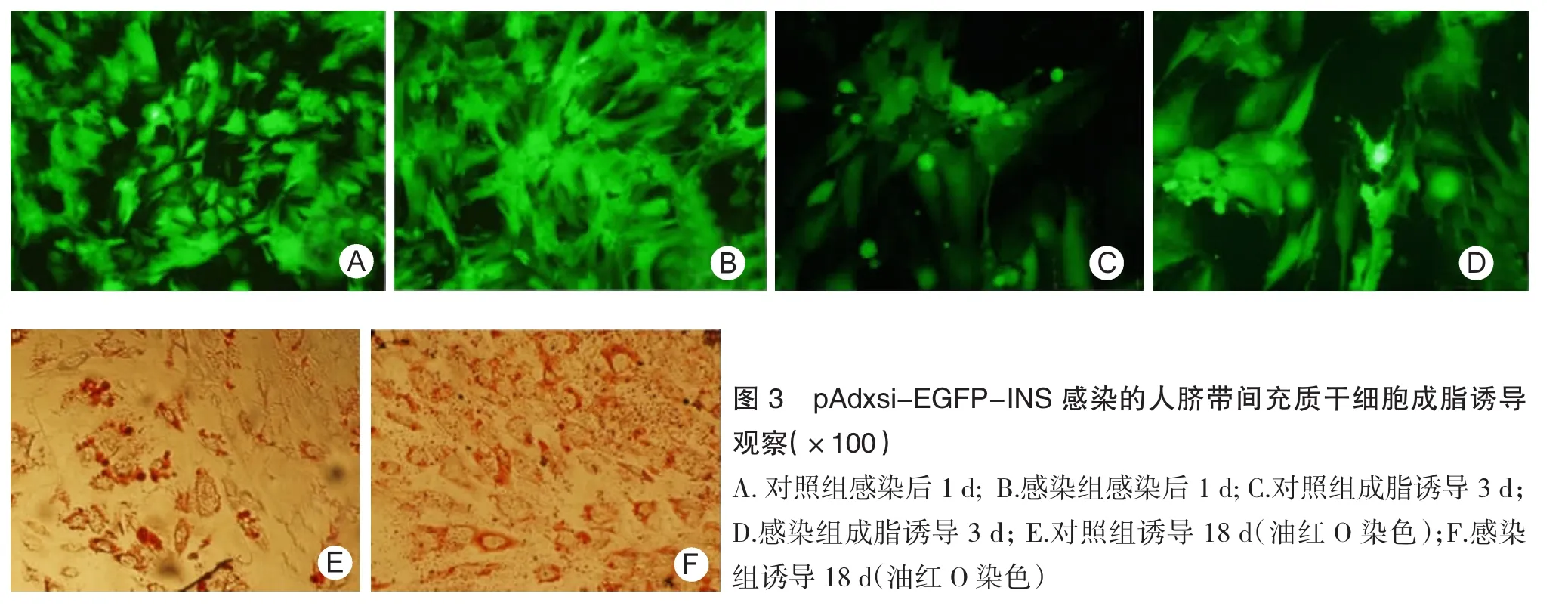
2.3 pAdxsi-EGFP-INS感染对hUCMSCs脂肪分化的影响 感染后1 d,2组均可观察到大量的表达绿荧光蛋白的hUCMSCs(图3A、B),培养3 d后加入成脂诱导培养液,诱导3 d时2组细胞多为铺展的不规则样,相比诱导前细胞体积略有增大,荧光蛋白在胞浆及胞核均有分布(图3C、D);诱导18 d,油红O染色显示2组细胞中有大量脂滴,对照组细胞中的脂滴相对集中,稍大,含有脂滴的脂肪样细胞较少(图3E),而感染组细胞中的脂滴小而分散,含有脂滴的脂肪样细胞明显多于对照组(图3F)。
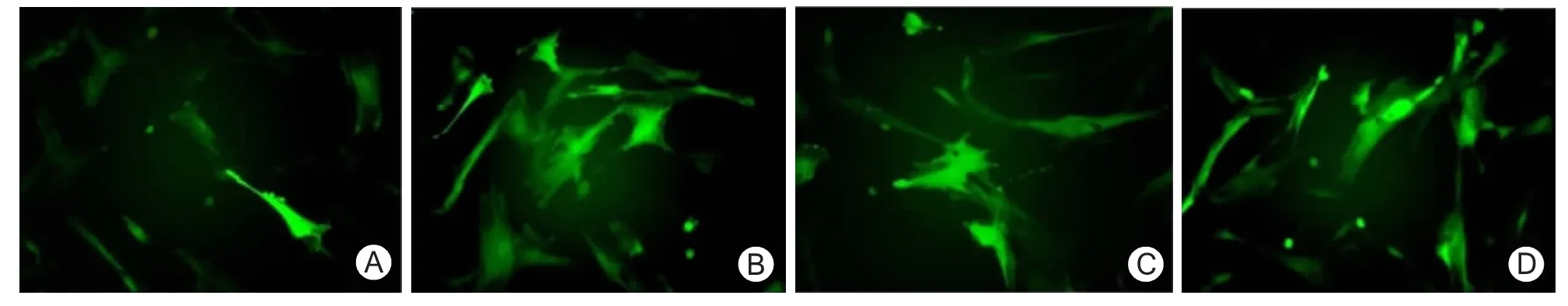
图2 pAdxsi-EGFP-INS感染人脐带间充质干细胞不同MOI值的感染率(×100)
3 讨论
hUCMSCs是多能干细胞,由于其易分离,传代稳定,在体外可快速扩增,传代后3~5 d能增殖4~5倍,传代培养10代以上细胞可增殖510倍,且增殖速度无明显降低,具有“横向分化”或“跨系分化”的能力,可以在地塞米松、抗坏血酸、胰岛素等不同诱导条件下,在体外分化为多种组织细胞(如神经细胞、脂肪细胞及心肌细胞等)而成为干细胞再生医学及组织工程新的种子细胞之一[7-8]。
因为腺病毒可将自身的基因组递送到细胞核中,并且高效率地复制,所以腺病毒成为表达和传递治疗基因的主要候选者。腺病毒载体转基因效率在体外实验研究中接近100%,可转导不同类型的人组织细胞,不受靶细胞是否为分裂细胞所限,进入细胞内并不整合到宿主细胞基因组,仅瞬间表达,安全性高。因而,腺病毒载体在基因治疗临床试验方面有了越来越多的应用,成为继反转录病毒载体之后广泛应用且最具前景的病毒载体[9]。本实验选用的pAdxsi-EGFP腺病毒系统是以Ad5血清型E1/E3缺陷型腺病毒DNA为骨架的复制缺陷型重组腺病毒系统,克隆阳性率高、滴度高,当MOI值为100时,携带绿色荧光蛋白基因的重组腺病毒体外感染hUCMSCs的效率可达到90%以上,能成功地将目的基因胰岛素递送到目标细胞。
胰岛素是一种具有多种生物学效应的激素,除了可以调节葡萄糖转运、脂代谢及肝糖原合成外,在细胞分化、细胞增殖、脂肪细胞脂滴积累、脂肪溶解调节等方面发挥重要作用[10-12]。Klemm 等[13]研究发现胰岛素及其下游信号分子胰岛素受体底物-1(IRS-1)、PI3K-Akt和CREB参与胰岛素诱导的脂肪形成。胰岛素通过与细胞膜上的胰岛素受体结合诱导受体β亚单位的磷酸化并激活酪氨酸蛋白激酶,被激活的β亚单位进而使IRS-1酪氨酸残基磷酸化,活化的IRS-1可与各种连接物蛋白结合,调节代谢,促进细胞生长增殖[14]。6种胰岛素类似物对3T3-L1前脂肪细胞有不同程度的诱导分化,可以促进细胞向成熟脂肪细胞分化[15],说明胰岛素在脂肪细胞的成熟分化中有重要作用。同时也有研究报道,来源于骨髓基质细胞的前脂肪细胞株PA6向成熟脂肪细胞的分化不需要胰岛素的诱导,但胰岛素受体IR及IPS-1的mRNA在PA6细胞成脂分化中表达,胰岛素可以诱导PA6细胞中脂肪分化相关蛋白Erks、Akt、p70的磷酸化,并促进2-脱氧-葡萄糖的吸收,提示脂肪形成过程中胰岛素信号通路在骨髓来源的PA6细胞与髓外来源的脂肪细胞如(3T3-L1)不同[16]。
目前利用体外培养的细胞来研究脂肪细胞的分化机制主要集中于细胞的终末分化阶段,但对于脂肪细胞决定前的分化调节机制仍不清楚。作为干细胞成脂分化中的一种重要的成脂诱导剂,胰岛素在多能干细胞成脂分化中的作用尚不清楚。本研究构建了胰岛素腺病毒表达载体并感染培养的hUCMSCs,并进行了初步的体外诱导成脂实验,观察到感染组hUCMSCs在成脂诱导剂诱导下分化为脂肪样细胞,细胞中出现了大量的小脂滴,含有小脂滴的细胞数量多,而对照组hUCMSCs中的脂肪样细胞数量少,细胞中的脂滴较大但量少,提示胰岛素感染对干细胞的成脂分化有影响,但具体机制需进一步深入研究。在后续实验中,我们还将携带有胰岛素的hUCMSCs与可降解的生物支架材料(如PLGA等)联合应用进行组织工程脂肪构建,研究移植细胞分泌的胰岛素对移植细胞的成脂是否有促进作用。
[1] D'souza N,Burns J S,Grisendi G,et al.MSC and Tumors:homing,differentiation,and secretion influence therapeutic potential[J].Adv Biochem Eng Biotechnol,2012(19)[Epub ahead of print].
[2] Kwon J Y,Seo S G,Yue S,et al.An inhibitory effect of resveratrol in the mitotic clonal expansion and insulin signalingpathway in the early phase of adipogenesis[J].Nutr Res,2012,32(8):607-616.
[3] Bluher M,Wilson Fritch L,Leszyk J,et al.Role of insulin action and cell size on protein expression patterns in adipocytes[J].J Biol Chem,2004,279(30):31902-31909.
[4] Blüher M,Patti M E,Gesta S,et al.Intrinsic heterogeneity in adipose tissue of fat-specific insulin receptorknock-out mice is associated with differences in patterns of gene expression[J].J Biol Chem,2004,279(30):31891-31901.
[5] Lin H T,Tsai H Y,Liu C P,et al.Comparability of bovine virus titers obtained by TCID 50/ml and FAID 50/ml[J].J Virol Methods,2010,165(1):121-124.
[6] Liu Y,Xue M.Recombinant human insulin gene lentivirus transfecting human umbilical cordmesenchymal stem cells in vitro[J].Chinese Journal of Reparative and Reconstructive Surgery,2010,24(7):822-827.
[7] Tsai P J,Wang H S,Shyr Y M,et al.Transplantation of insulin-producing cells from umbilical cordmesenchymal stem cells for the treatment of streptozotocin-induced diabetic rats[J].J Biomed Sci,2012(19):47.
[8] Wang H S,Shyu J F,Shen W S,et al.Transplantation of insulin-producing cells derived from umbilical cordstromal mesenchymal stem cells to treat NOD mice[J].Cell Transplant,2011,20(3):455-466.
[9] Zhuang K X,Huang W,Yan B.Establishment and expression of recombinant human glial cell line-derived neurotrophicfactor and TNF-α receptor in human neural stem cells[J].Asian Pac J Trop Med,2012,5(8):651-655.
[10] Arufe M C,Lu M,Lin R Y.Differentiation of murine embryonic stem cells to thyrocytes requires insulin and insulin-likegrowth factor-1[J].Biochem Biophys Res Commun,2009,381(2):264-270.
[11] Yu B,Zhang Z,Deng X,et al.Involvement of insulin in early development of mouse one-cell stage embryos[J].Sci China C Life Sci,2008,51(9):767-773.
[12] Hennige A M,Sartorius T,Tschritter O,et al.Tissue selectivity of insulin detemir action in vivo[J].Diabetologia,2006,49(6):1274-1282.
[13] Klemm D J,Leitner J W,Watson P,et al.Insulin-induced adipocyte differentiation.Activation of CREB rescues adipogenesis from the arrest caused by inhibition of prenylation[J].J Biol Chem,2001,276(30):28430-28435.
[14] Morito S,Yaguchi K,Imada M,et al.Insulin signaling in adipocytes differentiated from mouse stromal MC3T3-G2/PA6 cells[J].Biol Pharm Bull,2005,28(11):2040-2045.
[15] García Escobar E,Rodríguez Pacheco F,Haro Mora J J,et al.Effect of insulin analogues on 3t3-l1 adipogenesis and lipolysis[J].Eur J Clin Invest,2011,41(9):979-986.
[16] Gurriarán Rodríguez U,Al Massadi O,Crujeiras A B,et al.Preproghrelin expression is a key target for insulin action on adipogenesis[J].J Endocrinol,2011,210(2):R1-R7.
