N1或N3-单取代炔丙基或烯丙基-5-氟尿嘧啶的合成方法研究进展
2013-10-08建胡惟孝单
孙 建胡惟孝单 尚
(1.浙江工业大学化学工程与材料学院,浙江 杭州 310032;2.浙江工业大学药学院,浙江 杭州 310032)
1 引言
5-氟尿嘧啶(5-Fu)及其衍生物在药物化学领域一直是人们研究的热点。近20年来大量的结构修饰主要集中在对5-氟尿嘧啶N-1和N-3位的修饰,并且产生了许多具有生理活性的试剂[1-20]。 其中,5-氟尿嘧啶-异噁唑啉/异噁唑/三唑双杂环化合物频繁的被报道具有潜在的抗菌、抗病毒以及抗癌活性[1-3]。例如,5-氟尿嘧啶N-1位连接的三唑多杂环化合物1被报道具有抗菌活性[1],三唑化合物2被报道具有潜在的抗HIV活性[2]。
这些双杂环核苷类似物均可由N1炔丙基或烯丙基取代的-5-氟尿嘧啶与腈氧化物或叠氮偶极子进行1,3-偶极环加成反应得到。例如,双杂环核苷类似物 3[4], 4[5]和 5[2]的合成(Sheme 1)。
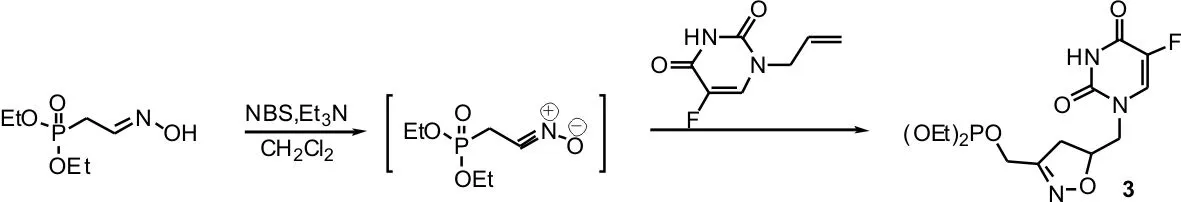


同理,N3-异噁唑啉/异噁唑/三唑取代的双杂环-5-氟尿嘧啶衍生物也可由相应的N3-炔丙基/烯丙基取代的5-氟尿嘧啶与腈氧化物或叠氮偶极子进行1,3-偶极环加成反应得到。由于这些双杂环化合物潜在的生理及药物应用价值,因此设计一种通用有效的合成N1或N3-单取代炔丙基或烯丙基-5-氟尿嘧啶的方法显得尤为重要。
2 N1或N3-单取代炔丙基或烯丙基-5-氟尿嘧啶的合成方法
2.1 直接取代合成法
文献中报道的直接合成N1-烯丙基-5-氟尿嘧啶的方法主要有以下5种:
(1)在5-氟尿嘧啶与溴丙烯的DMSO混合溶液中,以K2CO3作碱,以NaI作催化剂通过加热反应得到[6](Scheme 2):
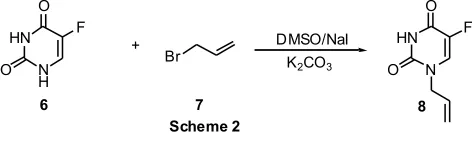
在此反应条件下 (DMSO作反应溶剂,K2CO3作碱时),当使用的烷基化试剂为不活泼的卤代烃时反应产物以N3烷基化产物为主;当使用的卤代烃为活泼卤代烃时反应产物则以N1烷基化产物为主。此法的主要缺点是产率低,由于使用了DMSO作为反应溶剂造成了后处理困难。
(2)以K2CO3作碱,通过5-氟尿嘧啶与溴丙烯在DMF溶液中室温反应制备[7](Scheme 3):
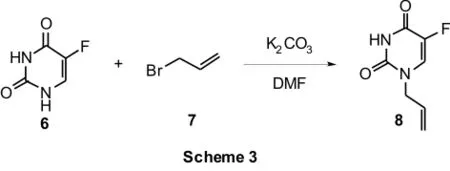
与(1)中所描述的方法相类似,5-Fu首先要与K2CO3作用生成糊状物,但是反应所需的时间远较前者长,生成钾盐的过程通常需要在室温条件下经过数天的搅拌才能完成。虽然单烯丙基取代产物和双烯丙基取代产物的总产率达到了73.9%,但是,其中只有32.4%为单烯丙基取代产物。反应产物中单双烯丙基取代产物的摩尔比值随K2CO3及溴丙烯用量而不断发生变化(Table 1)。

Table 1 产物中N1,N3-双烯丙基取代产物与N1-烯丙基取代-5-氟尿嘧啶的摩尔比
(3)以NaH作碱,通过5-氟尿嘧啶与溴丙烯在DMF溶液中搅拌反应制备[8](Scheme 4):

通常认为5-氟尿嘧啶的N1上的H远较N3位上的H活泼,所以N1,N3-二烯丙基取代-5-氟尿嘧啶是以NaH做碱制备N1-烯丙基-5-氟尿嘧啶时的唯一副产物,抑制副反应的关键是控制反应温度(Table 2):

Table 2.NaH作碱时,温度对5-氟尿嘧啶与溴丙烯反应结果的影响
(4)以Pd(PPh3)4/dppf作混合催化剂,催化5-氟尿嘧啶与3-乙氧基丙烯反应制备N1-烯丙基取代-5-氟尿嘧啶[9](Scheme 5):

此法虽然是一种制备N1-烯丙基-5-氟尿嘧啶的新方法,但是产率仅有52%,且反应中所用的催化剂不易制备,限制了它的应用。
(5)另外一种新的用于制备N1-烯丙基-5-氟尿嘧啶的方法是以TsIm作催化剂催化5-氟尿嘧啶与烯丙醇反应制备N1-烯丙基-5-氟尿嘧啶[10](Scheme 6):
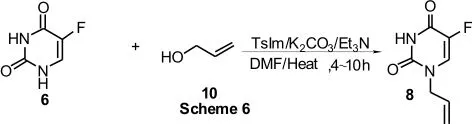
该反应的产率只有54%,后处理困难,同时TsIm不易购得,进一步应用受到了限制.
文献中报道的通过直接取代的方式制备N1-炔丙基-5-氟尿嘧啶的方法有以下两种:
(1)以NaH作碱,通过5-氟尿嘧啶与溴丙炔在DMF溶液中室温反应制备[1](Scheme 7):

(2)以K2CO3作碱,通过5-氟尿嘧啶与溴丙炔在DMF溶液中室温反应制备[2](Scheme 8):

以上两种制备N1-单烯丙基或炔丙基取代-5-氟尿嘧啶的产率分别为73%[1]和52%[2]且均具有操作简单,后处理方便的特点,是合成该类化合物的一种比较理想的方法。
2.2 间接取代合成法

5-氟尿嘧啶直接烷基化的结果是产生N-1或者是N-3烷基化的产物,也可能是双烷基化产物,这主要取决与反应底物以及反应条件的不同。Michel等利用4-位S原子取代的5-氟尿嘧啶,经S原子烷基化、N1烷基化以及 HCl和CH3OH脱保护等步骤间接合成了N1炔丙基/烯丙基取代的5-氟尿嘧啶[11](Scheme 9)。
2.3 N保护法制备炔丙基/烯丙基-5-氟尿嘧啶
5-氟尿嘧啶嘧啶衍生物合成过程中常用的N保护基包括苯甲酰基[20,21]、三氯乙氧甲酰基[3]、苄氧甲酰基[12]、苄基[22]和二苯甲基[23]等。但是,大多数保护基都存在保护和脱保护困难等问题。
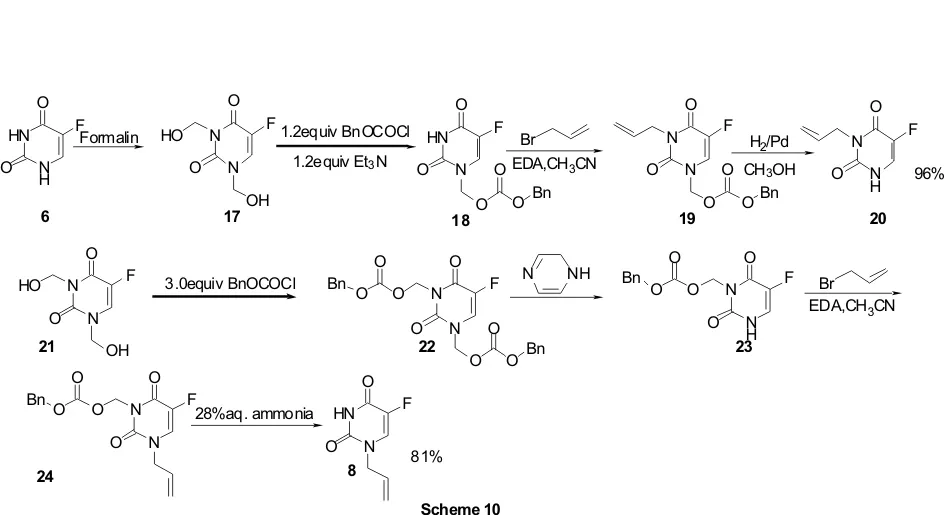
Nagase等[12]报道了一种利用苄氧甲酰基作为N保护基制备N1或N3烯丙基取代-5-氟尿嘧啶的方法 (Scheme 10)。
3 结束语
N1-炔丙基或烯丙基取代-5-氟尿嘧啶是一种重要的药物合成中间体,文献中报道的也比较多(N3-烯丙基取代-5-氟尿嘧啶也有文献报道),近年来其在有机合成中的应用也越来越广泛。但是,文献中并未报道过有关N3-炔丙基-5-氟尿嘧啶的合成方法,鉴于此类化合物的重要应用,因此开发一种新的、有效的合成N3-炔丙基-5-氟尿嘧啶的合成方法是很有价值的。
[1]Wael A,El-Sayeda,Adel A H,et al.Copper-catalyzed Synthesis and Antimicrob ial Activity of Disubsti tuted 1,2,3-Triazoles Starting from 1-Propargyluracils and Ethyl(4-Azido-1,2,3-trihydroxybutyl)furan-3-carboxylate[J].Zeitschrift fuer Naturforschung,B:A Journal of Chemistry Science.2010,65:57-66.
[2]Lazrek H B,Taourirte M,Oulih T,et al.Synthesis and Anti-Hiv Activity of New Modified 1,2,3-Triazole Acyclonucleosides.Nucleosides&Nucleotides&Nucleic Acids[J].2001,20:1949-1960.
[3]Shionogi.5-Halouracils:JP,570322271[P],1982-02-20.
[4]Giovanni R,Daniela I,Anna P,et al.Synthesis and biologicalevaluation ofphosphonated dihydroisoxazole nucleosides[J].Bioorganic&Medicinal Chemistry.2006,14:3818–3824.
[5]C Ugo,G Filippo,I Daniela,et al.Diastereoselective synthesis of homo-N,O-nucleosides[J].Tetrahedron,2004,60:441-448.
[6]Baker B R,Jackson G D F.Nonclassical Antimetabolities XXIV[J].Journal of Pharmaceutical Sciences,1965,54:1758-1762.
[7]Nitya G K,Scott A S.N-Alkylated Derivatives of 5-Fluorouracil[J].Journal of Pharmaceutical Sciences,1982,71:935-938.
[8]杨联明,郑国秀.自由基官能团化聚合合成主链挂嘧啶碱基的聚合物[J].功能高分子学报,1996,9:90-96.
[9]Franck A,Steven P N,Raymond F S,et al.Efficient synthesis of various acycloalkenyl derivatives of pyrimidine using cross-metathesis and Pd(0)methodologies[J].Tetrahedron,2005,61:537-544.
[10]Mohammad Navid Soltani Rad,Ali Khalafi-Nezhad,Somayeh Behrouz Mohammad Ali Faghihi,et al.One-pot synthesis of N-alkyl purine and pyrimidine derivatives from alcohols using TsIm:a rapid entry into carboacyclic nucleoside synthesis[J].Tetrahedron,2008,64:1778-1785.
[11]MichelG,KjellU.RegioselectiveN-Alkylationin5-Fluorouracil[J].Acta Chemica Scandinavica,Series B:Organic Chemistry and Biochemistry.1979,B33:515-18.
[12]T Nagase,K Seike,K Shiraishi,et al.Application of the[[(benzyloxy)carbonyl]oxy]methyl moiety to a protective group of 5-Fluorouracil.Selective alkylation of amide nitrogen of the uracil ring[J].Chemistry letters,1988,1381-1384.
[13]David R A,Alan S F B,Fergusona R,et al.Heterocyclic Nucleosede Analogues by Cycloaddition Reactions of 1-Vinylthymine with 1,3-Depoles[J].Nucleosides&Nucleotides,1998,17:1053-1075.
[14]Michel G,Kjell U.Regioselective N-Alkylation in 5-Fluorouracil[J].Acata Chemica Scandinavica B,1979,33:515-518.
[15]Tourirte M,Oulih T,Lazrek H B,et al.Synthesis of 30-Deoxy-30-[4-(pyrimidin-1-yl)methyl-1,2,3-triazol-1-yl]thymidine via 1,3-Dipolar Cycloaddition[J].Nucleosides&Nucleotides&Nucleic Acids.2003,22:1985–1993.
[16]Tetsuji K,Kazuo K,Mineharu H,et al.Studies on the Synthesis of Chemotherapeutics.10.Synthesis and Antitumor Activity of N-Acyl-and N-(Alkoxycarbonyl)-5-fluorouracil derivatives[J].Journal of Medicine Chemistry,1980,23,1324-1329.[17]Tetsuji K,Kazuo K,Mineharu H,et AL.Studies on the Synthesis of Chemotherapeutics1.Synthesis and Antitumor Activity of N-Phthalidyl-5-fluorouracil derivatives[J].Journal of Medicine Chemistry,1982,25,1219-1222.
[18]Ugo C,Daniela I,Anna P,et al.Synthesis of pyrimidinecontaining 3-aminobutenolides[J].Tetrahedron,2004,60:6593–6596.
[19]Ugo C,Maria G S,Lia C,et al.Enantioselective synthesis of homocarbocyclic-2'-oxo-3'-azanucleosides[J].Tetrahedron.2006,62:1171–1181.
[20]Helene M L,Dominique D,Gilles L,et al.Preparation of benzylpyrimidines for use as thymidine monophosphate Kines(TMPK)inhibitors:WO,2006048336[P].2005.
[21]Lee Y S,Kim B H.Heterocyclic Nucleoside Analogues:Design and Synthesis of Antiviral,Modified Nucleosides Containing Isoxazole Heterocycles[J].Bioorganic&Medicinal Chemistry Letters,2002,12:1395–1397.
[22]Sanyal U,Chakraborti S K.On the Alkylation of 5-Fluorouracil-some recent findings[J].India Synthetic communications,1982,12:1047-1054.
[23]Wu Fan,Musole G,Buhendwa D F,et al.Benzhydryl as an Efficient Selective Nitrogen Protecting Group for Uracils[J].Journal of Organic Chemistry,2004,69:9307-9309.
