高铁酸钾/254nm紫外光协同氧化降解水体中硝基苯
2013-09-28李迪璇朱承驻彭书传
李迪璇, 胡 喆, 朱承驻, 彭书传
(合肥工业大学 资源与环境工程学院,安徽 合肥 230009)
硝基苯是染料、香料等有机合成工业行业的重要原料,结构稳定,较难降解,特别是进入水体后会以油状物沉入水底,并随地下水渗入土壤[1-2],造成的水体和土壤污染会持续相当长的时间,因此,我国已将它列为优先控制的环境污染物[3-4]。
高铁酸钾因具有较强的氧化作用,近年来,其作为一种新型非氯高效消毒及水处理药剂而引起广泛的关注[5-9]。文献[10]用高铁酸盐处理水处理剩余污泥中的恶臭物质,结果表明导致恶臭的氨可以被高铁酸盐氧化成硝酸盐,硫化物可被氧化成硫酸盐;文献[11]研究了高铁酸钾氧化处理二级深度处理的出水或Mill-Q超纯水制备系统的缓冲水中的苯并三唑的动力学模型及反应机制,发现当Fe(VI)与苯并三唑的摩尔比达到30∶1时,苯并三唑的去除率可达95%以上;文献[4]利用化学法制备高铁酸钾并考察了其对硝基苯废水的处理效果,实验结果表明,在pH=7,自制的高铁酸钾与硝基苯的质量比为25∶1,反应时间20min时,硝基苯的CODCr的去除率可达88%。但目前对于高铁酸钾/UV联用降解水体中的有机污染物方面则鲜见报道。本文系统地研究了通过254nm紫外光与高铁酸钾联用技术协同氧化降解硝基苯水溶液,考察了反应体系中各因素对硝基苯CODcr降解效果的影响及其反应动力学,初步推测了硝基苯的降解过程,以期为高铁酸盐在实际污水处理中的应用提供技术参考。
1 材料与方法
1.1 试剂
硝基苯(分析纯,国药集团化学试剂有限公司);硫酸亚铁铵(分析纯,广东汕头市西陇化工厂);重铬酸钾(优级纯,上海青析化工科技有限公司);浓硫酸(分析纯,天津大茂化学试剂);氢氧化钠(分析纯,广东精细化学品工程技术研究开发中心);硫酸银(分析纯,天津市光复精细化工研究所);硫酸汞(分析纯,姜堰市环球试剂厂)。
实验所用高铁酸钾(K2FeO4)来自武汉富鑫远科技有限公司,使用前进行如下步骤的纯化:将K2FeO4用少量的饱和KOH溶液溶解,将K2FeO4溶液置于冰水中结晶,然后抽滤得到固体,再用异丙醇洗涤,真空干燥、避光保存[4]。
1.2 实验仪器与装置
254nm紫外灯管外径16mm,功率为5W;PHS-3C型酸度计(上海雷磁仪器厂);数显恒温磁力搅拌器(金坛市杰瑞尔电器有限公司);紫外分光光度计(UV-1750型,日本Shimadzu)。
降解装置如图1所示。
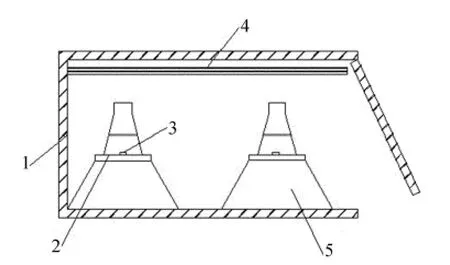
图1 实验装置图
1.3 实验方法
取一定质量浓度的模拟硝基苯废水溶液100mL于烧杯中,根据需要用稀硫酸和稀氢氧化钠溶液调节溶液初始pH值,然后加入一定量的高铁酸钾,在不断搅拌的条件下,进行高铁酸钾氧化、254nm紫外光光解及254nm紫外光/高铁酸钾协同降解实验,反应进行一定时间后,用重铬酸钾法测定处理液的CODCr:

其中,COD0和CODt分别为处理前后水样的CODCr值。
2 结果与讨论
2.1 高铁酸钾投加量对降解效果的影响
在pH=7的条件下,取3组体积为100mL、质量浓度为125mg/L硝基苯溶液,在不断搅拌的条件下按照高铁酸钾与硝基苯的质量比为2∶1、4∶1、6∶1、8∶1、10∶1投加高铁酸钾固体,考察CODCr去除率随高铁酸钾用量增大的变化趋势,结果如图2所示。

图2 高铁酸钾投加量对硝基苯CODCr降解率的影响
由图2可知,在pH=7时,在UV/高铁酸钾协同体系中硝基苯的去除率最高达86.71%,与高铁酸钾单独作用相比,协同体系中CODCr去除率提高了15%左右;而在紫外光单独作用下,去除率基本不随投加量而变化,且保持在1%~3%。比较3条曲线可知,中性条件下,高铁酸钾+UV曲线中硝基苯的去除率大于其他2条曲线的两者之和。这表明紫外光和高铁酸钾在氧化降解硝基苯时,两者之间存在协同效应。这可能是因为硝基苯的紫外吸收谱在254nm处有吸收,由光化学反应定律和Proper定律,254nm光子可使硝基苯分子中的C—NO2键断裂,使溶液中C6H5NO2有部分解离[12]。
因—NO2是吸电子基团,并考虑硝基苯的空间位阻,高铁酸根与硝基苯主要作用的位置可能是苯环上硝基对位的氢原子。从而根据文献[4,12-15]可发生如下反应:
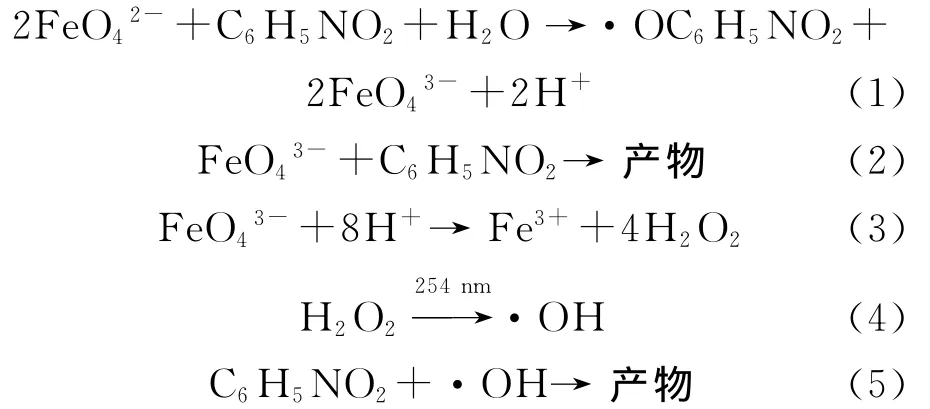
比较图2中曲线的去除率可知,在254nm紫外光/高铁酸钾协同体系和单独高铁酸钾作用下,增加高铁酸钾用量均会提高硝基苯的去除率,且在协同体系中这一提高效果更加显著。
2.2 溶液pH值对降解效果的影响
取3组质量浓度为125mg/L的硝基苯水样,水样体积为100mL,调节不同pH值,在各个水样中加入高铁酸钾125mg,反应时间为30min,反应结束后测定其CODCr值,结果如图3所示。

图3 溶液初始pH值对硝基苯CODCr降解率的影响
由图3可知,在整个pH值变化范围内,紫外光和高铁酸钾协同作用对硝基苯CODCr的去除率均高于高铁酸钾及紫外光单独作用。随着pH值增大,单独254nm光解的降解率,由于仅受光子的解离作用而基本不随pH值的变化而变化;高铁酸钾及254nm/高铁酸钾2个体系的降解率均是先升高,后下降,在中性条件下达到最大值。这可能是因为随着pH值的增加,高铁酸根稳定性增加但氧化电位降低。酸性条件下,FeO42-氧化还原电位为2.20V[4],但酸性越强,其分解速率越不稳定,影响其氧化降解效果;而在碱性条件下FeO42-稳定性增加,但其氧化性较弱(0.72V)[16],而且OH-是·OH 的强猝灭剂[12],故在碱性条件下的降解效率也较差。这与文献[4]报道的高铁酸钾氧化降解硝基苯的结果一致。
2.3 反应时间对降解率的影响
取3组100mL质量浓度为125mg/L的硝基苯水样,pH=7的条件下,加入125mg高铁酸钾,控制反应时间为10、20、30、40、50min。反应完后测定硝基苯水样不同时刻的CODCr值,结果如图4所示。
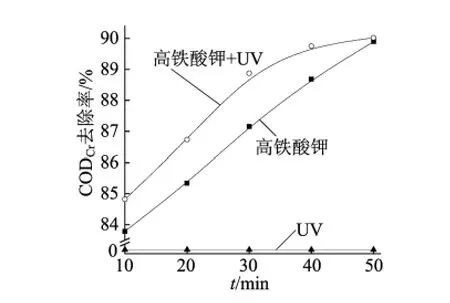
图4 反应时间对硝基苯CODCr降解率的影响
由图4可见,高铁酸钾和254nm/高铁酸钾协同作用对硝基苯CODCr的去除率均随时间增加而上升,且254nm/高铁酸钾协同作用优于高铁酸钾及紫外光单独作用的效果,而紫外光单独作用时则不随时间变化,基本保持3%不变。当反应时间为50min时,高铁酸钾和254nm/高铁酸钾协同作用下的硝基苯的CODCr去除率均可达到90%以上。随着时间的增加,反应液紫色逐渐变淡,当反应进行到50min时,反应液紫色消失变为红褐色,此时高铁酸根已与硝基苯反应完全。
2.4 硝基苯初始质量浓度对降解率的影响
分别配制25、50、75、100、125mg/L不同质量浓度的硝基苯水样,测定其原始CODCr值,保持水样pH=7,分别加入30mg的高铁酸钾,反应30min后,测定其反应后的CODCr值,其结果如图5所示。
由图5知,整个硝基苯质量浓度变化范围内,紫外光/高铁酸钾协同作用对CODCr的去除率均高于高铁酸钾及紫外光单独作用。从动力学的角度看,反应物初始质量浓度越高,反应推动力越大[17]。
高铁酸根对硝基苯的降解过程中并非单纯的高铁酸根与硝基苯2个分子之间的反应,而是生成了自由基后的链状反应[15]。当硝基苯质量浓度增加时,单位体积内的硝基苯分子数增加,但相同条件下高铁酸根离子的分子数不变,反应生成的自由基浓度并没有增加,其碰撞几率随着硝基苯质量浓度的增加反而减小,因此硝基苯质量浓度增加时,其降解率反而降低。

图5 硝基苯质量浓度对硝基苯CODCr降解率的影响
2.5 最佳降解条件的正交实验
在上述实验的基础上,高铁酸钾投加量选取25、75、125mg,pH 值选取11、7、3,100mL硝基苯,其初始质量浓度选取25、75、125mg/L,反应时间选10、30、50min,在有紫外光照射,温度为室温(25℃)的条件下进行正交试验,实验结果表明对硝基苯CODCr去除率的影响因素从大到小依次为:高铁酸钾投加量>硝基苯质量浓度>pH值>反应时间。
满足CODCr去除率最佳条件为:高铁酸钾为125mg、pH值为7、反应30min和硝基苯质量浓度为25mg/L,降解效率达到92%。
2.6 高铁酸钾降解硝基苯的UV-Vis分析
图6所示为254nm紫外光/高铁酸钾协同降解硝基苯水溶液,经过不同反应时间后的UVVis图谱。经对比分析可以看出,未处理的硝基苯水样在270nm处出现硝基苯特征吸收峰,经处理后硝基苯的特征峰则随反应时间增加而降低,至50min时特征峰则很微弱,这说明在高铁酸盐钾/紫外光的协同氧化作用下,水溶液的硝基苯发生了开环反应,到50min时水溶液中的硝基苯已反应较为彻底。
图7所示为硝基苯水溶液在是否加紫外光光照下经高铁酸钾氧化处理50min后的UV-Vis变化对比图。
图7表明,无UV条件下的曲线在250nm附近处有一微弱的特征峰,这可能是在单纯高铁酸钾氧化处理过程中,硝基苯发生开环反应不完全或发生取代反应,产生了苯环类的物质[12]。而254nm紫外光/高铁酸钾的协同作用则表现出了比单独高铁酸钾更强的氧化能力和对硝基苯更好的去除能力。

图6 高铁酸钾降解硝基苯的UV-Vis图

图7 有/无UV条件下反应后产物的UV-Vis对比图
2.7 CODcr降解反应动力学
对高铁酸钾/紫外光氧化降解硝基苯的水溶液采用二级反应动力学进行模拟,结果如图8所示。
对试验点拟合可以得到,在254nm紫外光协同作用下,高铁酸钾氧化降解硝基苯水溶液的表观二级反应动力学速率常数为4.56×10-5L/(mol·s),其相关系数为-0.99689,说明高铁酸钾/紫外光系统与硝基苯的CODCr降解较好地符合二级反应,与文献[18-19]的结果相同。

图8 高铁酸钾/254nm紫外光降解硝基苯废水反应动力学拟合
3 结 论
本文通过实验研究了高铁酸钾/254nm紫外光协同氧化降解水体中硝基苯的可行性,考察了高铁酸钾的最佳投加量、溶液初始pH值以及反应时间等因素对降解效果的影响,并对降解产物进行了UV-Vis对比分析,研究表明:
(1)254nm紫外光/高铁酸盐协同方法明显优于单纯的高铁酸盐氧化法。中性条件下,254nm紫外光/高铁酸盐降解硝基苯的去除率大于单纯的高铁酸盐氧化法及光解离两者之和。
(2)高铁酸钾氧化降解水体中硝基苯过程中,增加高铁酸盐投加量、减小硝基苯溶液初始质量浓度及延长反应时间,均有利于提高硝基苯的CODCr去除率;溶液在酸性和碱性条件下硝基苯的CODCr去除率明显低于近中性条件。
(3)正交实验结果表明,254nm紫外光/高铁酸盐协同对硝基苯降解的影响因素从大到小依次为:高铁酸钾投加量>硝基苯质量浓度>溶液pH值>反应时间。满足CODCr去除率最佳的条件为:高铁酸钾为125mg、pH 值为7、反应30min和硝基苯质量浓度为25mg/L,降解效率达到92%。
(4)在254nm紫外光协同作用下,高铁酸钾氧化降解硝基苯水溶液符合表观二级反应,其反应动力学速率常数为4.56×10-5L/(mol·s)。
[1]戴冬梅.苯胺与硝基苯中毒的救护体会[J].中国临床研究,2012,25(10):1036-1037.
[2]张 攀,高彦征,孔火良.污染土壤中硝基苯热脱附研究[J].土壤,2012,44(5):801-806.
[3]李 静,吴宏海,何广平,等.钾化蒙脱石对硝基苯的强化吸附机理研究[J].矿物学报,2012,32(4):555-562.
[4]许秀清,单治国,朱承驻,等.高铁酸盐制备及氧化降解硝基苯水溶液的研究[J].合肥工业大学学报:自然科学版,2008,31(4):507-510.
[5]Jiang J Q,Zhou Z G,Pahl O.Preliminary study of ciprofloxacin(CIP)removal by potassium ferrate[J].Sep Sci Technol,2012,22(3):95-98.
[6]Ma Y,Gao N Y,Li C.Degradation and pathway of tetracycline hydrochloride in aqueous solution by potassium ferrate[J].Environ Eng Sci,2012,29(5):357-362.
[7]Zhang X H,Leng H Y,Chen K.Effect of potassium ferrate(K2FeO4)on sludge dewater ability under different pH conditions[J].Chem Eng J,2012,13(9):467-474.
[8]Ye F X,Liu X W,Li Y.Effects of potassium ferrate on extra-curricular polymeric substances(EPS)and physicochemical properties of excess activated sludge[J].J Hazard Mater,2012,15(1):158-163.
[9]Ye F X,Ji H H,Ye Y F.Effect of potassium ferrate on disintegration of waste activated sludge(WAS)[J].J Hazard Mater,2012,15(6):164-168.
[10]Chao A C.Quality improvement of biosolids by ferrate(VI)oxidation of offensive odour compounds[J].Water Sci Tech,1996,33(3):119-130.
[11]Yang B,Ying G G,Zhang L J,et al.Kinetics modeling and reaction mechanism of ferrate(VI)oxidation of benzotriazoles[J].Water Res,2011,45(6):2261-2269.
[12]陆 军,朱承驻.185nm紫外光/氧化协同降解水体中微量苯的研究[J].合肥工业大学学报:自然科学版,2011,34(8):1242-1245,1262.
[13]Sharma V K.Ferrate(VI)and ferrate(V)oxidation of organic compounds:Kinetics and mechanism [J].Coordination Chemistry Reviews,2013,257:495-510.
[14]Zhu C Z,Ouyang B,Wang J Q,et al.Photochemistry in the mixed aqueous solution of nitrobenzene and nitrous acid as initiated by the 355nm UV light [J].Chemosphere,2007,67(5):855-861.
[15]Huang H,Sommerfeld D,Dunn B C,et al.Ferrate(VI)oxidation of aqueous phenol:kinetics and mechanism [J].J Phys Chem A,2001,105(14):3536-3541.
[16]Wood R H.The heat,free energy and entropy of the ferrate(VI)ion [J].J Am Chem Soc,1958,80(9):2038-2041.
[17]陈 琳,杜 瑛,雷乐成.UV/H2O2光化学氧化降解对氯苯酚废水的反应动力学[J].环境科学,2003,24(5):106-109.
[18]Goff R H,Murmann K.Mechanism of isotopic oxygen exchange and reduction of ferrate(VI)ion(FeO42-)[J].J Am Chem Soc,1971,93(23):6058-6065.
[19]Noorhasan N,Patel B,Sharma V K.Ferrate(VI)oxidation of glycine and glycylglycine:kinetics and products[J].Water Res,2010,44(3):927-935.
