对小菜蛾协同增效的Cry1和Cry9类蛋白组合的筛选
2013-09-28蔡吉林束长龙宋福平
蔡吉林, 束长龙, 宋福平, 黄 勃, 张 杰*
(1.安徽省微生物防治省重点实验室,安徽农业大学,合肥 230036;2.中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
小菜蛾[Plutella xylostella (Linnaeus)],属鳞翅目,菜蛾科,是一种世界性的十字花科蔬菜害虫[1]。它是首个在田间对Bt制剂产生抗性的害虫[2]。
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种在自然界广泛分布的革兰氏阳性细菌,其主要特征是在芽胞形成的同时产生杀虫晶体蛋白,对鳞翅目、鞘翅目、双翅目等多种昆虫具有特异杀虫活性[3-6]。由于Bt对人畜无害,环境友好,在小菜蛾等重要农业害虫防治中扮演了重要的角色,它是目前世界上开发时间最长、应用最成功的微生物杀虫剂。截止到2012年4月,Bt国际命名委员会网站上已公布的Cry类杀虫晶体蛋白有624种,其中Cry1类蛋白244种,Cry9类蛋白30种。
单价cry基因在应用过程中遇到了一些问题,例如毒力有限、杀虫谱窄、害虫易产生抗性等问题。1985年,Wu和Chang第一个证实了Bt以色列亚种(B.thuringiensis subsp.israelensis,Bti)中26ku和65ku蛋白组合有增效作用,26ku和130ku蛋白组合也表现出了相似的作用[7]。随后其他Cry蛋白间的协同作用陆续报道。张杰等发现Cry1Ba和Cry3Aa基因组合对鞘翅目叶甲科害虫具有高毒力[8];薛 建 丽 对 甜 菜 夜 蛾 [Spodoptera exigua(Hübner)]增效研究发现Cry1C和Cry1Aa等比混配时增效因子达到4.0[9];Sharma发现 Cry1Ab和Cry1Ac组合对斑禾草螟[Chilo partellus(Swinhoe)]有 3 倍 左 右 的 增 效 作 用[10];Peng 等 发 现Cry6Aa和Cry55Aa等比混配对南方根结线虫[Meloidogyne incognita (Kofoid et White)]增效可达5倍[11]。但是目前关于Cry蛋白对小菜蛾的增效研究很少,只有刘楠发现Cry1Ba与Cry1Ia组合对小菜蛾有相加作用的报道[12]。因此,寻找与筛选对小菜蛾高效的蛋白组合对于此类害虫防治具有重要的意义。
中国农业科学院植物保护研究所先后克隆了cry1Ai2*、cry1Ea8*、cry9Aa3 基因[13]。研究发现Cry1Ai和Cry1Ea蛋白均对小菜蛾等鳞翅目害虫具有高毒力(专利申请号:200910241558),Cry9Aa蛋白不仅对敏感种群小菜蛾和亚洲玉米螟[Ostrinia furnacalis(Guenée)]具有很强的毒杀作用,而且对Cry1Ac蛋白抗性小菜蛾也无交互抗性[13]。
本研究以Cry1Ai、Cry1Ea和Cry9Aa蛋白为材料,在单独测定各种蛋白杀虫活性的基础上,把Cry1Ai+ Cry1Ea、Cry1Ea+ Cry9Aa、Cry1Ai+Cry9Aa蛋白进行不同比例的混配,筛选到了对小菜蛾具有显著增效作用的蛋白组合。这些结果将为工程菌的构建和转基因抗虫作物的培育提供优良的杀虫基因组合。
1 材料与方法
1.1 菌株特征及来源
所用菌株均为本组保藏,Rosetta-1Ai、Rosetta-1Ea和Rosetta-9Aa[13]分别为本实验室构建的含有cry1Ai、cry1Ea、cry9Aa基因大肠杆菌表达菌株,详见表1。

表1 菌株及其表达的Cry蛋白特性Table 1 Strains and properties of their expressed Cry proteins
1.2 试剂和设备
1.2.1 试剂
液体 LB培养基:1.0%胰蛋白胨(tryptone),0.5%酵母提取物(yeast extract),1.0%氯化钠,pH 7.0,121 ℃/20min灭菌;抗生素:氨苄青霉素100mg/mL,氯霉素 34mg/mL,-20 ℃ 保存;IPTG:IPTG 水溶液1mol/L,-20 ℃保存;Tris-HCl:1mol/L(pH 8.0)121℃/20min灭菌后室温保存;SI:50%乙醇,10%乙酸,40%去离子水;SII:7.5%乙酸,5%乙醇,87.5%去离子水;SIII:0.25%的考马斯亮蓝R250乙醇溶液;其他试剂均为国产或进口分析纯化学试剂。
1.2.2 仪器设备
摇床:D250,美国NBS公司;落地式高速冷冻离心机:Avanti J-26XP,美国Beckman Coulter公司;蛋白电泳仪:Mini protein III美国Bio-Rad公司;凝胶成像系统:Universal HoodⅡ,美国Bio-Rad公司;超声波破碎仪:CP 750,宁波新芝生物公司。
1.3 供试昆虫
敏感种群小菜蛾,2000年采自北京海淀区永丰甘蓝菜地,由本实验室采用萝卜苗饲养。室内条件下,从卵孵化为幼虫至化蛹需要14d左右,蛹3~4d后羽化成虫,1~2d后成虫交配、产卵;该试虫一个生活史大约20d左右。
1.4 Cry蛋白的制备与分析
1.4.1 大肠杆菌培养与Cry蛋白提取
37 ℃ 过 夜 活 化 Rosetta-1Ai、Rosetta-1Ea、Rosetta-9Aa菌株,以1%的接种量转接于液体LB培养基中,37℃,220r/min培养2h使其A600为0.5。加入诱导物IPTG,终浓度为0.5mmol/L。150r/min,20℃诱导10h,4 ℃,8 000r/min离心10min收集菌体。收集菌体加入20mmol/L Tris-HCl(pH 8.0)悬浮,超声破碎完全后,4℃,12 000r/min离心10min,收集可溶组分,非可溶组分悬浮于20mmol/L Tris-HCl(pH 8.0)缓冲液中。
1.4.2 Cry蛋白SDS-PAGE分析
吸取蛋白溶液10μL,加入30μL ddH2O,加入10μL 5×Loading Buffer,充分混匀。100℃煮沸8min,12 000r/min离心5min,取上清为电泳样品。SDS-PAGE电泳条件:4%浓缩胶,8%分离胶,80V电泳10min,140V电泳直到溴酚蓝达到胶底边缘并溢出电泳槽。电泳结束后取出凝胶,加入50mL SI加热30s,60r/min振荡10min;倒掉SI加入含SIII的SII(每50mL SII加200μL SIII)加热30s,60r/min振荡1h。上样缓冲液、染色脱色液与凝胶配制参照文献[14]。
1.5 生物活性测定
人工饲料购于美国Southland Products Incorporated公司,配制方法见产品说明。称取15g人工饲料放置于灭菌培养皿中,加入待测样品的稀释液1.5mL(10μg/g向下设定7个梯度,2倍梯度稀释),充分搅拌混匀,平均分装于3个平皿中,每皿接入20头2龄幼虫,医用胶带封口,每个浓度重复3次。两种混配的Cry蛋白按照质量比混配成不同的蛋白溶 液 进 行 生 物测定,20mmol/L 的 Tris-Cl(pH-8.0)缓冲液作为空白对照,48h调查结果(L∥D=16h∥8h,RH:50%)。
1.6 数据分析
采用National Institutes of Health开发的imageJ(V1.43)分析SDS-PAGE图谱并进行定量,使用方法参考ImageJ User Guide1.43m。采用SPSS(V13.0)软件计算LC50等相关结果,协同毒力指数采用Tabashnik公式法计算[15],公式如下:

协同毒力指数=预期LC50/实测LC50。由于试验误差和供试生物等未被觉察到的不一致性,一般认为:预期LC50与实测LC50的毒力比在0.5~2.6之间属相加作用,大于2.6属增效作用,小于0.5时属拮抗作用(Finney法)[16]。
2 结果与分析
2.1 杀虫蛋白SDS-PAGE分析
Cry1Ai、Cry1Ea、Cry9Aa蛋白 SDS-PAGE 分析结果见图1。3种基因均能正常表达,Cry1Ai、Cry1Ea、Cry9Aa蛋白的分子量分别为133、133、129ku。利用imageJ定量,浓度分别为2.5、1.0、2.0mg/mL(可溶组分中Cry蛋白含量很低,图略)。
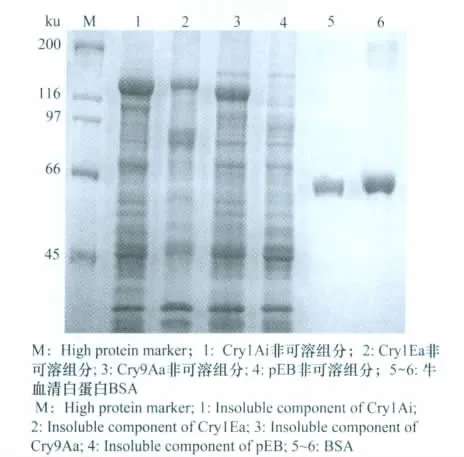
图1 3种Cry蛋白的SDS-PAGE定量分析Fig.1 SDS-PAGE quantitative analysis of 3Cry proteins
2.2 小菜蛾生物活性测定
2.2.1 Cry1Ai、Cry1Ea、Cry9Aa蛋白杀虫结果
Cry1Ai、Cry1Ea、Cry9Aa蛋白对小菜蛾2龄幼虫48h的LC50分别为1.52、5.47μg/g和3.27μg/g,结果详见表2。3种蛋白对靶标害虫均表现出了很高的毒力。
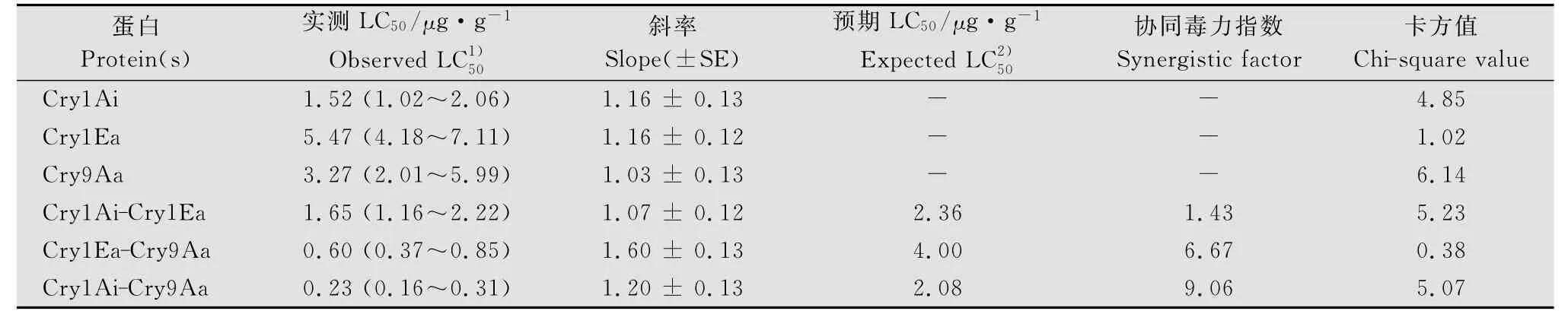
表2 3种Cry蛋白单独及其混配(1∶1)对小菜蛾生物活性测定结果Table 2 Bioassay of 3Cry proteins,alone or mixture(1∶1),against P.xylostella
2.2.2 Cry1Ai+Cry9Aa和Cry1Ea+Cry9Aa蛋白混配组合杀虫结果
在上述单一蛋白活性测定的基础上,继续测定了这3种蛋白两两等比例混合样品的杀虫活性,结果表明Cry1Ai+Cry9Aa组合LC50=0.23μg/g,增效因子为9.06,这个组合有非常显著的协同增效作用。Cry1Ea+Cry9Aa组合LC50=0.60μg/g,增效因子为6.67,这个组合有明显的增效作用。Cry1Ai+Cry1Ea组合 LC50=1.65μg/g,增 效 因 子 只 有1.43,说明这个组合仅有较强的相加作用(结果详见表2)。
根据这些研究结果,我们针对Cry1Ai+Cry9Aa和Cry1Ea+Cry9Aa两种组合分别设计了不同比例的毒素混配对小菜蛾的杀虫测定。
表3结果显示:Cry1Ai+Cry9Aa蛋白组合1∶1混配时增效因子为9.06;1∶2混配时的增效因子为8.21;1∶4混配时的增效因子为8.71,说明1∶1混配时增效因子最高。
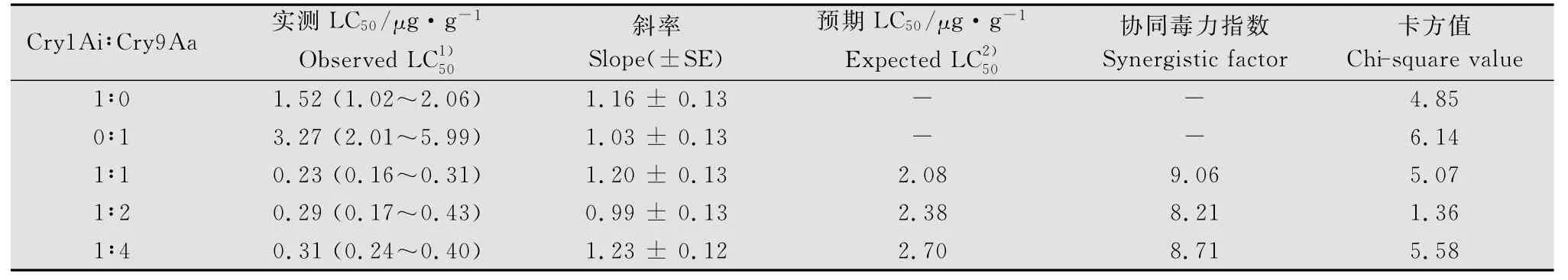
表3 不同比例的Cry1Ai+Cry9Aa蛋白组合混配对小菜蛾的生物测定结果Table 3 Bioassay of the Cry1Ai+Cry9Aa protein mixture with different proportions against P.xylostella
表4结果显示:Cry1Ea+Cry9Aa蛋白组合1∶1混配时增效因子为6.67;1∶2混配时的增效因子为5.92;1∶4混配时的增效因子为5.76,说明1∶1混配时增效因子最高。
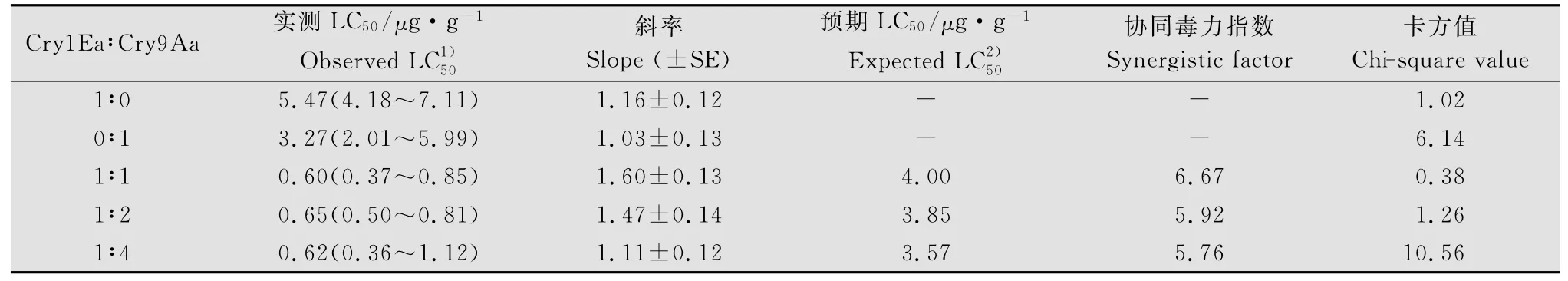
表4 不同比例的Cry1Ea和Cry9Aa蛋白混配对小菜蛾的生物测定结果Table 4 Bioassay of the Cry1Ea+Cry9Aa protein mixture with different proportions against P.xylostella
3 讨论
本文在对Cry1Ai、Cry1Ea、Cry9Aa 3种蛋白对小菜蛾2龄幼虫杀虫活性测定的基础上,筛选到对小菜蛾毒杀具有显著增效的蛋白组合Cry1Ai+Cry9Aa和Cry1Ea+Cry9Aa。增效因子分别达到了9.06和6.67。并且研究了两种蛋白以不同比例进行混配的杀虫效果,得出的结论是蛋白进行等比混合时增效最显著。
目前国内关于Bt对小菜蛾增效的研究很少,2010年刘楠利用Cry1Ba3和Cry1Ia8对小菜蛾增效,结果显示两者只有微弱的相加作用[12]。本研究发现了对小菜蛾具有显著增效的蛋白组合,这种组合明显提高了蛋白的毒力。而苏慧琴等报道Cry9A等与Cry1A蛋白无交互抗性[13],因此本研究获得的Cry1Ai+Cry9Aa和Cry1Ea+Cry9Aa两种高效组合有望在治理对Cry1A类蛋白产生抗性的害虫中发挥重要的作用[17]。这些结果将为转基因抗虫植物的研发提供新的基因来源,同时将指导我们继续深入发掘宝贵的Bt基因资源,实现Bt生防资源的可持续开发与利用。
Domain II决定毒素的专一性和与受体的特异性结合[18],通过序列比对发现:Cry1Ai和 Cry9Aa的Domain II相似性为20.4%,Cry1Ea和Cry9Aa的Domain II相似性为22.6%,相似性都较低(比对数据来自http:∥blast.ncbi.nlm.nih.gov/Blast.cgi)。推测这两组蛋白在小菜蛾的BBMV上可能结合不同的受体进而产生协同增效作用。关于两者协同增效的作用机制,还有待进一步的试验结果来验证。
[1] 赵建周,吴世昌.小菜蛾抗药性治理对策研究[J].中国农业科学,1996,29(1):8-14.
[2] FerréJ,Real M D,Van Rie J,et al.Resistance to the Bacillus thuringiensis bioinsecticide in a field population of Plutella xylostellais due to a change in a midgut membrane receptor[J].Proceedings of the National Academy of Sciences of the United States of America,1991,88(12):5119-5123.
[3] Schnepf E,Crickmore N,Van Rie J,et al.Bacillus thuringiensis and its pesticidal crystal proteins[J].Microbiology and Molecular Biology Reviews,1998,62(3):775-806.
[4] Soberon M,Fernández L E,Pérez C,et al.Mode of action of Bacillus thuringiensis Cry and Cyt toxins and their potential for insect control[J].Toxicon,2007,49(4):423-435.
[5] van Frankenhuyzen K. Insecticidal activity of Bacillus thuringiensis crystal proteins[J].Journal of Invertebrate Pathology,2009,101(1):1-16.
[6] Roh J Y,Choi J Y,Li M S,et al.Bacillus thuringiensis as a specific,safe and effective tool for insect pests control[J].Journal of Microbiology and Biotechnology,2007,17(4):547-559.
[7] Wu D,Chang F N.Synergism in mosquitocidal activity of 26 and 65kDa proteins from Bacillus thuringiensis subsp.israelensis crystal[J].FEMS Microbiology Letters,1985,190(2):232-236.
[8] 张杰,黄大昉,宋福平,等.对鳞翅目与鞘翅目昆虫高毒力的Bt基因、表达载体和工程菌:中国,01124164[P].2001-08-20.
[9] Xue J L,Cai Q X,Zheng D S,et al.The synergistic activity between Cry1Aa and Cry1Cfrom Bacillus thuringiensis against Spodoptera exigua and Helicoverpa armigera[J].Letters in Applied Microbiology,2005,40(6):460-465.
[10] Sharma P,Nain V,Lakhanpaul S,et al.Synergistic activity between Bacillus thuringiensis Cry1Ab and Cry1Ac toxins against maize stem borer(Chilo partellus Swinhoe)[J].Letters in Applied Microbiology,2010,51(1):42-47.
[11] Peng D H,Chai L J,Wang F S,et al.Synergistic activity between Bacillus thuringiensis Cry6Aa and Cry55Aa toxins against Meloidogyne incognita[J].Microbial Biotechnology,2011,4(6):794-798.
[12] 刘楠,王少丽,宋福平,等.Cry1Ba3、Cry1Ia8蛋白对Cry1Ac抗性小菜蛾的杀虫活性研究[J].植物保护,2010,36(2):66-70.
[13] 苏慧琴,束长龙,何康来,等.苏云金芽孢杆菌cry9Aa基因克隆表达及活性分析[J].植物保护学报,2010,37(6):541-546.
[14] Maniatis T,Fritsch E F,Sam brook J.Molecular cloning:A laboratory manual[M].2nded.New York:Cold Spring Harbor Laboratory Press,1989:880-887.
[15] Tabashnik B E.Evaluation of synergism among Bacillus thuringiensis toxins[J].Applied and Environmental Microbiology,1992,58(10):3343-3346.
[16] Finney D.Probit analysis[M].London:Cambridge University Press,1971.
[17] Zhao J Z,Cao J,Li Y X,et al.Transgenic plants expressing two Bacillus thuringiensis toxins delay insect resistance evolution[J].Nature Biotechnology,2003,21(12):1493-1497.
[18] Li J D,Carroll j,Ellar D J.Crystal structure of insecticidalδendotoxin fromBacillus thuringiensis at 2.5Åresolution[J].Nature,1991,353(6347):815-821.
