甘肃省保护地蔬菜根结线虫种类鉴定及其rDNA-ITS序列分析
2013-09-28漆永红吕和平陈书龙
杜 蕙, 漆永红, 吕和平, 陈书龙, 陈 明*
(1.甘肃省农业科学院植物保护研究所,兰州 730070;2.河北省农林科学院植物保护研究所,保定 071000)
根结线虫(Meloidogynespp.)是一类在蔬菜作物上危害极大的植物病原线虫,其寄主范围广,种类多,分布广,能侵染几乎所有蔬菜作物。据调查,2008年根结线虫病仅在甘肃省局部地区的保护地蔬菜上发生,随着种植结构的调整,人为因素等影响,蔬菜根结线虫病发生日趋严重,现已蔓延到几乎全省保护地蔬菜产区,造成严重的产量损失,给蔬菜生产带来巨大的影响[1-2]。
根结线虫种类鉴定除传统的形态学、鉴别寄主反应、生物化学和细胞遗传学等方法外,r DNA-ITS-PCR技术已被用于根结线虫的快速分子诊断和从混合种群中识别根结线虫种类。Zijlstra等采用ITS-RFLP技术鉴定出了北方根结线虫(M.haplaChitwood)、奇 特 伍 德 根 结 线 虫 (M.chitwoodiGolden et al.)和法拉克斯根结线虫 (M.fallaxKarssen)3种十分相近的根结线虫种群[3]。Blok等利用5S和18S引物之间的ITS区域揭示了爪哇根结线虫[M.javanica(Treub)]、花生根结线虫[M.arenaria(Neal)]、南方根结线虫[M.incognita(Kofoid et White)]、玛亚圭根结线虫(M.mayaguensisRammah et Hirschmann)和北方根结线虫的种内和种间变异[4]。彭德良等用PCR技术研究了40多个根结线虫群体的r DNA-ITS基因,明确了北方根结线虫、爪哇根结线虫、南方根结线虫等6种根结线虫的ITS位点序列特征[5]。廖金铃等研究并建立了用r DNA-ITS、线粒体DNA-PCR-RFLP和SCAR方法快速鉴定根结线虫的方法[6]。但是,尚未对甘肃省根结线虫种类开展研究。本试验以采自甘肃省11个不同区域保护地蔬菜根结线虫种群为研究对象,采用ITS标记,将PCR扩增产物进行测序,分析根结线虫的同源性和亲缘关系,鉴定甘肃省不同区域蔬菜根结线虫种类,对根结线虫病害快速诊断、种群遗传多样性研究及根结线虫病害防治具有重要的实际意义。
1 材料与方法
1.1 供试线虫
供试根结线虫于2008-2011年从甘肃省9个市不同区域保护地蔬菜上采集,分别进行单卵块纯化培养后接种于预先培植于消毒土的番茄(品种为‘毛粉802’)根部(约25 d苗龄),在温室中培养45 d左右,获得纯培养种群11个(表1)。
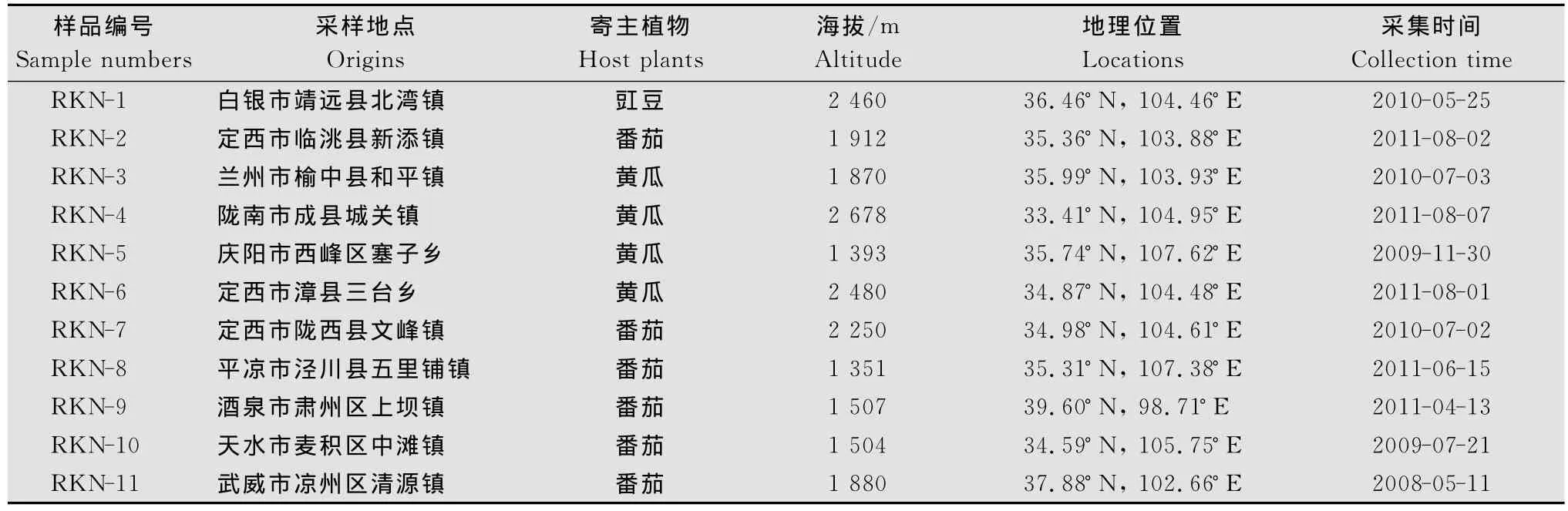
表1 供试蔬菜根结线虫样本采集信息Table 1 Origins of the tested vegetable root-knot nematodes
1.2 试剂和仪器
PCR所用的Taq酶,d NTP,Buffer均购自TIAN GEN生化科技生物技术有限公司。
试验仪器为:MJ PTC-100 PCR仪,JY 600+电泳仪,Heraeus台式高速离心机,FTI-500凝胶成像分析系统。
1.3 根结线虫DNA提取
参照王江岭等单条线虫基因组DNA提取方法稍作改进[7]。具体方法为:将从新鲜卵囊里孵化出的根结线虫2龄幼虫放入dd H2O中清洗,挑取单条放入200μL PCR管中(含8μL dd H2O和1μL 10×PCR Buffer),超低温冰箱-80℃放置4 h,85℃加热2 min,向PCR管中加入1μL 20 mg/m L蛋白酶K,56℃加热15 min,95℃加热10 min,高速离心(14 000 r/min)1 min,取此 DNA 上清液直接进行PCR扩增。
1.4 PCR扩增
采用Harris等[8]设计的线虫ITS扩增通用引物F195和V5367(由上海生工公司合成),其序列分别 为:5′-TCCTCCGCTAAATGATATG-3′和 5′-TTGATTACGTCCCTGCCCTTT-3′,对 11 个 县(区)根结线虫种群的ITS间隔区进行扩增。PCR扩增采用25μL反应体系,其中10×PCR Buffer 2.5μL,2.5 mmol/L d NTP 1μL,5μmol/L 引物F195和V5367各1μL,2.5U/μLTaq酶0.5μL,DNA提取上清液3μL,加dd H2O至25μL。同时设置无DNA模板的空白对照CK。PCR扩增条件为:95℃预变性5 min;然后94℃变性1 min,60℃退火1 min,72℃延伸1 min,反应共35个循环;最后72℃延伸10 min。4℃ 保存备用。PCR产物采用1.5%的琼脂糖凝胶120 V电泳30 min进行检测,用1×TBE作为电泳缓冲液,并在紫外灯下观测照相。
1.5 PCR产物序列测定、序列分析及同源性比较
将PCR产物送上海生物工程有限公司进行序列测定。采用MEGA软件对所测定的序列进行比对分析,比较11个不同地区根结线虫种群ITS序列的同源性。
2 结果与分析
2.1 根结线虫形态学鉴定结果
对甘肃省11个不同区域根结线虫进行了形态学方面的鉴定,根据其2龄幼虫、雌虫会阴花纹及卵的形态学特征(图1),初步确定11个不同地区保护地蔬菜根结线虫均为南方根结线虫(M.incognita)。
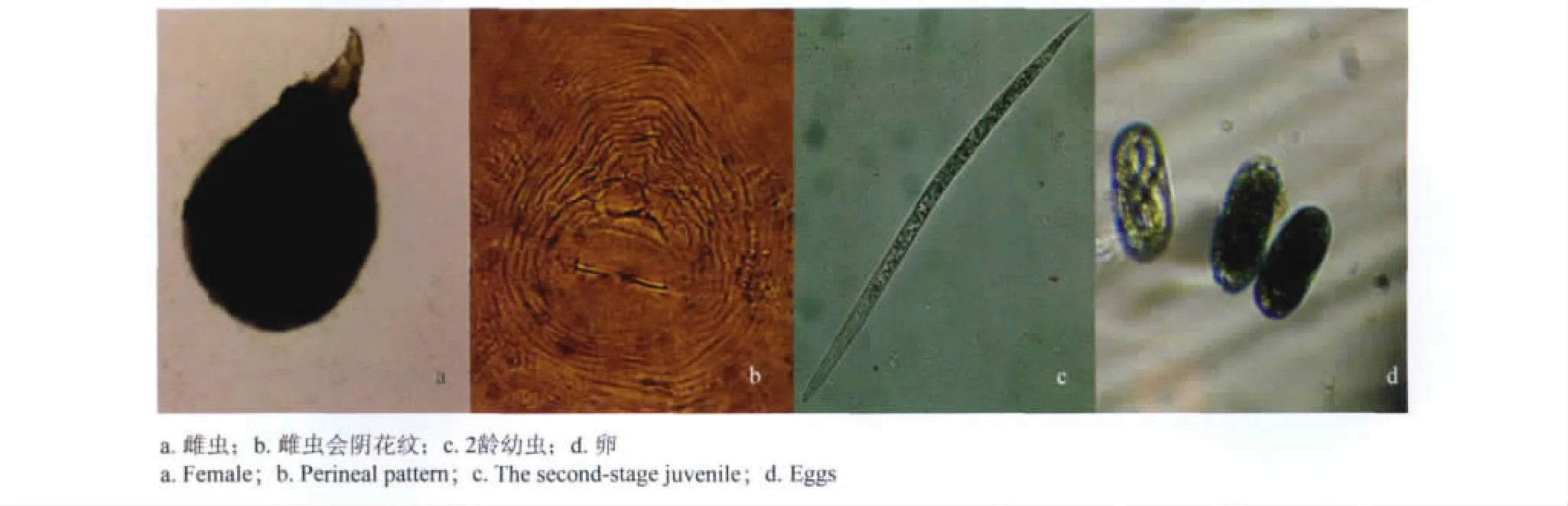
图1 供试根结线虫的形态特征Fig.1 The morphological characters of root-knot nematodes in the experiment
2.2 r DNA-ITS-PCR扩增产物电泳检测结果
用引物F195和V5367对甘肃省11个不同地区根结线虫单条2龄幼虫进行r DNA-ITS-PCR扩增后,用琼脂糖凝胶电泳检测,各地区线虫样本的ITS片段大小为700 bp左右(图2)。
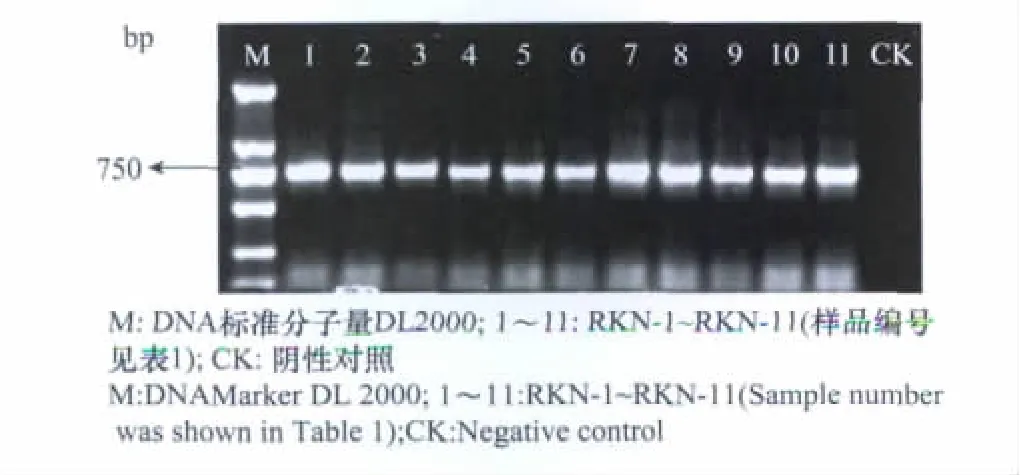
图2 11个根结线虫样品ITS片段的PCR扩增电泳图Fig.2 Electrophoregram of PCR product of ITS fragment from 11 root-knot nematode samples
2.3 序列测定结果
对11个根结线虫种群的rDNA-ITS序列进行测定,结果表明,11个蔬菜根结线虫种群的ITS片段大小介于690~695 bp之间。其中白银市靖远县北湾镇、定西市临洮县新添镇、定西市陇西县文峰镇、平凉市泾川县五里铺镇4地根结线虫ITS片段大小均为691 bp;兰州市榆中县和平镇、陇南市成县城关镇、天水市麦积区中滩镇3地根结线虫ITS片段大小均为690 bp;庆阳市西峰区塞子乡、定西市漳县三台乡、酒泉市肃州区上坝镇、武威市凉州区清源镇4地根结线虫ITS片段大小均为695 bp。
2.4 序列分析及同源性比较结果
经测序后,将11个根结线虫样本的r DNA-ITS区域序列与GenBank(http:∥www.ncbi.nlm.nih.gov)数据库进行Nucleotide BLASTN序列比对,结果表明,获得的扩增产物ITS区域序列与已知南方根结线虫ITS区域序列的相似性达到99%。用MEGA 4.0软件构建系统发育树(图3)。从系统发育树可以看出,11个根结线虫样本与南方根结线虫的遗传距离最近,而与其他根结线虫的遗传距离相对较远,说明甘肃省9个市的保护地蔬菜根结线虫均为南方根结线虫(M.incognita)。
3 结论与讨论
由于根结线虫的形态特征在进化过程中比较保守,不同线虫种类之间的形态特征差异较小,相对来讲同种内不同种群之间的特征变异幅度又较大,一般仅靠形态特征不能对根结线虫进行准确的鉴定。近年来分子生物学特征对线虫进行种类鉴定,已成为线虫种类鉴定的发展趋势。线虫基因组DNA提取是线虫分子生物学研究的基础,国内外一些学者用碱裂 解 法[9]、蛋 白 酶 K 法[10]、试 剂 盒 法[11]以 及SDS法[12]等对提取单头线虫DNA的方法进行了摸索和改进,取得一些进展。本试验采用PCR Buffer溶液替代WLB裂解液,使用变温处理替代其他手工破碎能够快速提取单头线虫DNA,本方法可供提取其他线虫基因组DNA所借鉴。
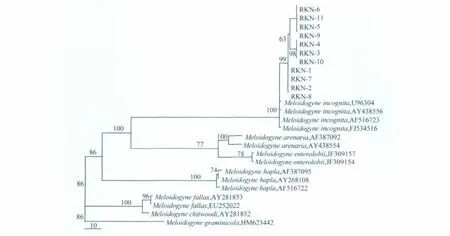
图3 基于11个根结线虫样本和来自GenBank不同种类根结线虫ITS区序列构建的系统进化树Fig.3 The phylogenetic tree of 11 samples and related Meloidogyne spp.from GenBank based on their ITS sequences
王仁刚等对北京地区保护地蔬菜根结线虫用形态学和r DNA-ITS序列分析进行鉴定,发现南方根结线虫不仅广泛分布于我国南方地区,在北方北京地区温室蔬菜上也有分布[13]。本研究采用r DNAITS-PCR方法,结合供试根结线虫形态学特征,所有根结线虫样品均被鉴定为南方根结线虫(M.incognita),供试的根结线虫样品来自甘肃省14个市州中的9个市的不同区域,11个采样点均为目前甘肃省的主要保护地蔬菜产区,具有较强的代表性,可以基本反映全省的状况,表明南方根结线虫在甘肃省保护地内已普遍发生,值得引起相关部门的高度重视。
[1]高赟,漆永红,刘永刚,等.甘肃河西地区番茄根结线虫病病原鉴定[J].植物保护,2009,35(3):127-131.
[2]漆永红,吕和平,杜蕙,等.甘肃武威市黄瓜根结线虫病病原鉴定[J].甘肃农业科技,2009(9):9-11.
[3]Zijlstra C,Uemk B J,Van Silfhout C H.A reliable,precise method to differentiate species of root-knot nematodes in mixtures on the basis of ITS-RFLPs[J].Fundamental and Applied Nematology,1997,20(1):59-63.
[4]Blok V C,Phillips M S,Fargette M.Comparision of sequence from the ribosomal DNA intergenic region ofMeloidogyne mayaguensisand other major tropical root-knot nematodes[J].Journal of Nematology,1997,29(1):16-22.
[5]Peng D L,Subbotin S,Moens M.Molecular characterization of some species of the genusMeloidogynefrom China[J].Nematology,2002,4(2):175-176.
[6]Liao J L,Feng Z X,Yang W C.Phylogeny ofMeloidogynespp.based on r DNA-ITS sequence and fluorescent AFLP[J].Nematology,2002,4(2):173-174.
[7]王江岭,张建成,顾建峰.单条线虫DNA提取方法[J].植物检疫,2011,25(2):32-35.
[8]Harris T S,Sandall L J,Powers T O.Identification of singleMeloidogynejuveniles by polymerase chain reaction amplification of mitochondrial DNA[J].Journal of Nematology,1990,22(4):518-524.
[9]葛建军,刁 鹏,陈洪俊,等.马铃薯金线虫的分子检测技术[J].植物检疫,2008,22(1):21-23.
[10]Subbotin S A,Ragsdale E J,Mullens T,et al.A phylogenetic framework for root lesion nematodes of the genusPratylenchus(Nematoda):Evidence form 18S and D2-D3 expansion segments of 28S ribosomal RNA genes and morphological characters[J].Molecular Phylogenetics and Evolution,2008,48(2):491-505.
[11]Burgermeister W,Metge K,Braasch H.ITS-RFLP patterns for differentiation of 26Bursaphelenchusspecies(Nematoda:Parasitaphelenchidae)and observations on their distribution[J].Russian Journal of Nematology,2005,13(1):29-42.
[12]Braasch H,Burgermeister W.Bursaphelenchusrainulfisp.n.(Nematoda:Parasitaphelenchidae),first record of the genusBursaphelenchusFuchs,1937 from Malaysia[J].Nematology,2002,4(8):971-978.
[13]王仁刚,简恒,向红琼,等.北京地区保护地蔬菜根结线虫种类鉴定[J].植物保护,2007,33(3):90-92.
