北京及周边地区7个地理种群的亚洲小车蝗mtDNA COI基因序列分析
2013-09-28李云龙梁铁双张立国李冬冬
李云龙, 李 霞, 梁铁双, 张立国, 李冬冬
(1.北京市植物保护站,北京 100029;2.安达市农业技术推广中心,安达 151400;3.黑龙江省农业科学院玉米研究所,哈尔滨 156104;4.饶河出入境检验检疫局,饶河 155700)
亚洲小车蝗(OedaleusasiaticusB.-Bienko)属直翅目(Orthoptera)蝗总科(Acridoidea)丝角蝗科(Oedipodidae)小车蝗属(Oedaleus),主要分布于河北、内蒙古、甘肃和青海省等地,是我国北方草原的主要优势种害虫,也是农牧交错地带的重要经济害虫[1]。亚洲小车蝗具有远距离迁移的特性,迁移时间主要集中在晚上20:00至凌晨03:00期间,同时由于其具有较强的趋光性,因而在城市中灯光强烈的地方则吸引大量的亚洲小车蝗成虫[2]。2000年和2002年的7月上旬至8月上旬,北京市区及区县城区夜间灯下突然出现大量亚洲小车蝗成虫,给农业生产造成严重损失的同时,还给市民正常生活带来极大不便,造成了一定程度的社会恐慌。利用现代技术手段开展种群遗传关系及迁移来源研究,对于做到虫源地早监测、早预警、早防治,降低虫源地害虫基数,提高监测预警水平,提高防控工作的主动性、及时性和有效性,具有重要意义。
线粒体DNA序列分析(mtDNA sequence analysis)技术是目前进行昆虫种群遗传研究中最常用的分子生物学技术之一。mtDNA中常用的序列分析目的基因主要有12S RNA、16S RNA、COI、COII、ND1、ND 6和Cytb基因等,其中细胞色素氧化酶I基因(COI基因)已被成功用于橘小实蝇等迁飞性昆虫的种群遗传结构的研究[3-6]。高书晶等也利用COI基因对内蒙古地区7个不同地理种群的亚洲小车蝗样本进行了遗传多样性和种群关系初步分析[7]。
本研究在收集不同地理种群亚洲小车蝗成虫样品的基础上,采用mt DNA COI基因序列分析技术,研究北京及周边地区亚洲小车蝗的种群遗传关系,为进一步确定北京地区亚洲小车蝗的迁移来源,做到虫源地提早防治提供分子生物学方面的依据。
1 材料与方法
1.1 试验材料
供试亚洲小车蝗样本包括内蒙古自治区的锡林郭勒盟、赤峰市、乌兰察布市,河北省的张家口市、承德市和北京的密云县共3个省(直辖市)、6个盟市县在内的共7个地理种群的139个样本(表1和图1),所有样本均在2011年人工采集,采集的新鲜样品置于无水乙醇中,-20℃保存备用。

表1 用于mtDNA研究的亚洲小车蝗样本Table 1 Specimens of Oedaleus asiaticus for mt DNA analysis
1.2 试验方法
1.2.1 DNA提取与测序
采用天根生化科技(北京)有限公司的“血液/细胞/组织基因组DNA提取试剂盒”进行亚洲小车蝗总DNA的提取,并采用水平琼脂糖凝胶电泳检测的方法对所提取的DNA质量进行检测。目的片段扩增所用特异引物为“Uea7O.a”(5′-TCTCAACAAATCATAAGGACATTGG-3′)和 “Uea10O.a”(5′-TATACTTCTGGGTGTCCAAAGAATCA-3′)[8]。
PCR扩增体系为50μL,包括灭菌双蒸水30.5μL;10× Buffer 8 μL;d NTP(25 mmol/L)3 μL;20μmol/L引物各2μL,模板 DNA(20~50 ng)3μL;TaqPlus DNA聚合酶(2 U/μL)1.5μL。扩增条件共35个循环,包括94℃预变性3 min,94℃变性1 min,57.5℃ 退火1 min,72℃ 延伸1 min;最后72℃延伸30 min,4℃保存备用。PCR粗产物的纯化和测序,委托北京奥科生物技术公司在ABI-3730测序仪上完成,所有序列采用双向测序以确保测序的准确性。
1.2.2 数据分析
序列的比对和剪切利用Clustal X(Version 1.83)软件完成;碱基组成及单倍型分析利用 Mega version 3.1软件[10]完成;种群遗传分化系数(FST)、分子方差(AMOVA)分析[8]和 Mantel检测[9]等使用 Arlequin 3.0软件[8]完成;单倍型多样性、核苷酸多样性(π)、平均核苷酸差异数(k)及其相应标准偏差(SD)等参数分析使用 DNASP 4.10.1软件[11]完成;单倍型的统计简约网络(statistical parsimony)使用TCS version 1.21软件[12]进行构建,并根据Pfenninger和 Posada[13]提出的频率判据(frequency criterion)、拓扑判据(topological criterion)和地理判据(geographic criterion)原则进行断环(break the loops),以解决在统计简约网络构建过程中出现的分支、关联等问题,在进行断环过程中始终选择最简约的解决方案。
2 结果与分析
2.1 碱基组成分析
在所有样品中最终获得准确一致的长为645 bp的线粒体DNA CO I基因部分序列139条,全部样本序列中A、T、G和C碱基平均含量分别为34.9%、31.0%、16.1%和18.0%,A+T 的平均含量为65.9%,明显高于G+C的平均含量34.1%。在645个碱基中仅检测到12个多态性位点,占碱基总数的1.86%,其中多数变异发生在密码子的第3位点上,占变异位点的50%,发生在第1位点的变异比例为33.3%,第2位点最少,占变异比例的16.7%。12个多态性位点中包括7个单变异多态性位点和5个简约信息位点,在碱基的替换中,5个位点发生了转换,6个位点发生了颠换,1个位点同时发生了转换和颠换,所有多态性位点全部由碱基的替换产生,未发现插入和缺失。
2.2 遗传多样性分析
亚洲小车蝗7个地理种群的核苷酸多样性(π)、平均核苷酸差异数(K)以及单倍型多样性(Hd)参数值见表2。供试亚洲小车蝗样本总体上表现出较低水平的核苷酸多样性(0.000 42)和单倍型多样性(0.205)。核苷酸多样性最高的种群为内蒙古赤峰广兴源种群(0.000 84),其次分别是内蒙古乌兰察布种群(0.000 69)、内蒙古赤峰达莱诺日种群(0.000 41)和内蒙古锡林郭勒种群(0.000 12),河北张家口种群、河北承德种群和北京密云种群均未发生遗传变异,核苷酸多样性均为0。与上述核苷酸多样性高低排序相比,内蒙古乌兰察布种群的单倍型多样性在7个种群中最高(0.338),其次分别为内蒙古赤峰广兴源种群(0.335)、内蒙古赤峰达莱诺日种群(0.251)和内蒙古锡林郭勒种群(0.080)。
在139条序列中共鉴定出13种单倍型,其中共享单倍型仅4种,其余9种均为独享单倍型。在4种共享单倍型中,单倍型H3为内蒙古赤峰达莱诺日种群内共享;其余3种单倍型在至少2个种群间共享,分别是H1在所有7个种群中共享,H2在内蒙古赤峰达莱诺日种群和内蒙古锡林郭勒种群间共享,H7在内蒙古赤峰广兴源种群和内蒙古乌兰察布种群间共享。H4、H5、H6、H8、H9、H10、H11、H12、H13共9个独享单倍型的存在,表明在各种群内存在一定的遗传分化(表3)。
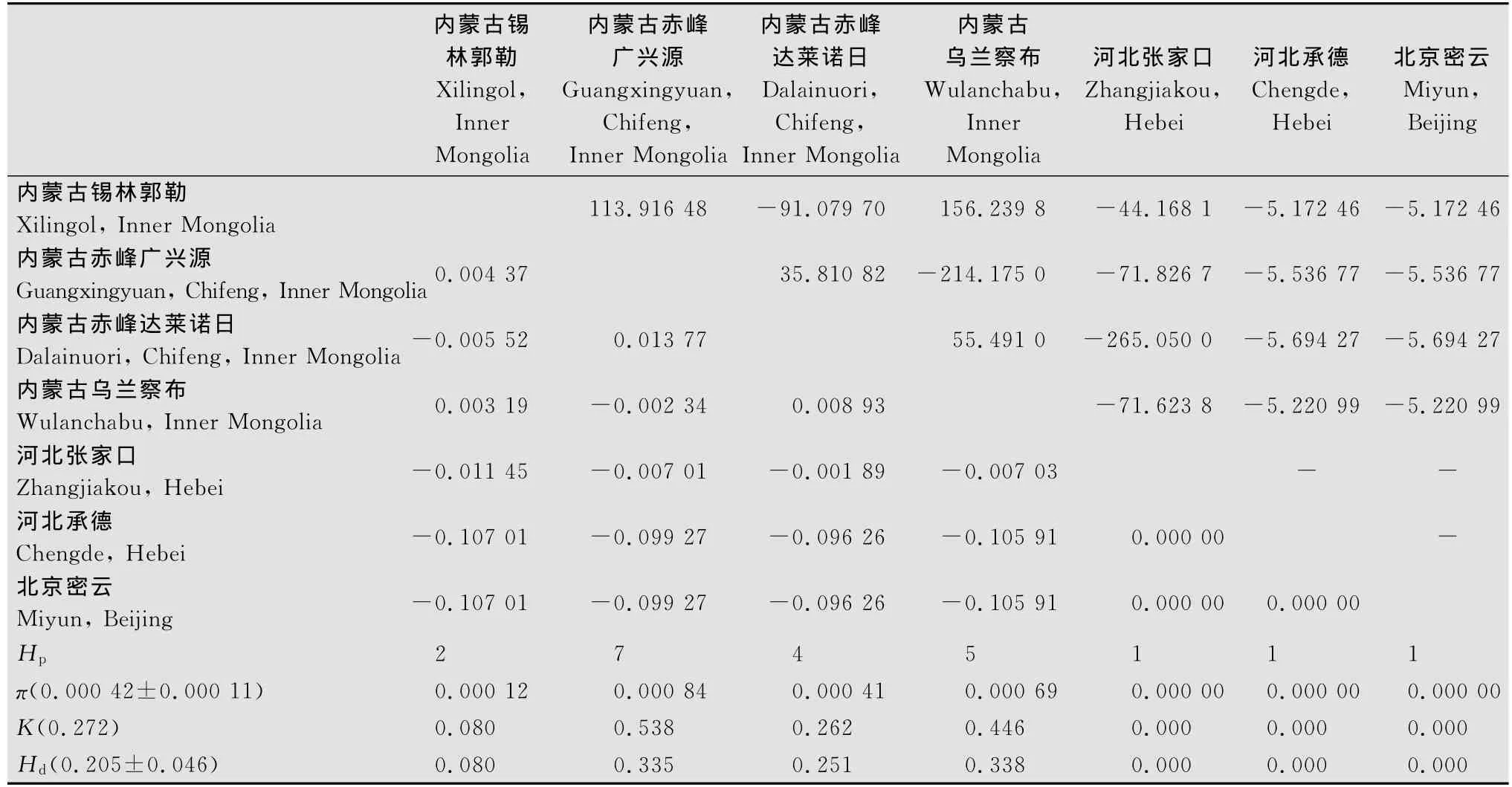
表2 亚洲小车蝗7个地理种群样本的遗传分化系数F ST、基因流N m以及遗传多样性参数1)Table 2 Genetic differentiation coefficient(F ST),gene flow (N m)and parameters of genetic diversity in population of O.asiaticus

表3 各种群单倍型数量、频率及在2个以上种群间共享的单倍型Table 3 The number and frequency of haplotypes in 7 populations and the haplotype shared by at least two populations
2.3 种群遗传结构
种群遗传分化系数FST(F-statistic)和基因流(gene flow)是反映种群间的遗传分化程度和各种群间基因交流情况的重要指标[14]。表2可示,各种群间遗传分化系数(FST)在0.013 77和-0.107 01之间,差异均未达到显著程度(P>0.05)。FST最高值出现在内蒙古赤峰达莱诺日种群与内蒙古赤峰广兴源种群之间(0.013 77),其次是内蒙古赤峰达莱诺日种群与内蒙古乌兰察布种群(0.008 93)、内蒙古赤峰广兴源种群与内蒙古锡林郭勒种群(0.004 37)、内蒙古乌兰察种群与内蒙古锡林郭勒种群(0.003 19);河北张家口、河北承德和北京密云3个种群间的FST值均为0,其余种群间的遗传分化系数均为负值,表明这些种群间的遗传分化程度均较小。
各种群间基因流在156.239 8和-265.05之间,差异也均未达到显著程度。同为内蒙古赤峰市的达莱诺日种群与广兴源种群之间的基因流为35.810 82,均低于内蒙古乌兰察种群与内蒙古锡林郭勒种群(156.239 8)、内蒙古赤峰广兴源种群与内蒙古锡林郭勒种群(113.916 476)、内蒙古赤峰达莱诺日种群与内蒙古乌兰察布种群(55.491 04)。其余各种群间的基因流的绝对值也都大于4,表明种群间的基因流动比较频繁[14]。
依据各种群的地理空间特征,将供试种群划分为6个群组:1)内蒙古锡林郭勒;2)内蒙古赤峰广兴源种群和内蒙古赤峰达莱诺日种群;3)内蒙古乌兰察布种群;4)河北张家口种群;5)河北承德种群;6)北京密云种群。对其进行AMOVA分析,发现种群间变异占-6.47%,组内种群间变异占了4.48%,种群个体间变异占了101.99%,结果表明引起种群总体变异的主要因素还是种群内的个体间变异。
通过对地理种群FST值(表2)和Nei氏遗传距离(Nei氏平均核苷酸差异数)与各种群间空间距离间(表4)的Mantel test结果表明,2对矩阵之间不存在显著的相关性(R1=-0.275 888,P1=0.857 000;R2=-0.014 366,P2=0.453 000),即亚洲小车蝗种群间的遗传分化程度与地理距离没有显著的相关性。
2.4 单倍型网络分析
研究鉴定出的13个单倍型中,核心单倍型H1被所有7个种群的124个个体所共享,占样本总量的89.2%。内蒙古锡林郭勒(A)种群与内蒙古赤峰达莱诺日(C)共享H2;内蒙古赤峰广兴源(B)种群共鉴定出7个单倍型,分别独享H5、H6、H7、H8、H9和H10共6个单倍型,其中单倍型H9由核心单倍型H1经过3次突变形成,并且前两次的中间单倍型缺失;H8由H1经过1次突变形成单倍型H5,再由其经过1次突变形成;内蒙古赤峰达莱诺日(C)种群独享H3、H4,并与A共享H2;内蒙古乌兰察布(D)种群分别独享H11、H12和H13;河北张家口(E)、河北承德(F)和北京密云(G)种群29个样本的序列全部相同,仅鉴定出一种单倍型。整体上,各单倍型之间未形成与其地理种群空间位置相对应的聚类单元,与上述各地理种群FST值、Nei氏遗传距离与各种群间空间距离间的Mantel test结果一致。同时,在单倍型网络进化图中也未发现各单倍型之间存在明显的进化关系,仅在内蒙古赤峰广兴源(B)种群中分别存在一定的变异分化,该种群的遗传变异程度相对较高。
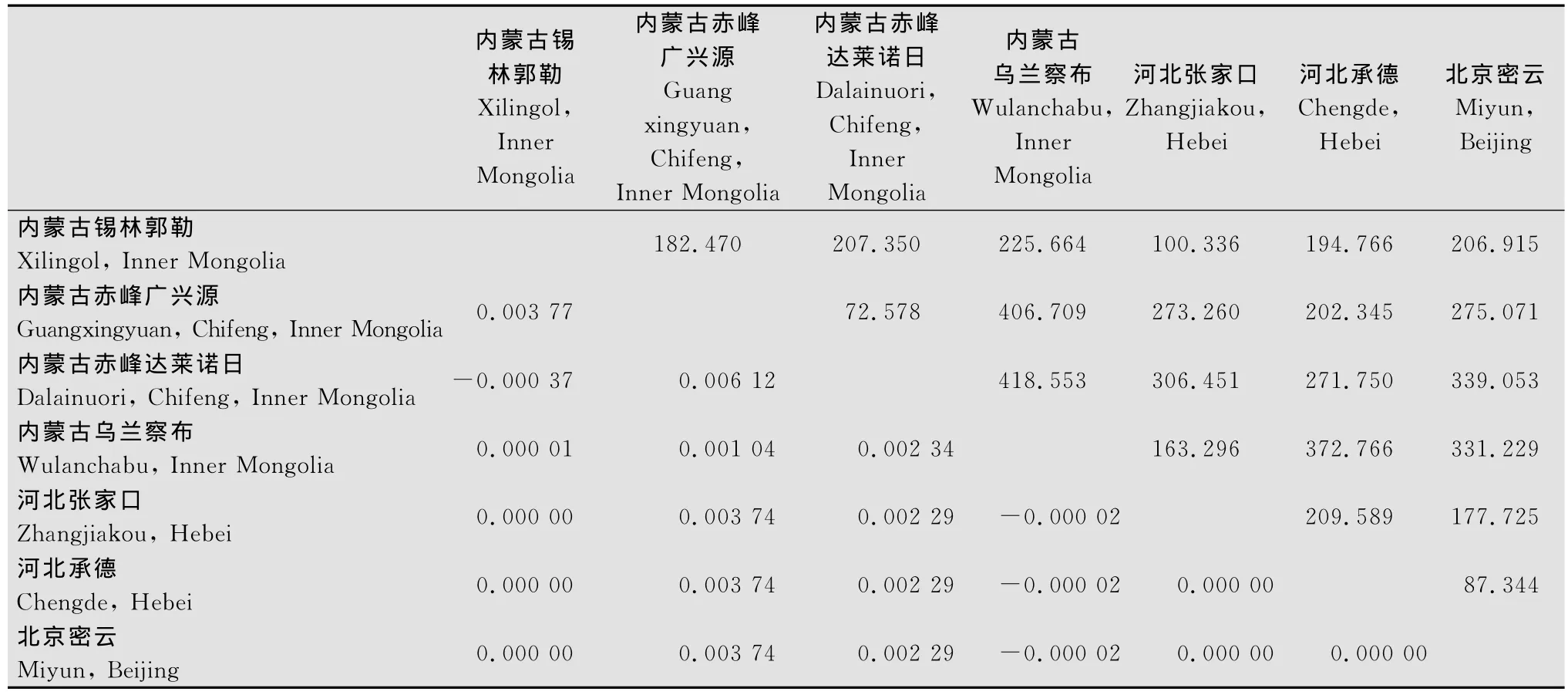
表4 7个地理种群间的Nei氏遗传距离和地理距离1)Table 4 Nei’s genetic distances and geographic distances between 7 populations of O.asiaticus
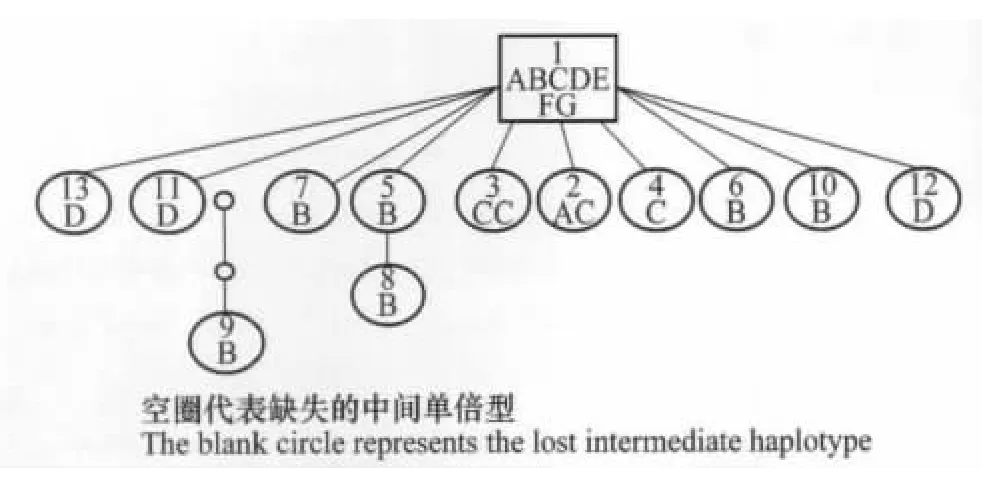
图1 单倍型最大简约网络进化图Fig.1 Network showing the most parsimonious evolutionary relationships among haplotypes
3 讨论
亚洲小车蝗mt DNA COI基因序列全长为1 541 bp[15],本研究用于分析的645 bp序列位于第47位碱基至第704位碱基之间,仅检测到12个多态性位点,占所测核苷酸的1.86%,样本总体核苷酸多样性仅为0.000 42。而高书晶等2011年所用473 bp序列位于第250位碱基至第723位碱基之间,共检测到29个核苷酸变异位点,占所测核苷酸的6.13%;在截取第250位碱基至第704位碱基之后,在454个碱基中仍鉴定出27个核苷酸变异位点,占所测核苷酸的5.95%。本研究所用样本,除内蒙古地区的4个种群外,还有河北省和北京市的3个种群,而且所用分析序列,较高书晶等2011年截取后454 bp序列多出203 bp,但本研究样本的多态性位点检出率仅为1.86%,远低于后者的5.95%,这可能是由于本研究中的实验样本均由同一年采集,并且亚洲小车蝗具备较强的飞翔能力,致使各种群之间存在着广泛的基因交流和融合造成的。
在本研究中,出现单倍型数量最多的种群是内蒙古赤峰广兴源种群,共检测出7种单倍型,这可能与该种群的样品数量最多有关;但同时,该种群的核苷酸多样性为0.000 84,也是所有种群中核苷酸多样性最高的种群。核苷酸多样性是由每个群体内各个单元型的两两配对差异的平均值得出,不依赖于样本大小和序列长度,是进行遗传座位或群体间遗传变异程度比较的理想指标。赤峰市的克什克腾旗是内蒙古草原地区亚洲小车蝗的主要分布区之一。在内蒙古赤峰广兴源地区的西北方向,分布着达里诺尔湖、岗更诺尔湖以及其他的一些面积较小的湖泊和湿地,这些水源地周边植被丰富,温湿度适宜,为亚洲小车蝗提供了较为充足的食物和生长发育条件。内蒙古赤峰广兴源种群遗传多样性较高,可能与该地区生长条件适宜,种群数量较大有关。
在本研究139个样本中,仅鉴定出13个单倍型,单倍型检出率为9.35%,样本总体单倍型多样性仅为0.205,各单倍型之间未形成与其地理种群空间位置相对应的聚类单元;同时,在单倍型网络进化图中也未发现各单倍型之间存在明显的进化关系。高书晶等2011年的研究结果也表明,亚洲小车蝗mtDNA COI序列不同单倍型之间有一定的分歧,形成不同的簇类关系,但总体上看,这种簇类关系基本上呈平行分布,没有明显的地域性差别。两次结果表明,mt DNA COI基因虽然成功用于橘小实蝇等迁飞性昆虫的种群遗传结构研究,但在亚洲小车蝗种类种群遗传关系的研究中表现却不理想,表明同一种目的基因的进化速率,在不同物种间存在着较大的差异。关于不同地区间亚洲小车蝗的迁移规律研究,还有待于选择进化速率更快的遗传标记来进行进一步研究,并适当扩大研究种群的样本数量。
[1]郑哲民,夏凯龄.中国动物志:昆虫纲:第十卷:直翅目:蝗总科[M].北京:科学出版社,2002:121-123.
[2]蒋湘,买买提明,张龙.夜间迁飞的亚洲小车蝗[J].草地学报,2003,11(1):75-77.
[3]Li Y,Wu Y,Chen H,et al.Population structure and colonization ofBactroceradorsalis(Diptera:Tephritidae)in China,inferred from mtDNA COI sequence[J].Journal of Applied Entomology,2011,136(3):1-11.
[4]吴广超,李云龙,李志红,等.基于线粒体COI基因的上海地区橘小实蝇种群遗传关系研究[J].中国农业大学学报,2012,17(2):94-101.
[5]施伟,叶辉.云南桔小实蝇(Bactroceradorsalis)季节性分布区4个地理种群遗传结构[J].生态学报,2007,27(6):2477-2482.
[6]施伟,叶辉.云南桔小实蝇五个地理种群的遗传分化研究[J].昆虫学报,2004,47(3):384-388.
[7]高书晶,李东伟,刘爱萍,等.不同地理种群的亚洲小车蝗mt DNA COI基因序列及其相互关系[J].草地学报,2011,19(5):846-851.
[8]Zhang D X,Hewitt G M.Assessment of the universality and utility of a set of conserved mitochondrial COI primers in insects[J].Insect Molecular Biology,1997,6(2):143-150.
[9]Excoffier L,Laval G,Schneider S.Arlequin ver.3.0:An integrated software package for population genetics data analysis[J].Evolutionary Bioinformatics Online,2005,1:47-50.
[10]Legendre P,Legendre L.Numerical ecology[M].Amsterdam:Elsevier,1998.
[11]Kumar S,Tamura K,Nei M.MEGA3:integrated software for molecular evolutionary genetics analysis and sequence alignment[J].Briefings in Bioinformatics,2004,5(2):150-163.
[12]Rozas J,Sánchez-DelBarrio J C,Messeguer X,et al.DnaSP,DNA polymorphism analyses by the coalescent and other methods[J].Bioinformatics,2003,19(18):2496-2497.
[13]Clement M,Posada D,Crandall K A.TCS:a computer program to estimate gene genealogies[J].Molecular Ecology,2000,9(10):1657-1659.
[14]Allendorf F W.Isolation,gene flow and genetic differentiation among populations[R].Genetics and Conservation,1983:51-65.
[15]Ma C,Liu C X,Yang P C,et al.The complete mitochondrial genomes of two band-winged grasshoppers,Gastrimargus marmoratusandOedaleusasiaticus[J].BMC Genomics,2009,10:156.
