高频超声评价2型糖尿病周围神经病变患者神经异常改变
2013-09-28周红艳张宇虹苏本利
周红艳,张宇虹,苏本利
(大连医科大学附属第二医院,辽宁 大连 116021)
本研究应用高频超声对2型糖尿病 (Type 2 diabetes mellitus,T2DM)以及合并周围神经病变(Diabetic peripheral neuropathy,DPN)患者的上肢主要神经进行检测,以探讨其临床应用价值。
1 资料与方法
1.1 研究对象
60例T2DM均为2011年12月—2012年4月在我院内分泌科住院的患者。T2DM均符合WHO的诊断标准。同时排除合并高血压、冠心病、肝肾疾病、全身大血管病变以及其他原因引起的神经病变者。按照DPN的诊断标准[1],将60例T2DM患者分为2组:其中合并DPN的为A组(30例,其中男 14 例,女 16 例,平均年龄(49.8±15.3)岁);不合并 DPN 的为B组(30例,其中男 13例,女 17例,平均年龄(47.3±13.2)岁)。选取30例健康志愿者作为正常对照组C组(30例,其中男 15 名,女 15 名,平均年龄(46.4±17.8)岁)。 A、B、C 三组在年龄及性别比例方面差异无统计学意义(P均>0.05)。
1.2 仪器与方法
采用Logiq E9超声诊断仪,探头频率为9~15 MHz。受检者取仰卧位,充分暴露双上肢,受检上肢自然平放于检查床上,探头轻放于所要检查部位。正中神经扫查:探头垂直于上肢长轴,分别于肘窝屈侧偏内侧略上方(本文简称MN1)、前臂前区腕部上方5 cm处(本文简称MN2)及腕部正中腕管处(本文简称MN3)对正中神经行横切面扫查;之后探头旋转90°行正中神经长轴扫查。桡神经扫查:受检上肢平直略向内侧旋,探头垂直于肱骨,分别于桡神经沿桡神经沟走行中距体表最近处(本文简称RN1)及肱骨外上髁略上方外侧(本文简称RN2)进行横切面扫查;然后探头旋转90°对桡神经行长轴扫查,分别向上向下延续至尽可能远的距离。尺神经扫查:受检上肢平直放于检查床上略外展,探头垂直于上肢长轴,分别于肘部内上髁与尺骨鹰嘴之间(本文简称UN1)、前臂前区正中偏尺侧腕部上方5 cm(本文简称UN2)及腕部正中偏尺侧(本文简称UN3)行尺神经横切面扫查;探头旋转90°行尺神经长轴的扫查。检查对侧上肢神经时,患者需调换头足体位。对全部受检者进行双上肢扫查,观察神经的内部回声及有无异常改变,在冻结状态下,于各支神经横切面上测量长径(D1)及宽径(D2)。 利用公式:横截面积(CSA)=D1×D2×π×1/4分别计算出CSA。
1.3 统计方法
采用SPSS 13.0统计软件,所有数据均以均数±标准差表示。三组间正中神经、尺神经及桡神经相应各节段的长径、宽径及横截面积采用单因素方差分析进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 C组各支神经超声表现
C组横切面正中神经、桡神经及尺神经多为圆形或椭圆形的高回声或中等回声,内部间以细小低回声 (神经束回声),类似蜂窝状或网格样改变,纵切面可见条状的高回声或中等回声,内可见平行的、被高回声断续分隔的低回声线状结构(神经束回声)(图 1~3)。
2.2 A、B组各支神经超声表现
正中神经:与C组相比,A组神经正中神经三个水平扫查均可见神经内部回声明显减低,条状高回声及中等回声减少,平行线状低回声结构消失,内部结构紊乱,尤以MN3为重;B组正中神经的MN1及MN2水平扫查内部回声没有明显改变,神经内部平行线状低回声仍存在,MN3内部回声略减低,神经内部平行线状低回声仅有小节段的缺失;MN3水平扫查,A组正中神经内部回声较B组更为减低,而且平行线状结构消失更重(图1)。
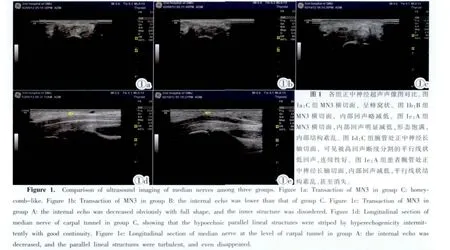

桡神经:与C组相比,A组桡神经的两个水平扫查可见神经内部回声略减低,条状高回声及中等回声略减少,平行线状低回声结构消失,B组桡神经未见明显改变(图2)。
尺神经:与C组相比,A组尺神经三个水平扫查均可见神经内部回声减低,条状高回声及中等回声减少,平行线状低回声结构消失,尤以UN3为重;B组尺神经的UN1及UN2水平扫查内部回声没有明显改变,UN3内部回声略减低,神经内部平行线状低回声不缺失或仅少量缺失;UN3水平扫查,A组尺神经内部回声较B组更低(图3)。
2.3 各组正中神经、桡神经及尺神经各个节段的D1、D2、CSA的比较
见表1。
MN1及 MN2的横断面扫查,A组正中神经的 D1、D2、CSA较C组增大,差异有统计学意义(P均<0.05),A组与B组、B组与C组间差异均无统计学意义(P均>0.05)。MN3横断面扫查,A组、B组正中神经的D1、D2、CSA较C组均明显增大,差异有统计学意义(P均<0.01),A组正中神经的D1、D2、CSA较B组均增大,差异有统计学意义(P均<0.05)。

表1 三组上肢三大神经的各节段测值对比
RN1及 RN2的横断面扫查,A组桡神经的D1、D2、CSA较B组、C组均增大,差异有统计学意义(P<0.05),B组与C组间无显著性差异(P均>0.05)。
UN1及UN3横断面扫查,A组、B组尺神经的D1、CSA较C组均增大,差异有统计学意义(P均<0.05)。A组尺神经的D1、CSA较B组均增大,差异有统计学意义(P均<0.05)。A组尺神经的D2较C组增大(P<0.05),较B组间无显著改变(P>0.05)。B组的尺神经 D2较C组无明显增大 (P>0.05)。UN2横断面扫查,A组尺神经的D1、D2、CSA较B组、C组均增大,差异有统计学意义(P均<0.05)。B组尺神经的D1、D2、CSA较C组无显著性差异(P均>0.05)。
3 讨论
DPN是糖尿病最常见的并发症,其发病率多数报道在60%左右。DPN临床上主要表现为双侧肢体末端对称性疼痛、麻木、痛觉及温度觉减退或缺失、肌无力、肌萎缩等,偶有手套、袜套样感觉障碍,一般下肢较上肢重。DPN的发生严重影响糖尿病患者的生活质量,更是糖尿病足、溃疡、感染和截肢发生的主要原因之一。糖尿病时,高血糖的高渗作用导致的缺血、缺氧极可能是DPN的始动因子,进而引起氧化应激增加、糖基化终末产物(Advanced glycosylation end products,AGEs)增加。AGEs进一步造成神经的营养因子或胰岛素样生长因子-1减少[2]。上述因素作用于神经细胞及其轴突,使得神经细胞肿胀变性,进而引发神经脱髓鞘改变,最终导致DPN 的发生[3]。
临床上对DPN常用的检查方法是神经电生理检查。通过检测出外周神经传导速度减慢、神经动作电位幅度减低或消失来诊断DPN。但神经电生理检查的缺点是有创、受外界及患者本身影响较大,并且不能准确判断病变的程度及具体位置[4]。随着高频超声的广泛使用以及分辨率的不断提高,其在外周主要神经的检测上已日渐成熟,可以清晰地显示外周神经的被膜、内部回声及结构[5]。同时应用于一些神经病变的诊断上,比如神经卡压症、肿瘤、囊性病变以及创伤[6-7]。
本研究应用高频超声对T2DM合并DPN组 (A组)、T2DM不合并DPN组(B组)以及正常对照组(C组)的正中神经、桡神经、尺神经进行检测。结果显示:高频超声可以清晰地显示各组的各支神经。其中B组仅在正中神经腕部正中腕管处(MN3水平)以及尺神经腕部正中偏尺侧(UN3水平)的内部回声略减低,神经内部平行线状低回声仅有小节段的缺失。而A组三支神经的所有节段内部回声均发生了改变,表现为回声减低,横切面的蜂窝状或网格样结构紊乱或消失,纵切面平行分布的低回声结构消失。该结果表明,T2DM不合并DPN患者的上肢主要神经的某些节段在超声声像图上已经发生了异常改变。而T2DM合并DPN患者的上肢主要神经的改变又更为严重。糖尿病的高血糖可以导致神经的血供减少、缺氧等,受影响的主要是神经内膜,神经束的血供及营养主要靠神经内膜,所以最终导致神经束缺血、梗塞、水肿,使得神经束结构改变,从而引起神经内部回声的减低,平行线状低回声(即神经束)的减少及消失[8]。本研究结果同时显示,A组三支神经所有节段及B组的部分节段的D1、D2、CSA均较C组增大,A组的部分节段的D1、D2、CSA较B组增大。高血糖本身可以诱使外周神经水肿、增粗。此外,在腕管、肘部尺神经管、Guyon管、内踝跗管等处本身就存在着正常的生理肌性或骨性狭窄,这使本已肿胀的外周神经更易发生卡压,进而加重该处神经的缺血、缺氧,使脱髓鞘病变加重,使此处的DPN发展得更为显著[9]。但A、B组之间,以及B、C组之间的部分节段的管径和截面积无明显差异,目前尚未见关于T2DM以及DPN患者上述三支神经详细节段的超声测量的报道,可能与本研究的样本量较小以及病程有关,这方面的研究尚需进一步进行。国内外均有学者[10-11]应用高频超声对DPN患者的正中神经进行的研究,本研究结果与其均一致,但两者仅显示了正中神经在MN3水平上的改变,未对其他切面进行检测。
由于上肢外周神经结构细微,与周围的结缔组织、肌腱等结构在某些切面上有时较难辨别,对于操作者的手法和经验要求较高。熟悉外周神经的正常解剖、走形以及正常超声声像图特征是我们能够诊断外周神经病变的前提。检查外周神经时,检查者手法要轻,患者应尽量放松,尤其是关节处,否则可能会影响测值。应充分利用神经周围伴行的动、静脉及某些骨性标志来识别及观察其回声、形态等,这样既可以提高检查的准确性,又可以减少检查时间。利用高频超声扫查上肢外周神经时,连续的横切面观察更容易确定神经的位置,而纵切面扫查应该是在横切面已确定后再旋转探头进行,应用纵切面可以整体观察神经内部结构、回声及神经外膜的连续性等。此外,超声显像利用的是声学原理,某些情况下可能会产生一些伪像,但由于这方面的研究尚少,故未见到关于超声伪像对于神经显示的影响,有待进一步研究。
综上所述,高频超声具有无创、直观、准确、可重复检查等优点,可对T2DM,尤其是合并DPN的患者上肢主要神经病变作出诊断以及程度的判定,为临床的诊断和治疗提供依据。
]
[1]Boulton AJ.Diabetic neuropathy:classification,measurement and treatment[J].Curr Opin Endocrinol Diabetes Obes,2007,14(2):141-145.
[2]刘娟,张燕,席平.前列腺素E治疗糖尿病周围神经病变疗效观察[J].中国综合临床,2004,20(11):1003.
[3]Biddinger KR,Amend KJ.The role of surgical decompression for diabetic neuropathy[J].Foot Ankle Clin,2004,9(2):239-254.
[4]Uluc K,Isak B,Borucu D,et al.Medial plantar and dorsal sural nerve conduction studies increase the sensitivity in the detection of neuropathy in diabetic patients[J].Clin Neurophysiol,2008,119(4):880-885.
[5]Tagliafico A,Tagliafico G,Martinoli C.Nerve density:a new parameter to evaluate nerve pathology on ultrasound.preliminary study[J].Ultrasound Med Biol,2010,36(10):1588-1593.
[6]Bianchi S.Ultrasound of the peripheral nerves[J].Joint Bone Spine,2008,75(6):643-649.
[7]Koenig RW,Pedro MT,Heinen CP,et al.High-resolution ultrasonography in evaluating peripheral nerve entrapment and trauma[J].Neurosurg Focus,2009,26(2):E13.
[8]Gooch C,Podwall D.The diabetic Neuropathies[J].Neurologist,2004,10(6):311-322.
[9]Bianchi S,Montet X,Martinoli C,et al.High-resolution sonography of compressive neuropathies of the Wrist[J].J Clin Ultrasound,2004,32(9):451-461.
[10]Watanabe T,Ito H,Sekine A,et al.Sonographic evaluation of the peripheral nerve in diabetic patients[J].J Ultrasound Med,2010,29(5):697-708.
[11]孙冬梅,王艳滨,刘洋,等.2型糖尿病伴周围神经病变症状患者正中神经的超声特征 [J].中国超声医学杂志,2011,27(12):1126-1128.
