甘草查尔酮B体外细胞毒作用研究
2013-09-27冉芳杨帆杨新惠王振华张波郑秋生
冉芳,杨帆,杨新惠,王振华,张波,郑秋生
(石河子大学药学院/新疆特种植物药资源教育部重点实验室,石河子,832002)
甘草查尔酮B(Licochalcone B,LCB)是一类查尔酮类化合物。查尔酮类化合物分子能与不同的生物受体结合,对肿瘤细胞增殖具有显著的抑制作用,其作用机制包括:抑制微管蛋白聚合、抗血管生成、诱导凋亡、抗雌激素以及逆转多药耐药性[1]。研究表明,查尔酮是具有应用前景的新型抗肿瘤先导化合物。本研究旨在观察甘草查尔酮B对肿瘤细胞的增殖抑制作用,初步探讨其作用机制,为进一步研究甘草查尔酮B的抗肿瘤作用提供实验依据。
1 材料与方法
1.1 细胞株与药物
MCF-7、T24、HeLa、B16F10、B16F0购买于中国典型培养物保藏中心,本实验室保种。甘草查尔酮B购自上海丽臣公司,纯度大于98%,用DMSO配制成2×104μg/mL母液备用,用前用完全培养基稀释成所需浓度,各给药组DMSO浓度不大于0.5%。
1.2 主要试剂
RPMI1640培养基、胰蛋白酶、二甲基亚砜(DMSO)购自Gibco公司;胎牛血清购于杭州四季青公司;四甲基偶氮唑盐(MTT)、台盼蓝(Typan blue)购自北京拜尔迪生物技术公司;JC-1染料购自Sigma公司。
1.3 方法
1.3.1 细胞增殖实验
细胞增殖实验使用MTT法,于96孔板中进行。取对数生长期细胞按5000个/孔接种于96孔板中,待细胞完全贴壁后,设不同浓度梯度,加药100μL,每组设6个复孔,继续培养24h后,每孔加入 MTT工作液(5.0mg/mL)20μL,继续培养4h,弃去培养液,每孔加入150μL DMSO,微量振荡器振荡10min使结晶物充分溶解,酶标仪在570nm检测波长,630nm参考波长下检测每孔的吸光度(A)值。
计算药物对细胞增殖的抑制率(IR)=(1-A给药孔/A对照孔)×100%,再根据药物浓度对应细胞增殖抑制率作线性回归,根据直线方程计算药物对细胞增殖的半数抑制浓度(IC50)。
1.3.2 台盼蓝拒染法测定致死率[2]
取细胞对数生长期的B16F0细胞,计数并调整细胞悬液的浓度为1×105/mL,按3mL孔加入6孔板中,加甘草查尔酮B,其终浓度分别为5.0、7.5、10.0、12.5μg/mL,培养24h。取90μL细胞悬液加于200μL离心管中,再加入10μL0.4%台盼蓝染液,用细胞计数器计数死细胞个数,计算甘草查尔酮B对B16F0细胞的致死率。
1.3.3 相差显微镜观察细胞形态学
取细胞对数生长期的B16F0细胞,计数并调整细胞悬液的浓度为1×105/mL,按3mL/孔加入6孔板中,加甘草查尔酮B,其终浓度分别为7.5和12.5μg/mL,培养24h,于倒置相差显微镜观察细胞数。
1.3.4 线粒体膜电势测定
取甘草查尔酮B处理2h的B16F0细胞,台盼兰染色法进行计数,取1×106个/mL细胞,离心(1500g×5min),弃上清液,加2mL PBS缓冲液润洗一次,加100μL的10μmol/L JC-1荧光染料重悬细胞、混匀,然后将细胞置于37℃水浴中20 min,用PBS润洗2次,洗去未结合的荧光染料,酶标仪进行线粒体膜电势检测红色/绿色荧光强度比值衡量线粒体去极化程度。
1.3.5 数据处理
2 结果与分析
2.1 甘草查尔酮B对5种细胞的生长抑制作用
实验结果见表1。
由表1可知:甘草查尔酮B以不同浓度分别作用于 MCF-7、T24、HeLa、B16F10、B16F0 5种肿瘤细胞24h后,细胞生长均受到不同程度的抑制,并呈量效关系,其IC50分别为12.1、11.12、12.38、12.14、10.73μg/mL。
为了进一步研究甘草查尔酮B对肿瘤细胞增殖机制,我们在下面试验中选取B16F0细胞作进一步探讨。

表1 甘草查尔酮B对5种细胞的生长抑制作用X±S,n=3Tab.1Growth inhibition of LCB in five kinds cell
2.2 甘草查尔酮B对B16F0细胞致死率
不同浓度甘草查尔酮B(5~15μg/mL)处理24 h后,采用台盼蓝拒染法对B16F0细胞的致死率进行检测,结果见图1。

图1 甘草查尔酮B对B16F0细胞致死率的影响Fig.1Effects of LCB on the fatality rate in B16F0cells
由图1可知:甘草查尔酮B以不同浓度作用于B16F0细胞24h后,随着药物浓度的增加,细胞的死亡率也增加。
2.3 细胞形态学变化
相差显微镜下观察细胞,结果如图2所示。
由图2可知:正常B16F0贴壁生长,分布均匀,细胞接触紧密。甘草查尔酮B作用于细胞24h后,细胞间隙增大,脱壁细胞增多漂浮在培养基中,并且随着药物浓度的增加,上述变化愈加明显。
2.4 甘草查尔酮B对B16F0细胞△ψm的影响
结果见表2。

图2 相差显微镜观察B16F0细胞形态学变化Fig.2The effect of LCB on morphological changes of B16F0cell under phase contrast microscope
由表2可知:JC-1是一种阳离子荧光染料,由于线粒体内膜的电负性而聚集在活细胞线粒体内形成多聚体,呈鲜红色荧光;但在凋亡细胞内,由于△Ψm的破坏,不能聚集到线粒体内,以单体的形式存在于胞质发绿色荧光;红色/绿色荧光强度比例下降,通过荧光颜色的转变来检测线粒体膜电位的变化。B16F0细胞经5、7.5、10、12.5、15μg/mL的甘草查尔酮B作用24h后,线粒体膜电势降低,且呈现浓度依赖关系。
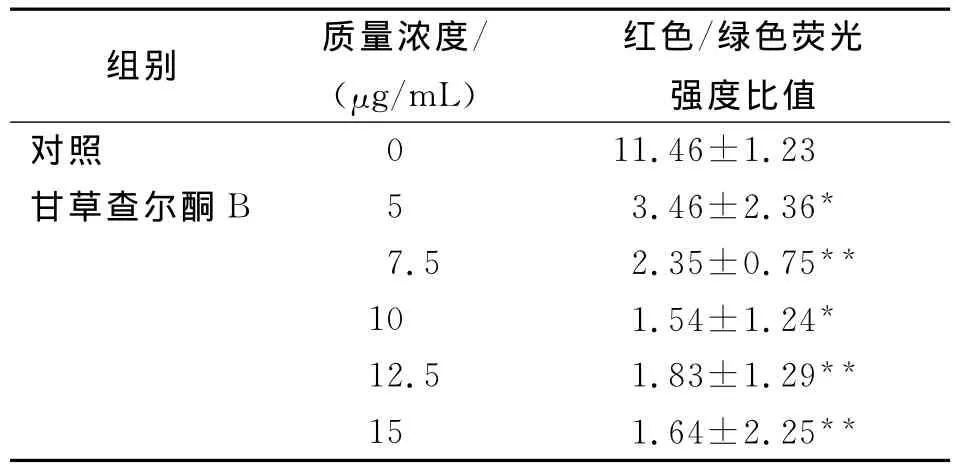
表2 甘草查尔酮B对B16F0细胞△ψm的影响X±S,n=3Tab.2Effects of LCB on△ψm in B16F0cells
3 讨论
甘草查尔酮B是一类查尔酮类化合物。甘草查尔酮B具有显著的抗菌作用,对革兰氏阳性菌具有较强的抑制活性[3]。甘草中的5种查尔酮类成分均具有抗氧化作用,其中以甘草查尔酮B和C的作用最为显著,认为查尔酮的B环结构与抗氧化活性密切相关[4-6]。甘草查尔酮A和B能够增加花生四烯酸的形成,抑制凝血酶诱导的血小板聚集作用[7]。本研究通过MTT和台盼蓝检测发现,甘草查尔酮B对B16F0细胞的恶性增殖具有抑制作用,并且诱导线粒体膜电势降低,且呈现浓度依赖关系。
本研究发现甘草查尔酮B对5种细胞增殖活性均有抑制作用,并且细胞生长均受到不同程度的抑制,且呈量效关系。选取B16F0细胞进行台盼蓝拒染实验,随着药物浓度的增加,细胞的致死率略微有所增加,与对照组相比,药物处理组并无显著差异。肿瘤细胞的增殖受到抑制的可能机制主要有4种:1)是引起细胞的死亡(包括凋亡);2)是引起细胞周期各时相的等比例延长;3)是细胞被阻滞在周期中的某一个时相;4)是细胞发生再分化,失去了肿瘤细胞的恶性特征[8]。
研究表明,在不同因素诱导的细胞凋亡中,在细胞形态学改变之前均出现线粒体膜电位的下降。可见,线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程。抑制线粒体膜电位下降,就可能阻抑细胞凋亡的发生,说明线粒体膜电位下降为凋亡的特征性改变[9]。经对诱导凋亡后的细胞进行流式细胞术分析检测也表明,线粒体膜电位的下降要早于DNA断裂和胞膜磷脂酰丝氨酸外翻,也早于凋亡时细胞的形态学改变、蛋白酶Caspase-3激活等变化,提示线粒体膜电位下降是凋亡早期阶段[10]。本实验应用JC-1染色,发现甘草查尔酮B各浓度作用于B16F0细胞24 h后,线粒体膜电势降低,且呈现浓度依赖关系。由此推测,甘草查尔酮B对B16F0细胞的增殖抑制作用可能与其诱导细胞凋亡的作用有关。
综上所述,甘草查尔酮B能够抑制B16F0细胞的恶性增殖。实验结果检测到甘草查尔酮B以不同浓度作用于B16F0细胞,随着药物浓度的增加,细胞的致死率略微有所增加;相差显微镜下观察细胞,细胞增殖变慢,细胞间隙增大,脱壁细胞增多漂浮在培养基中,并且随着药物浓度的增加,上述变化愈加明显;线粒体膜电势降低,且呈现浓度依赖关系。从而推测,甘草查尔酮B对B16F0细胞的增殖抑制作用可能与其诱导细胞凋亡的作用有关。虽然甘草查尔酮B对B16F0细胞的增殖抑制作用机制还不清楚,但是本研究结果表明,更深入地探讨其诱导细胞凋亡的分子机制是十分有价值的,甘草查尔酮B有可能成为治疗恶性肿瘤的候选化合物。
[1]Ducki S.The development of chalcones as promising anticancer agents[J].Drugs,2007,10(1):42-46.
[2]Renzi D,Valtolina M,Foster R.The evaluation of a multi-end-point cytotoxicity assay system[J].ATLA 1993,21:89-96.
[3]Abe H,Ohya N,Yamamoto K F,et al.Effects of glycyrrhizin and glycyrrhetinic acid on growth and melanogenesis in cultured B16melanoma cells[J].Eur J Cancer Clin Oncol,1987,23(10):1549-1555.
[4]傅乃武,刘朝阳,张如意,等.甘草黄酮类和三萜类化合物抗氧化作用的研究[J].中药药理与临床,1994,7(5):26-29.
[5]朱少华,王大进,张玲莉,等.甘草查尔酮抗脂质氧化剂及自由基的实验研究[J].同济医科大学学报,1996,25(1):25-27.
[6]Kun Zou,Yuying Zhao,Naiwu Fu,et al.Antioxidant constituents from G inflate Bat,Root[J].Journal of Chinese Pharmaceutical Sciences,1996,5(4):182-185.
[7]蔡幼清.胀果甘草根中分离的黄酮类化合物对花生四烯酸代谢和人体血小板聚集的作用[J].国外医学中医中药分册,1994,16(4):41.
[8]翟中和,王喜忠,丁明孝,等.细胞生物学[M]·3版.北京:高等教育出版社,2007:8.
[9]胡硕,胡成平.线粒体与细胞凋亡的研究进展[J].国际呼吸杂志,2006,26(6):463-470.
[10]陈慧莉,李建华.线粒体跨膜电位和细胞凋亡相关性的研究[J].医学综述,2007,13(14):1041-1043.
