核磁共振骨皮质成像关键技术研究进展*
2013-09-27包尚联杜江2高嵩3
包尚联 杜江2) 高嵩3)†
1)(北京大学物理学院,医学物理和工程北京市重点实验室,北京 100871)
2)(美国加利福尼亚大学圣迭哥分校放射学系,美国圣迭哥CA 92103-8226)
3)(北京大学医学部医学影像物理实验室,北京 100191)
(2013年1月5日收到)
1 引言
骨是人体内硬度仅次于牙齿的坚硬组织,在支撑人体、保护内脏、参与运动及代谢等方面具有重要作用[1].骨质疏松症是一种以骨强度下降、骨折风险增加为特征的全身性疾病,发病率随着年龄的增加显著升高,女性发病率高于男性.我国骨质疏松症患者人数已居世界首位,随着社会老龄化进程加快,骨质疏松症患者将大量增加,给家庭及社会均带来沉重负担.所以骨质量检测技术是当前医学物理领域的研究热点和前沿问题.
最早的非侵入式骨质量检测方法是X射线平片法,通过第二掌骨或脊椎的X射线平片中光的透射率了解骨中矿物质的含量.由于骨中主要矿物质羟磷灰石对X射线的衰减与铝接近,所以可用铝阶梯作为参照物估算骨矿物密度.此方法的缺点是不能早期诊断,不能区分骨皮质与骨小梁,不能得到定量结果,拍片参数改变会导致较大误差等.20世纪70年代提出的单能或双能光子吸收法可显著提高测量的准确性,但必须使用放射性同位素(如125I),扫描时间较长,设备复杂,需要根据同位素半衰期对结果进行校正.双能X射线吸收测量法(double-energy X-ray absorptiometry,DXA)使用两种不同能量的X射线扫描被测部位,理论上通过计算可排除软组织的影响,得到较准确的平均骨矿物密度(bonemineral density,BMD).DXA是当前骨质检测的金标准,在临床骨病防治及药物研究中得到广泛应用.近年来还出现了定量显微CT法,但放射剂量大,而且在预测骨折能力方面有争议.定量超声法设备简单,没有辐射,但精度低、重复性差,且仅能检测跟骨.
以上各方法最主要的缺点是仅能了解骨矿物质含量信息.需要注意的是,除矿物质外,有机基质和水是骨皮质的另外两种主要组成物质,约占骨皮质总体积的57%,对骨的力学性质有重要影响[1].但通过BMD值不能评估这两类物质.多项临床研究表明BMD指标有局限性,例如通过BMD很难区分骨质疏松症与骨软化症[2-4].因此需要一种更敏感、更全面的无创定量骨质评估方法,综合考虑骨的微结构、孔隙率、有机基质、骨中的水成分及骨灌注,而不是依靠单一的BMD值[5-7].
磁共振成像(magnetic resonance imaging,MRI)方法有望解决以上问题.骨MRI信号衰减极快,用传统MRI的脉冲序列无法检测到骨的信号,不能实现骨及其周围组织的成像.为了解决这一问题,美国加州大学圣迭哥分校杜江教授领导的研究小组与北京大学物理学院医学物理和工程北京市重点实验室合作,围绕骨磁共振成像(bone MRI,bMRI)成像,在理论、方法、设备等方面做了大量的研究工作.bMRI包括定性和定量两个层次的工作,前者从成像原理出发,解决成像理论、成像方法,用于估计骨的生物学和力学特性;后者是把bMRI定性测量中涉及的物理学和生物学参数定量化,更准确、更全面地评价骨质量.所以bMRI有重要理论价值与广阔的临床应用前景.本文对以超短回波(ultrashort echo time,UTE)为基础的bMRI及其所面临的问题与发展方向进行综述.
2 UTE骨皮质成像方法
2.1 定性UTE成像
UTE使用半sinc函数型RF脉冲,结合层面选择梯度磁场实现快速层面激发,采用放射状轨迹填充k空间,回波时间(echo time,TE)可降至100µs以下.同理使用短硬脉冲激发及三维放射状采集可实现三维UTE成像.半sinc函数型RF脉冲选层效果不好,而且容易受到涡流的影响.使用两个半sinc函数型RF脉冲结合两个极性相反的选层梯度磁场以及涡流补偿技术可以改善选层效果[8].另外,骨皮质内侧、脂肪外侧有肌肉,脂肪及肌肉的T2较长,而骨皮质T2极短,普通UTE的结果会受到长T2组织信号的严重干扰,必需设法压制脂肪及肌肉的信号才能实现骨皮质成像.为了更好地直接观察骨皮质及其周围组织,出现了多种UTE改进方案,主要分为以下三类.
2.1.1 双回波差UTE

图1 三种改进UTE脉冲序列示意图 (a)双回波差UTE;(c)单绝热反转恢复UTE;(e)双绝热反转恢复UTE;右侧图(b),(d),(f)分别是三种脉冲序列对应的短T2对比度形成机制
在UTE成像过程中先后采集两个TE不同的回波信号,两信号直接相减可抑制长T2信号[9,10].如图1(a)所示,第一个自由衰减(free induction decay,FID)信号中长短T2信号均较强;经过一段时间,短T2信号快速衰减,所以第二个FID信号主要由长T2信号构成.第一个回波减去第二个回波可以选择性地压制长T2组织对结果的影响,提高短T2组织对比度.此方法虽然简单,但结果中会残留较强的长T2信号而影响短T2组织图像对比度.为此,将第一个回波信号按某一比例降低,使得在相减后图像中长T2组织的信号小于零,而短T2组织的信号大于零,从而有效提高短T2组织(如骨皮质)图像的对比度.双回波差UTE的优点是方法简单、结果分辨率高,而且对B1及B0场的不均匀性不敏感.主要缺点是第二个回波的TE较长,信号较弱,而且结果容易受到涡流、磁化率的影响[10].
2.1.2 绝热反转恢复UTE
如图1(c)所示,使用一个绝热Silver-Hoult型反转脉冲(持续86 ms)反转长T2组织的纵向磁化矢量[11].绝热脉冲对B0场的不均匀性不敏感,所以当脉冲幅度大于绝热极限之后可以较一致地反转各部位纵向磁化矢量.在绝热脉冲期间,短T2物质的纵向磁化矢量会被部分饱和.经过一段时间TI后,长T2组织的磁化矢量接近零点,此时开始采集数据.通过Bloch方程的模拟可知,优化的重复激发时间(repetition time,TR)与TI的组合可以使长T2组织信号衰减85%(见图2,假设肌肉及脂肪的T1分别为1400及350 ms)[11].由于脂肪的T1与肌肉的T1相差较大,所以它们的纵向磁化强度不会同时到达零点,导致结果中仍然会残存长T2组织的信号.

图2 单绝热反转UTE结果中残存的长T1组织信号受TI及TR影响的模拟结果,右侧色标为被压制的肌肉及脂肪信号所占比例
双绝热反转UTE方法可以更有效压制长T2组织信号(图1(e))[12].两个绝热反转脉冲相继反转长T2的水和脂肪的纵向磁化矢量.由于水的T1较长,所以首先反转水的纵向磁化矢量.短T2组织在绝热脉冲期间有显著的横向弛豫效应,所以骨皮质不受两个绝热反转脉冲影响.TI1与TI2分别使水和脂肪的磁化矢量相继到达0,然后分别采集两次数据.适当的TI1,TI2及TR组合可以得到很好的同时压制水和脂肪信号的图像,而且对B0场及B1场的不均匀性不敏感.
2.1.3 偏共振饱和UTE
偏共振饱和方法与UTE结合可以得到高对比度的骨皮质影像[13].骨皮质包含水及胶原蛋白,其T2∗很短,所以共振谱线较宽.在频率域,将一个RF脉冲放在远离水和脂肪等长T2物质狭窄谱线的位置,但与短T2∗组织的较宽谱线有数千赫兹的重叠,这样的RF脉冲可通过直接饱和、交叉弛豫及化学交换三种方式压制骨皮质的信号,对肌肉脂肪等软组织的作用很小.直接饱和即饱和被有机基质束缚的水分子,胶原蛋白中的质子及束缚水中的质子之间会发生质子-质子交叉弛豫,自由水及束缚水分子之间会发生化学交换.用一个常规UTE图像减去这个偏共振饱和UTE图像可以得到高对比的骨皮质图像(图3).
2.1.4 UTE波谱成像
一系列不同TE条件下采集的MR图像经过傅里叶变换可得到波谱图.在t时刻的MRI复数图像可表示为
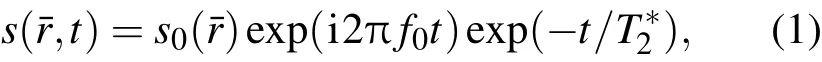
其中f0是共振频率,r¯是图像空间的位置,s0(r¯)是有效的可观测到的质子密度分布,可通过图像信号和已知水含量模体的信号比较得到s0(r¯).模体中液体由20%蒸馏水H2O与80%的重水D2O组成,加入MnCl2调整液体的T1及T2∗分别约等于5 ms及400µs.通过傅里叶变换得到波谱分布:

由波谱信息可以得到幅值图:

用幅值图可以避免相位误差对结果的影响,简化成像过程.

图3 偏共振饱和UTE方法示意图(饱和脉冲中实线虚线分别为硬饱和脉冲及Fermi饱和脉冲)
UTE波谱成像需要花费大量时间来采集不同TE的信号.将UTE与高欠采样交错多回波可变TE采集方法结合可以有效减少UTE波谱成像需要的时间.投影数据高欠采样,加速因子可达50—100,这样可以显著缩短整个扫描时间.另外,欠采样的投影交错排列会产生振荡条纹,这样条纹会自动偏移至波谱的高频区域,得到没有条纹的水的图像.UTE波谱成像可得到化学位移、总磁化率、共振频率位移及相位演进等信息.以上信息可使用常规医用MRI系统一次扫描得到,所用时间少于10 min.
2.2 UTE定量测量
为了更准确地评价骨质,需要得到定量化的骨生物学参数,如短T2组织的T1及T2∗等物理量,以及骨灌注、质子密度、骨皮质孔隙度、水含量、自由水和束缚水的比例等.自由水与束缚水对骨皮质力学性质的贡献不同.自由水及束缚水与骨所能承受的最大压力分别呈负相关与正相关[14].通过测量T1及T2∗可以得到骨中水的状态,通过自由水与束缚水的含量可分别得到骨皮质的孔隙度与有机基质密度[15,16],也可监测骨折后的恢复情况[17].使用磁化转移(magnetization transfer,MT)技术同样可以得到自由水与束缚水在骨皮质中的比例[18].正常的骨灌注对骨的健康十分重要,骨灌注与骨重建之间有直接的关系,随着年龄的增加,骨灌注呈下降趋势[19].最近的研究表明,骨质疏松对骨髓的灌注有一定影响,而且骨灌注与BMD之间有显著的正相关关系[20,21].低骨质及骨质疏松被试的股骨近端骨灌注下降,在BMD下降的同时血管通透性及血浆消去率均下降[21].当前骨皮质UTE定量测量方法分为以下三类.
2.2.1 定量测量T1,T2∗及含水量
与反转骨磁化矢量相比,饱和骨磁化矢量更容易实现[22],所以可用饱和恢复UTE方法定量测量骨皮质T1[13].在此方法中,一个非选择性90°矩形硬脉冲(时长约265µs,受到RF系统的限制)后与一个破坏梯度用于使长短T2核素均被饱和.在逐步增加的饱和恢复时间条件下,UTE采集数据用于探测骨皮质纵向磁化矢量的恢复.最后用指数衰减模型拟和采集到的信号,可得到T1值.
使用TE逐步增加的UTE序列采集信号,通过分析数据可以得到骨皮质的T2∗.但是,变化的TE会导致随时间变化的涡流对信号影响的改变,导致层面轮廓及长T2信号对结果影响的变化[23],这样得到的T2∗值误差很大.用绝热反转和T2零点方法压制长T2信号可以显著减少长T2信号对结果的不利影响.然后使用指数衰减模型拟合信号可以得到较准确的骨皮质T2∗值.
骨皮质中自由水与束缚水的横向弛豫时间不同,双指数拟合方法可以更接近实际地分析T2弛豫时间曲线[24,25].可假设采集的骨皮质信号衰减模型是

其中AS与AL分别是短长T2∗部分所占权重,N为噪声信号.在双指数拟合之前对UTE T2∗信号进行归一化,可以减少(4)式中一个权重参数.用基于最大似然估计模型的算法估算背景噪声,可以减少(4)式中的噪声参数[26,27].在拟合中使用基于n阶第一类贝塞尔函数的噪声校正模型以减小对噪声的敏感度[28].
直接用MRI研究骨的含水量面临三个技术挑战.首先,自由水的T2大于100 ms,常规MRI系统可探测到自由水的信号,但骨皮质中自由水含量很低,所以很难用以成像.健康人骨皮质中水分子大部分被束缚在骨基质或矿物质上,只有一小部分以自由水形式存在于哈弗氏结构或腔隙-小管系统中[29].一般情况下水在骨中所占体积比仅20%左右[30,31].这样自由水在骨皮质中体积比只有4%左右.其次,直接骨成像对动态范围要求很高.骨皮质被骨髓(内部)和肌肉(外部)包围,这些组织的质子密度高达80%—90%.第三,骨结构成像需要高分辨率,这导致结果的SNR下降.可以采集轴位像并加大层厚来提高结果的SNR.另外可通过比较UTE得到的骨与外部参考物的信号强度,直接得到骨含水量[11,32].
2.2.2 磁化转移UTE
近年来MT方法已经被用于定量评估束缚水与自由水的T1,T2及比例等[33,34].常规MT序列由一个偏共振饱和脉冲及常规自旋回波或梯度回波成像序列组成.偏共振饱和脉冲是一个远离自由水狭窄共振峰但仍位于束缚水共振峰内的高斯脉冲,脉冲谱宽度数千赫兹.这个偏共振脉冲可以选择性饱和束缚水,束缚水与自由水不停地交换,这导致纵向磁化强度的损失,进而自由水磁化强度减弱.MT是研究组织内束缚在大分子上的水与自由水相互作用的理想工具.不足之处是常规MT序列只能用于长T2组织,如关节软骨及肌肉等,不能观测骨皮质等短T2组织的MT效应.
正在研究的磁化矢量准备2D或3D UTE有可能解决以上问题.Springer等最先研究了牛及人骨皮质的磁化矢量转移对比成像,他们在3D UTE序列中先使用一个高斯形偏共振饱和脉冲作为MT的准备,然后用一个矩形RF脉冲进行3D激发(图4)[18].通过一系列不同频率的偏共振MT脉冲得到3D UTE数据,通过这些数据得到磁化转移率(MT ratio,MTR).可在3T MRI设备上得到人体胫骨的定量磁化转移率图,这说明在体研究骨皮质的MT效应是可行的.
2.2.3 骨灌注
动态对比增强(dynamic contrast enhanced,DCE)MRI已经被用于多种人体组织的动力学分析,如脑损伤及体部肿瘤[35].DCE需要使用快速的梯度回波序列测量感兴趣区的动态MRI信号[36].骨皮质区域缺少可被探测的信号限制了DCE-MRI在骨灌注方面的应用.UTE序列为评估骨皮质的灌注情况提供了一种可行方案.2D UTE采取短TR(如约20 ms)采集,使得对比剂动态图像在骨皮质区域可以有相对较高的空间分辨率与时间分辨率(20—30 s/帧)[37].通过经典的Tofts模型可得到多个参数,如:转运常数Ktrans,衰减速率Kep及血浆体积比Vp等[37,38].用UTE方法直接评估骨灌注及药代动力学模型可以进一步提高对骨血管分布、新陈代谢及相关疾病的了解.
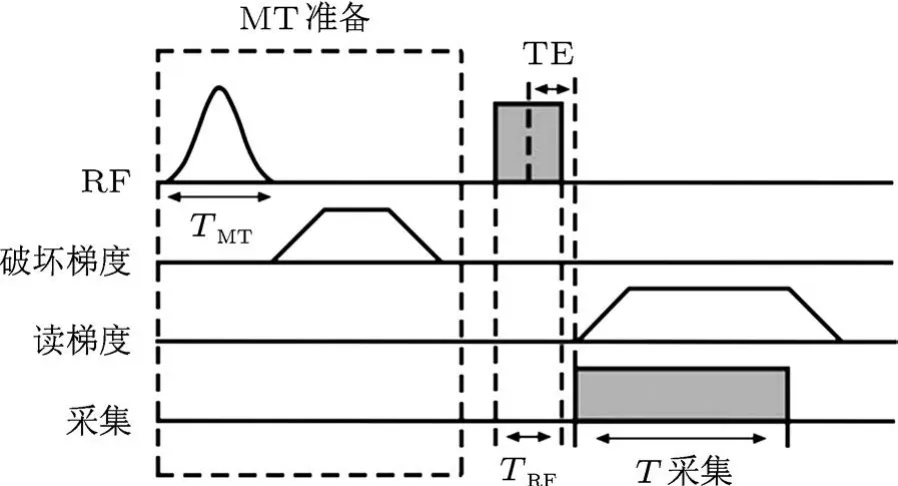
图4 3D MT UTE脉冲序列示意图
3 骨磁共振成像技术bMRI技术发展方向
虽然世界上bMRI的研发工作已经开始多年并取得一定进展,但尚未在临床应用和推广,很多问题需要进一步深入研究.骨皮质UTE成像技术从理论研究到实际应用需要分为四步解决如下问题:第一步是在物理原理上走通,包括理论推导和数学建模,以及成像的物理参数定量化;第二步确定描述骨特性的生物学参数值(例如BMD、骨中束缚水含量、自由水含量、孔隙度、灌注能力及骨中蛋白质含量等)与骨的生物力学性质之间的定量关系,完成从形态学成像到生物学参数成像的过程;第三步,通过临床试验确定生物力学参数与临床病理参数(例如骨质疏松的分类和分级)的定量关系;最后,在总结归纳临床数据的基础上,把生物学参数进行集总分析,形成对临床病理敏感且易于操作的集总参数,便于在临床推广及应用.
现阶段仅完成了第一步工作,第二步工作已经开始,还有很多工作没有完成,第三和第四步工作还没有开始.所以UTE定性与定量骨皮质成像还有大量的研究工作需要尽快完成.利用国内在多模态成像方面的优势[39-41],以及磁体设计方面的优势[42],用一个多模态成像设备一站式完成多种测量和分析任务,得到各种骨质量评价、骨病诊断和疗效评估需要的数据,这将是骨科疾病诊疗的革命性进步,是医学物理工作者和医学工作者共同的目标.
[1]Bao SL,Zhou C N,Guo Z G 2010 Biology Fundamental Theory of Medical Imaging(1st Ed.)(Beijing:Higher Education Press)p99(in Chinese)[包尚联,周传农,郭占国2010医学影像生物学基础(第1版)(北京:高等教育出版社)第99页]
[2]Faulkner K G 2000 J.Bone Miner.Res.15 183
[3]Schuit SC,Klift M,Weel A E,Laet CE,Burger H,Seeman E,Hofman A,Uitterlinder A G,Leeuwen JP,Pols H A 2004 Bone 34 195
[4]Cummings SR,Karpf D B,Harris F,Genant H K,Ensrud K,LaCroix A Z,Black D M 2002 Am.J.Med.112 221
[5]Bousson V,Meunier A,Bergot C,Vicaut E,Rocha M A,Morais M H,Laval-Jeantet A M,Laredo JD 2001 J.Bone Miner.Res.16 1308
[6]Burghardt A J,Kazakia GJ,Ramachandran S,Link TM,Majumdar S 2010 J.Bone Miner.Res.25 983
[7]Diab T,Vashishth D 2005 Bone 37 96
[8]Josan S,Pauly JM,Daniel B L,Pauly K B 2009 Magn.Reson.Med.61 1083
[9]Robson M D,Gatehouse PD,Bydder M,Bydder GM 2003 J.Comput.Assist.Tomogra.27 825
[10]Du J,Bydder M,Takahashi A M,Carl M,Chung C B,Bydder G M 2011 Magn.Reson.Imag.29 470
[11]Du J,Carl M,Bydder M,Takahashi A,Chung CB,Bydder GM 2010 J.Magn.Reson.207 304
[12]Du J,Takahashi A M,Bae WC,Chung CB,Bydder GM 2010 Magn.Reson.Med.63 447
[13]Du J,Takahashi A M,Bydder M,Chung CB,Bydder GM 2009 Magn.Reson.Med.62 527
[14]Horch RA,Gochberg D F,Nyman JS,Does M D 2011 PLoSONE 6 e16359
[15]Bae WC,Chen PC,Chung CB,Masuda K,D’Lima D,Du J2012 J.Bone Miner.Res.27 848
[16]Wu Y,Hrovat M I,Ackerman J L,Reese T G,Cao H,Ecklund K,Glimcher M J2010 J.Magn.Reson.Imag.31 954
[17]Reichert IL H,Robson M D,Gatehouse PD,He T 2005 Magn.Reson.Imag.23 611
[18]Springer F,Martirosian P,Machann J,Schwenzer N F,Claussen CD,Schick F 2009 Magn.Reson.Med.61 1040
[19]McCarthy I 2006 J.Bone Joint Surg.88 4
[20]Wang Y X,Griffi th JF,Kwok A W L,Leung JC S,Yeung D K W,Ahuja A T,Leung PC 2009 Bone45 711
[21]Ma H T,Griffi th JF,Yeung D K,Leung PC 2010 Proceedings of the 18th Annual Meeting of ISMRM Stockholm,Sweden May 1—7,2010 p1968
[22]Techawiboonwong A,Song H K,Leonard M B,Wehrli FW 2008 Radiology 238 824
[23]Lu A,Daniel B L,Pauly JM,Pauly K B 2008 J.Magn.Reson.Imag.28 190
[24]Biswas R,Bae W,Diaz E,Masuda K,Chung C,Bydder G M,Du J 2012 Bone50 749
[25]Anastasiou A,Hall L D 2004 Magn.Reson.Imag.22 67
[26]Du J,Diaz E,Carl M,Bae W,Chung C,Bydder G M 2012 Magn.Reson.Med.67 645
[27]Diaz E,Chung C B,Bae W C,Statum S,Znamirowski R,Bydder G M,Du J2012 NMRin Biomed.25 161
[28]Raya JG,Dietrich O,Horng A,Weber J,Reiser M F,Glaser C 2010 Magn.Reson.Med.63 181
[29]Horch RA,Nyman JS,Gochberg DF,Dortch RD 2010Magn.Reson.Med.64 680
[30]Wehrli FW,Song H K,Saha PK,Wright A C 2006 NMRBiomed.19 731
[31]Wehrli FW,Fernandez-Seara M A 2005 Ann.Biomed.Eng.33 79
[32]Techawiboonwong A,Song H K,Wehrli F W 2008 NMRin Biomed.21 59
[33]Ramani A,Dalton C,Miller D H,Tofts PS,Barker G J 2002 Magn.Reson.Imaging 20 721
[34]Henkelman R M,Stanisz G J,Graham SJ 2001 NMRin Biomed.14 57
[35]Yu Y,Jiang Q,Miao Y,Li J,Bao SL,Wang H Y,Wu C,Wang X,Zhu J,Zhong Y,Haacke EM 2010 Radiology 257 47
[36]Wang H,Miao Y,Zhou K,Yu Y M,Bao SL,He Q,Dai Y,Xuan SY,Tarabishy B,Ye Y,Hu JN 2010 Med.Phys.37 4971
[37]Girard O,Du J,Bydder G M,Mattrey R 2011 Proceedingsof the19th Annual Meeting of ISMRM Montreal,Canada May 7—13,2011 p3210
[38]Tofts P 1997 J.Magn.Reson.Imag.7 91
[39]Wang H Z,Xu L F,Yu J,Huang Q M,Wang X Y,Lu L,Wang H,Huang Y,Cheng H Y,Zhang X L,Li G Y 2010 Acta Phys.Sin.59 7463(in Chinese)[汪红志,许凌峰,俞捷,黄清明,王晓琰,陆伦,王鹤,黄勇,程红岩,张学龙,李鲠颖2010物理学报59 7463]
[40]Bao S L 2004 Modernization Medical Physics(1st Ed.)(Beijing:Peking University Medical Press)p728(in Chinese)[包尚联2004现代医学影像物理学(第一版)(北京:北京大学医学出版社)第728页]
[41]Bao SL,Gao S 2013 Progressof Modernization Medical Physics(1st Ed.)(Beijing:Peking University Press)(in Chinese)[包尚联,高嵩2013现代医学影像物理学进展(第一版)(北京:北京大学出版社)](in press)
[42]Zhang G Q,Du X J,Zhao L,Ning FP,Yao W C,Zhu Z A 2012 Acta Phys.Sin.61 228701(in Chinese)[张国庆,杜晓纪,赵玲,宁飞鹏,姚卫超,朱自安2012物理学报61 228701]
