白僵蚕化学成分的基础研究△
2013-09-27程锁明李国玉王航宇黄健王金辉
程锁明,李国玉,王航宇,黄健,王金辉,*
(1.石河子大学药学院 新疆特种植物药资源重点实验室,新疆 石河子 832000;2.沈阳药科大学 中药学院,辽宁 沈阳 110016)
中药科技
白僵蚕化学成分的基础研究△
程锁明1,李国玉1,王航宇1,黄健2,王金辉1,2*
(1.石河子大学药学院 新疆特种植物药资源重点实验室,新疆 石河子 832000;2.沈阳药科大学 中药学院,辽宁 沈阳 110016)
目的:对白僵蚕的化学成分进行分离鉴定。方法:采用溶剂提取、萃取、反复硅胶柱色谱(ODS、制备液相色谱法)等方法进行分离纯化,根据化合物的理化性质和谱学数据鉴定其结构。结果:从白僵蚕分离得到4个化合物,分别鉴定为3β,5α-二羟基-(22E,24R)-麦角甾-7,22-二烯-6-酮(1)、(22E,24S)-5α,8α-环二氧-24-甲基-胆甾-6,9(11),22-三烯-3β-醇(2)、高精氨酸(3)、β-谷甾醇(4)。结论:化合物1~3为首次从该药材中分离得到。
白僵蚕;化学成分;结构鉴定
白僵蚕BombyxBatryticatus,异名僵蚕、天虫、僵虫、白僵虫[1],为蚕蛾科昆虫家蚕BombyxmoriL.4~5龄的幼虫感染(或人工接种)白僵菌[Beauveriabassiana(Bals.)Vuillant]而致死的干燥体,多于春、秋季生产,将感染白僵菌病死的蚕干燥。白僵蚕味咸、辛,性平;归肝、肺、胃经;具有息风止痉、祛风止痛、化痰散结功能;用于肝风夹痰、惊痫抽搐、小儿急惊、破伤风、中风口、风热头痛、目赤咽痛、风疹瘙痒、发颐痄腮[2]。白僵蚕主要分布于四川、广西、江苏、浙江、安徽、山东、甘肃等省,且以四川省质量最优[3]。
目前,关于白僵蚕药理活性的研究,国内外已有大量文献报道,但对其化学成分的研究报道还比较少,为进一步开发利用白僵蚕,作者对白僵蚕的化学成分进行了分离、纯化和鉴定,得到4个化合物,其中化合物1~3为首次从该药材中分离所得,结构式见图1。
1 材料与仪器
X-5显微熔点测试仪(北京泰克仪器有限公司);Shimadzu UV-2401紫外可见分光光度计(日本岛津公司);IRAffinity-1 FTIR红外光谱仪(Shimadzu),Varian Vnmrs 600型核磁共振光谱仪(TMS作内标,瑞士Bruker公司生产),Waters 600高效液相色谱仪;Waters 2489紫外检测器,Waters LCT Premier XE time-of-flying质谱仪(美国Waters公司)。
薄层色谱硅胶GF254和柱色谱硅胶(200~300目,青岛海洋化工厂有限公司),ODS(30~50 m,日本YMC株式会社),甲醇(色谱纯,J.T Baker生产);石油醚(沸程60~90 ℃)、甲醇、乙酸乙酯、丙酮等试剂均为市售分析纯。
白僵蚕于2010年购于沈阳药材市场,经石河子大学药学院谭勇教授鉴定为白僵蚕BombyxBatryticatus,标本号为No.20101001,标本存于石河子大学药学院。

图1 化合物1~3结构
2 提取分离
白僵蚕10 kg,用95%乙醇水溶液回流提取3次,浓缩得浸膏810 g,将浸膏混悬于水中,用乙酸乙酯萃取,得乙酸乙酯萃取物376 g。该萃取物经硅胶柱色谱,石油醚-乙酸乙酯(100∶0~0∶100)系统梯度洗脱,所得流分经TLC分析合并相同组分后,运用反复硅胶柱色谱、开放式ODS柱色谱、RP-HPLC及重结晶等方法分离得到化合物1(14.2 mg)、2(19.5 mg)、3(20.3 mg)、4(103.4 mg)。
3 结构鉴定
3.1 化合物1
1H-NMR(600 MHz,DMSO-d6)显示有2个单峰的甲基质子信号δ0.52和0.81;4个双峰的甲基质子信号δ0.77,0.79,0.88,0.98;3个含氧质子信号δ3.69;1个三元取代的烯键质子信号δ5.15;1组烯键质子信号δ5.15,5.23。13C-NMR(150 MHz,DMSO-d6)显示有28个碳信号,1个酮羰基信号δ198.7;2组双键碳信号δ119.4和131.6及δ135.1和163.3;23个sp3杂化的碳信号δ12.4,15.8,17.3,19.5,19.8,20.9,22.0,21.3,27.6,30.0,30.4,32.5,34.4,35.9,40.0,40.2,42.0,44.0,43.2,54.8,55.2,65.5,76.0,见表1。
波谱数据与文献[4-5]报道基本一致,结合IR,HR-ESI-TOF-MS数据最终确定其结构为3β,5α-二羟基-(22E,24R)-麦角甾-7,22-二烯-6-酮[3β,5α-dihydroxy-(22E,24R)-ergosta-7,22-diene-6-one]。
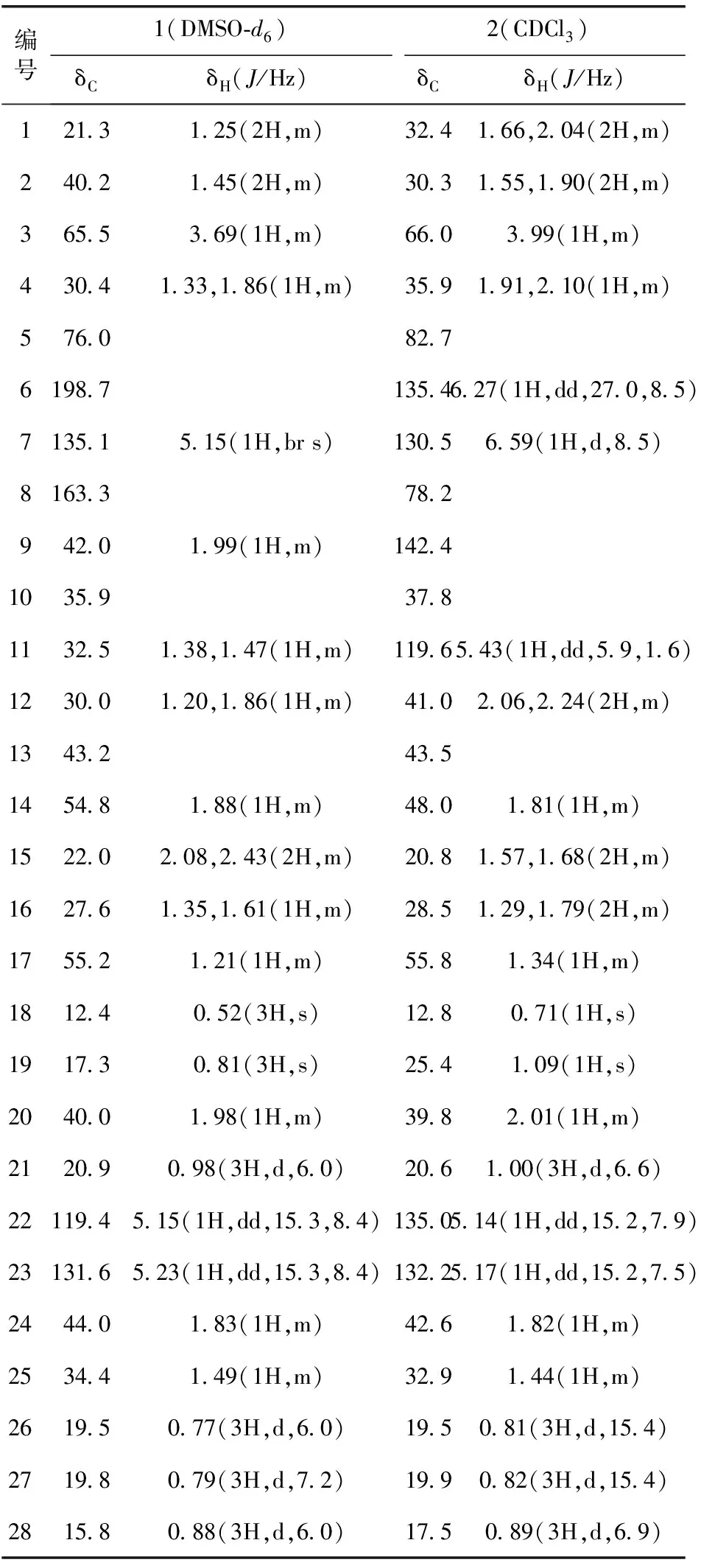
表1 化合物1和2的1H-NMR(600 MHz)和13C-NMR(150 MHz)数据
3.2 化合物2
1H-NMR(600 MHz,CDCl3)显示有2个单峰的甲基质子信号δ0.71,1.09;4个双峰的甲基质子信号δ0.81,0.82,0.89,1.00;1个含氧质子信号δ3.99;1个三元取代的烯键质子信号δ3.99;2组烯键质子信号δ5.14,5.17和δ6.27,6.59。13C-NMR(150 MHz,CDCl3)显示有29个碳信号,包括3组双键碳信号δ142.4和119.6、δ135.0和132.2、δ135.4和130.5;3个含氧碳信号δ66.0,78.2,82.7;19个sp3杂化的碳信号δ12.8,17.5,19.5,19.9,20.6,20.8,25.4,28.5,30.3,32.4,32.9,35.9,37.8,39.8,41.0,42.6,43.5,48.0,55.8,见表1。
波谱数据与文献[6-7]报道基本一致,结合IR,HR-ESI-TOF-MS数据最终确定其结构为(22E,24S)-5α,8α-环二氧-24-甲基-胆甾-6,9(11),22-三烯-3β-醇[(22E,24S)-5α,8α-epidioxy-24-methyl-cholesta-6,9(11),22-trien-3β-ol]。
3.3 化合物3
1H-NMR(600 MHz,CD3OD)显示有1个与-NH-相连的质子信号δ2.84 (2H,td,H-6);1个与-NH2相连的质子信号δ3.91(1H,dd,H-2);13C-NMR(150 MHz,CD3OD)显示有6个碳信号,其中有1个羰基碳信号δ176.9;1个与NH相连的双键碳信号δ156.6;5个sp3杂化的碳信号δ23.6,26.0,28.7,39.9,59.8。HMBC谱显示δ3.91 (1H,dd,H-2)与C-1,3,5远程相关,δ2.11(2H,dd,H-3)与C-2,4,5相关,δ1.72 (2H,H-4)与C-3,5相关,δ1.95 (2H,H-5)与C-2,3,4,6相关,δ2.84 (2H,td,H-6)与C-4,5,6′相关,具体数值见表2。
波谱数据与文献[8]报道基本一致,结合UV,IR,HR-ESI-TOF-MS数据最终确定其结构为高精氨酸(Homoarginine)。

表2 化合物3的1H-NMR(600 MHz)和13C-NMR(150 MHz)数据
3.4 化合物4
无色针状结晶(石油醚-丙酮),不溶于冷甲醇,可溶于三氯甲烷和热甲醇,mp 136~137 ℃。Liebermann-Burchard反应呈污绿色,示存在甾体母核。与已知对照品β-谷甾醇共薄层检测,在3种溶剂系统下TLC分析,二者薄层色谱行为完全一致,在紫外灯(254 nm)下观察无荧光斑点,10%硫酸乙醇溶液105 ℃加热显紫红色斑点,香草醛-浓硫酸显紫红色,鉴定其为β-谷甾醇(β-sitosterol)[9]。
4 讨论
白僵蚕为中国中医临床常用的中药材,现代药理研究发现具有抗凝、抗血栓、抗惊厥、抗癌、降糖、降脂等作用,目前多用于治疗癫痫、顽固性头痛等疾病[3],含有的化学成分比较复杂,主要有甾体、生物碱、环肽、氨基酸等,对白僵蚕化学成分的研究有助于我们发现其中的活性成分,为白僵蚕质量标准的建立和进一步开发打下基础。
致谢:感谢石河子大学谭勇教授鉴定药材; 感谢新疆大学分析测试中心、新疆理化所分析测试中心、新疆医科大学分析测试中心在测试时给予的大力帮助。
[1] 南京中医药大学. 中药大辞典[M]. 第二版.上册.上海:上海科学技术出版社,2006:1020-1022.
[2] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010:352.
[3] 黄晓雪. 僵蚕的生药学及药理活性研究[D]. 长春:吉林农业大学,2008.
[4] Ishizuka T,Yaoita Y,Kikuchi M. Streol constituents from the fruit bodies ofGrifolafrondosa(Fr.) S. F. Gray[J]. Chem Pharm Bull,1997,45(11): 1756-1760.
[5] Valisolalao J,Luu B,Ourisson G. Steroides cytotoxiques dePolyporusversicolor[J]. Tetrahedron,1983,39(17):2779-2785.
[6] Ioannou E,Abdel-Razik AF,Zervou M,et al. 5α,8α-Epidioxysterols from the gorgonianEunicellacavoliniand the ascidianTrididemnuminarmatum: Isolation and evaluation of their antiproliferative activity [J]. Steroids,2009,74(1):73-80.
[7] Gauvin A,Smadja J,Aknin M,et al. Isolation of bioactive 5α,8α-epidioxy sterols from the marine spongeLuffariellacf.variabilis[J]. Can J Chem, 2000,78(7): 986-992.
[8] Assmann M,Lichte E,Van Soest RWM,et al. New bromopyrrole alkaloid from the marine spongeAgelaswiedenmayeri[J]. Org Lett,1999,1(3): 455-457.
[9] 王珲,高慧媛,吴立军,等. 中药迷迭香化学成分的分离与鉴定[J]. 中国现代中药,2011,13(1): 23-25.
StudyonChemicalConstituentsofBombyxBatryticatus
CHENG Suo-ming1,LI Guo-yu1,WANG Hang-yu1,HUANG Jian2,WANG Jin-hui1,2*
(1.SchoolofPharmacy,ShiheziUniversity/KeyLaboratoryofPhytomedicineResources&ModernizationofTCM,ShiheziXinjiang832002,China;2.SchoolofTraditionalChineseMatericaMedica,ShenyangPharmaceuticalUniversity,ShenyangLiaoning110016,China)
Objective: To investigate the chemical constitutents ofBombyxbatryticatus.Methods: The compounds were isolated by means of solvent extraction,abstraction,chromatography on silica gel,ODS,and preparative RP-HPLC. The structures were identified by spectral analysis and physicochemical evidence.Results: Four compounds were isolated from theBombyxBatryticatusand identified as 3β,5α-dihydroxy-(22E,24R)-ergosta-7,22-diene-6-one (1),(22E,24S)-5α,8α-epidioxy-24-methylcholesta-6,9(11),22-trien-3β-ol (2),homoarginine (3),andβ-sitosterol (4).Conclusion: Compounds1~3were isolated fromB.Batryticatusfor the first time.
Bombyxbatryticatus; Chemical constituents; Structure identification
2013-03-28)
△
国家科技支撑计划(2012BAI30B02),石河子大学科学技术研究发展计划(ZRKX2009ZD05)
*
王金辉,E-mail:tcm_shz@yahoo.cn
