人AQP5真核表达质粒的构建及其在胃癌细胞中的表达
2013-09-26黄永红徐方云吕农华
黄永红,徐方云,吕农华
(1.南昌大学第一附属医院消化内科,南昌 330006;2.南昌大学基础医学院病理生理教研室,南昌 330006)
水通道蛋白5(aquaporin 5,AQP5)是跨膜水通道蛋白家族的重要成员之一,广泛分布于分泌性腺体上皮组织和细胞,在体内水平衡和腺体分泌等方面起着重要作用[1]。新近研究表明,AQP5在多种肿瘤组织细胞中呈异常表达,可能通过调节肿瘤细胞的增殖与转化[2]、影响肿瘤细胞的侵袭与迁移等参与肿瘤的发生与发展[3]。因此,AQP5正成为肿瘤研究的新领域。本研究运用分子生物学方法,构建人AQP5重组质粒并将其导入人胃癌细胞株AGS细胞中,从而获得稳定表达AQP5基因的AGS细胞系,为进一步研究AQP5基因对胃癌恶性表型的影响奠定实验基础。
1 材料与方法
1.1 材料 人胃癌细胞株AGS为本研究所保种;pcDNA 3.1/myc-His质粒为本院科研中心罗时文教授馈赠;总RNA提取液(TRIzol)、逆转录聚合酶链式反应(RT-PCR)试剂盒为北京TransGen公司产品;脂质体Lipofectmine2000试剂为美国Invitrogen公司产品;限制性核酸内切酶EcoRⅠ、BamHⅠ、T4DNA连接酶为日本TaKaRa公司产品;质粒小提试剂盒及胶回收试剂盒为Omega公司产品;兔抗人AQP5抗体为Abcam公司产品;鼠抗人β-肌动蛋白(β-actin)抗体为Santa Cruze公司产品;遗传霉素(G418)为 Merck公司产品;美国Invitrogen公司完成引物合成;北京诺赛基因公司完成基因测序。
1.2 方法
1.2.1 人AQP5真核表达质粒的构建 根据序列数据库GenBank中人AQP5的mRNA序列设计特异性引物。引物序列:上游5′-GCGAT GAA GAA GGA GGT GTG CTC CGT-3′(BamHⅠ);下游5′-CCGTCA GCG GGT GGT CAG CTC C-3′(EcoRⅠ),下划线示酶切位点(BamHⅠ、EcoRⅠ)。用PCR法扩增获得AQP5目的片段,产物长度为810bp。对扩增的AQP5基因片段和载体pcDNA3.1/myc-His分别用EcoRⅠ和BamHⅠ进行双酶切。酶切产物用1%琼脂糖凝胶电泳(110V,35min),电泳片段用凝胶回收试剂盒回收。AQP5目的片段与线性载体分别按摩尔比3∶1、6∶1和9∶1用T4DNA连接酶进行连接,4℃连接过夜。连接产物转化大肠杆菌Top10感受态细胞后,接种于含氨苄西林100μg/mL的Lu-ria-Bertani(LB)固体培养基平板,37℃筛选过夜。挑取阳性克隆摇菌提取质粒,质粒用BamHⅠ和EcoRⅠ酶切鉴定。将酶切鉴定正确的阳性质粒送北京诺赛基因公司进行测序鉴定。
1.2.2 细胞培养及质粒转染 转染前24h取对数生长期AGS细胞,调整细胞密度为1×105/mL,接种于12孔培养板,次日进行转染。随机分为对照组、空载体组和AQP5转染组。转染前弃含血清双抗培养基,磷酸缓冲盐溶液(PBS)漂洗2遍后,每孔加无血清无双抗Dulbecco改良Eagle培养基(DMEM)1mL,将质粒(μg)和Lipofectmine 2 000(μL)按1∶3的比例分别用100μL无血清培养基稀释,各自轻轻混匀静置5min后,再混合两者静置20min,将混合液均匀加至相应的细胞中,于37℃CO2孵育箱中培养5h后更换10%胎牛血清含青链双抗的DMEM培养基继续培养。
1.2.3 G418筛选浓度的确定及AGS细胞阳性克隆的筛选将AGS细胞以5×104/mL密度接种于12孔培养板中,24h后,将G418与含血清的DMEM培养基混合,配成浓度分别为0、100、200、300、400、500、600、700、800、900和 1 000mg/L 的液体,每隔3d换液一次,培养10d,以10d90%细胞致死量为最佳筛选浓度,因此确定400mg/L为最佳筛选浓度。转染24 h后按1∶10传代于24孔板,细胞贴壁后加入含400mg/L G418的完全培养基培养14d至筛选出阳性克隆;挑取阳性克隆继续扩大培养,筛选出的稳定细胞株分别命名为AGS/AQP5细胞(转染AQP5的细胞)和AGS/EV细胞(转染空载体的细胞),用200mg/L G418维持培养。
1.2.4 RT-PCR检测细胞AQP5mRNA表达 TRIzol法抽提AGS(对照组)、AGS/AQP5(AQP5 组)和 AGS/EV(空载组)细胞总RNA,按逆转录试剂盒说明进行逆转录获取cDNA,以cDNA为模板进行PCR扩增。AQP5引物序列:上游5′-CTT CCT CAA GGC CGT GTT C-3′;下游 5′-CTC CTC CCA GTC CTC GTC A-3′;内参β-actin引物序列:上游 5′-CGG GAA ATC GTG CGT GAC-3′;下游5′-TGG AAG GTG GAC AGC GAG G-3′。反应条件94℃预变性4min,94℃变性30s,58℃退火30s,72℃延伸1min,共35个循环,72℃继续延伸7min。取10μL PCR产物行1%琼脂糖凝胶电泳,凝胶成像分析进行分析,以目的条带AQP5与β-actin灰度值的比值反映AQP5mRNA相对表达水平。实验重复至少3次。1.2.5 蛋白质印迹法(Western Blot)检测细胞AQP5蛋白表达 收集对照组、AQP5组和空载组细胞,细胞裂解液提取总蛋白。BCA法进行蛋白含量测定。取总蛋白50μg/孔在10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)40V,30 min后改电压为80V,120min后至溴酚蓝跑至胶最下方取胶,将分离的蛋白转移至聚偏氟乙烯(PVDF)膜,25V90min进行转膜。转膜后5%脱脂奶粉含0.1%叶吐温20Tris缓冲溶液(TBST)4℃封闭60min;加入一抗孵育(AQP5 1∶500,β-actin 1∶500)4℃过夜,TBST洗膜3次,10min/次,加入辣根过氧化物酶(HRP)标记二抗(1∶5 000)孵育,4℃5h,洗膜,曝光、显影、定影。Gel-pro凝胶成像分析软件分析AQP5蛋白和β-actin蛋白的灰度值,并计算其比值反映AQP5蛋白相对表达水平。实验重复至少3次。
1.3 统计学处理 采用SPSS 17.0统计软件分析,数据以表示,多个样本均数比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 克隆的双酶切及序列测定 重组质粒双酶切后琼脂糖电泳约在810bp和5 480bp附近分别见一明显条带,与目的片段大小相符,见图1,北京诺赛基因公司测序结果与GenBank中人AQP5(NM_001651.2)的核苷酸序列完全一致。
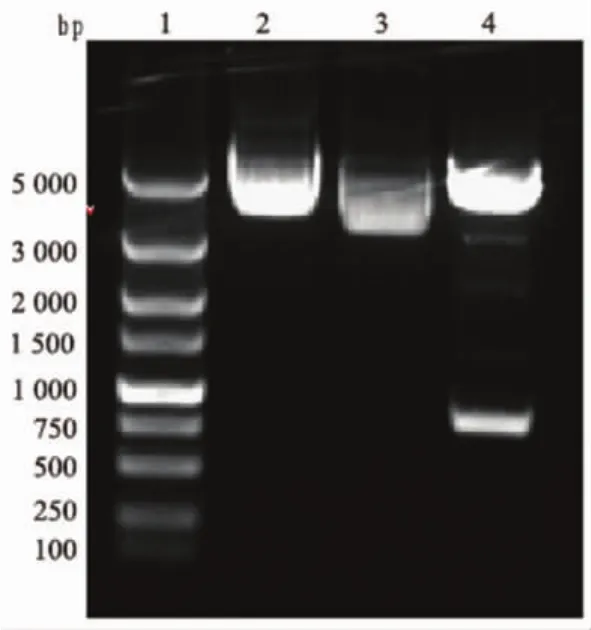
图1 酶切鉴定电泳图
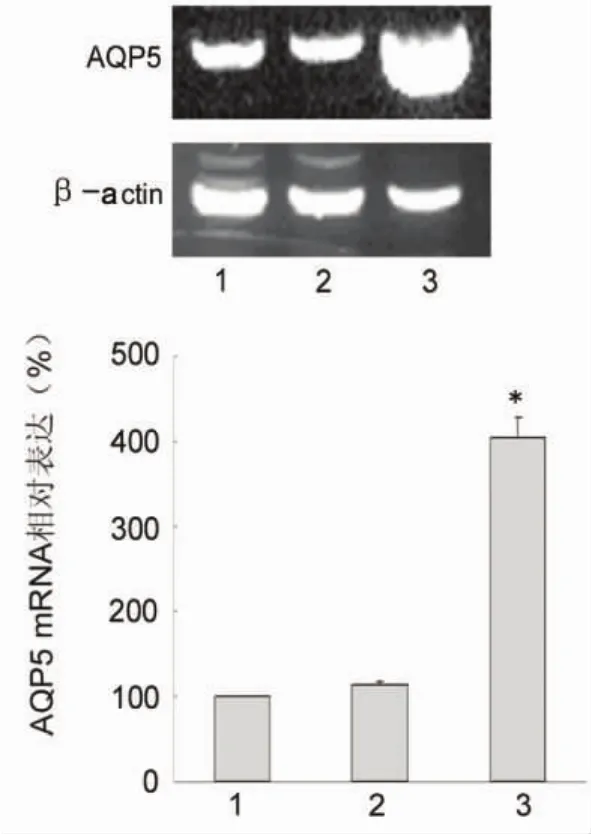
图2 RT-PCR检测各组AGS细胞AQP5mRNA的表达
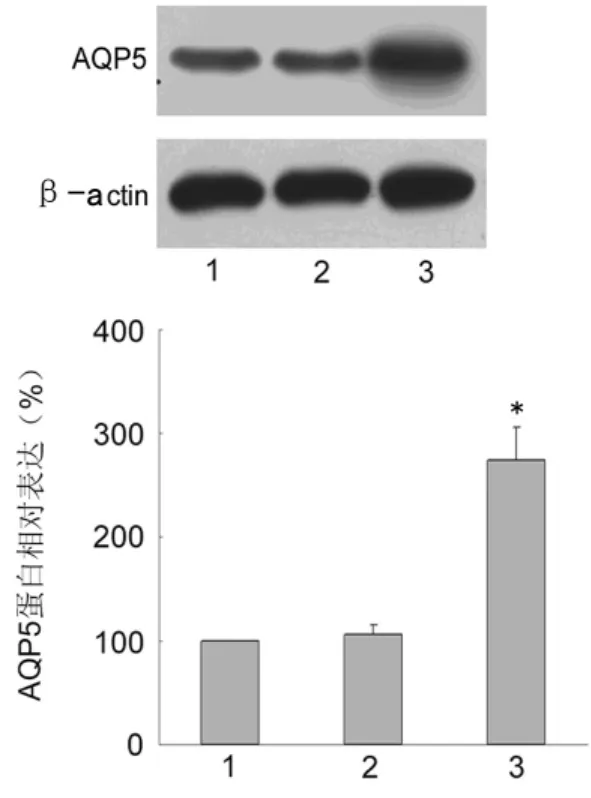
图3 Western Blot检测各组AGS细胞AQP5蛋白的表达
2.2 AQP5mRNA的表达 外源AQP5转染AGS细胞后,AQP5mRNA表达水平显著上调,AQP5组与对照组、空载组比较,AQP5mRNA水平显著上调,差异有统计学意义(P<0.05),而对照组与空载组比较mRNA表达差异无统计学意义(P=0.355),见图2。
2.3 AQP5蛋白的表达 外源AQP5转染AGS细胞后,AQP5蛋白表达水平显著上调,AQP5组与对照组、空载组比较,AQP5蛋白水平显著上调,差异有统计学意义(P<0.05),而对照组与空载组比较蛋白表达差异无统计学意义(P=0.181),见图3。
3 讨 论
水的微环境是细胞内外一切生命活动进行的场所,肿瘤的发生、发展也离不开水的微环境。而且,肿瘤细胞为了满足快速增殖、分裂及向周围基质侵袭和转移的需要,一系列酶的活性和表达发生改变,细胞基本结构成分合成明显加强;同时癌细胞向周围基质侵袭和进出血管/淋巴管时需要体积和外形发生相应改变[4]。因此,肿瘤细胞比正常细胞更需要水分子的快速跨膜转运。
近年文献报道AQP5蛋白过度表达于多种肿瘤组织中[5-8],并与某些肿瘤的进展、化疗药物的耐受及患者的预后相关。体外实验表明,AQP5参与肿瘤生物学行为的形成。Chae等[9]发现过表达AQP5的K562细胞和LAMA84细胞增殖能力增强。Chen等[10]采用RNA干扰(RNAi)技术沉默 AQP5基因表达可明显减少人肺癌细胞株SPC-A1细胞的迁移和侵袭能力,且认为其迁移和侵袭能力下降与沉默AQP5基因,降低细胞水的通透性,调节细胞大小和形态有关。Jung等[11]在乳腺癌研究中亦发现乳腺癌细胞MCF7AQP5表达与肿瘤细胞的增殖和转移能力相关。Chae等[7]的研究表明,外源性表达AQP5的正常肺上皮细胞株BEAS-2B可发生上皮间质转化(epithelial mesenchymal transition,EMT),细胞呈成纤维样改变,失去细胞-细胞间连接和细胞极性,而且细胞上皮标志蛋白表达下调、间质标志蛋白表达则上调,提示AQP5可通过EMT促进肿瘤细胞的侵袭和转移。此外,动物实验表明AQP5过表达可诱导荷瘤动物肿瘤发生转移[12]。目前病理组织学研究发现[13-14],正常胃黏膜组织中AQP5呈低表达,而胃癌组织中AQP5呈高表达,提示AQP5可能参与胃癌的发生与发展。但是,AQP5基因在胃癌发生发展中究竟发挥何种作用,有待深入研究。
总之,本研究通过Western Blot和RT-PCR实验证实已成功筛选出稳定表达外源性人AQP5基因的AGS胃癌细胞株,这为进一步研究AQP5基因在胃癌发生发展中可能扮演的角色奠定实验基础。
[1]张景熙,李强,刘忠令.AQP5的结构功能及其调节[J].国外医学:生理、病理科学与临床分册,2003,23(6):599-601.
[2]Woo J,Lee J,Chae YK,et al.Overexpression of AQP5,a putative oncogene,promotes cell growth and transformation[J].Cancer Letters,2008,264(1):54-62.
[3]Chen ZH,Wang XD,Bai CX,et al.Regulation of MUC5AC mucin secretion by depletion of AQP5in SPC-A1cells[J].Biochem Biophys Res Commun,2006,342(3):775-781.
[4]Verkman AS,Hara-Chikuma M,Papadopoulos MC.Aquaporins-new players in cancer biology[J].J Mol Med,2008,86(5):523-529.
[5]Burghardt B,Elkjær ML,Kwon TH,et al.Distribution of aquaporin water channels AQP1[J].Gut,2003,52(7):1008-1016.
[6]Kang SK,Chae YK,Woo J,et al.Role of human aquaporin 5in colorectal carcinogenesis[J].Am J Pathol,2008,173(2):518-525.
[7]Chae YK,Kang SK,Kim MS,et al.Expression of aquaporin 5(AQP5)promotes tumor invasion in human non small cell lung cancer[J].PLoS ONE,2008,3(5):e2162.
[8]Zhang Z,Chen Z,Song Y,et al.Expression of aquaporin 5 increases proliferation and metastasis potential of lung cancer[J].J Pathol,2010,221(2):210-220.
[9]Chae YK,Kang SK,Kim MS,et al.Human AQP5plays a role in the progression of chronic myelogenous leukemia(CML)[J].PLoS ONE,2008,3(7):e2594.
[10]Chen Z,Zhang Z,Gu Y,et al.Impaired migration and cell volume regulation in aquaporin 5-deficient SPC-A1cells[J].Respir Physiol Neurobiol,2011,176(3):110-117.
[11]Jung HJ,Park JY,Jeon HS,et al.Aquaporin-5:a marker protein for proliferation and migration of human breast cancer cells[J].PLoS ONE,2011,6(12):e28492.
[12]Zhang ZQ,Zhu ZX,Bai CX.Lung fluorescence imaging to evaluate tumor metastasis induced by AQP5expression in murine model[J].Med Oncol,2012,29(1):205-211.
[13]Watanabe T,Fujii T,Oya T,et al.Involvement of aquaporin-5in differentiation of human gastric cancer cells[J].J Physiol Sci,2009,59(2):113-122.
[14]Shen L,Zhu Z,Huang Y,et al.Expression profile of multiple aquaporins in human gastric carcinoma and its clinical significance[J].Biomed Pharmacother,2010,64(5):313-318.
