酯类皂化反应动力学溶剂效应的研究*
——介绍一个开放式、研究性实验
2013-09-25陈小娟陈六平余小岚李瑞英
陈小娟 陈六平 余小岚 李瑞英
(中山大学化学与化学工程学院 广东广州 510275)
在液相化学反应体系中,除了直接参加化学反应的反应物外,还存在着大量溶剂和一些不直接参加反应的中性盐或其他杂质。这些溶剂或中性盐虽未直接参加反应,但也会影响反应的热力学和动力学性能,有时还可以大大改变反应速率甚至反应机理[1]。动力学介质效应是指一些不直接参加反应的溶剂或盐对反应动力学的影响。介质不仅担负提供“反应场所”的具体任务,而且在某种意义上,对反应比催化剂有着更大的影响。溶剂效应的数量级在102~103范围内是很常见的,在某些极端情况下其数量级可达109[2]。由此可见,不同介质对反应速率的影响差别很大。溶剂的性能对反应速率和反应机理的影响是多种多样的,其中包括:反应物、活化络合物和生成物的不同程度的溶剂化效应;溶剂的介电常数变化所引起的静电效应;溶剂的极性效应;溶剂的酸度效应;溶剂的黏度所引起的笼效应;溶剂的电离效应和溶剂解效应等[1]。
对反应的介质效应进行实验和理论研究,探讨不同溶剂对指定反应平衡态和动力学性质的影响,预测可能的反应机理,提出溶剂选择的一般规律和指导性原则,不仅是化学科学研究的重要内容和任务[3],而且对实际工业生产具有指导作用。
在基础物理化学实验中,“测量乙酸乙酯皂化反应的速率常数和活化能”是国内外高校化学类专业都必开设的一个经典实验[4-6]。金家骏等研究了乙酸乙酯皂化反应的动力学溶剂效应和动力学盐效应[7-9]。如何将这类基础性实验延伸为具有研究性特点的开放性实验,让学生在实验课之余自由完成,是我们一线实验教师需要认真探索的问题。本文介绍我们已开设的一个开放性实验——“酯类皂化反应动力学溶剂效应的研究”。
1 实验目的
学生通过查阅文献,了解介质(溶剂)对化学反应速率的影响规律;选择1~2种酯类化合物,考察温度、溶剂种类及其组成对酯类物质皂化反应速率的影响;学会从理论上、分子间相互作用水平上分析并理解化学反应动力学溶剂效应的本质规律;以科技论文格式撰写综合性研究报告并参加“开放式、研究性”实验交流(答辩)会。
2 实验原理
相关文献研究结果表明,酯类的皂化反应是二级反应,其反应方程式可表示为:

设在t时刻生成物的浓度为Ct,则该反应的速率方程为:
dCt/dt=k(C0(R1COOR2)-Ct)(C0(NaOH)-Ct)
(1)
式中,C0(R1COOR2)、C0(NaOH)分别为R1COOR2和NaOH的起始浓度,k为反应速率常数或速率系数。k的大小与反应物种的浓度无关,但它包含浓度以外的所有其他因素(内因,即反应物本性,如反应物的分子大小、形状、结构,反应体系中分子间的相互作用力情况等;外因,即温度、压力、反应介质的性质、催化剂、外场等)对反应速率的影响。
若C0(R1COOR2)=C0(NaOH),则式(1)可写为:
dCt/dt=k(C0(R1COOR2)-Ct)2
(2)
对上式积分,得:
kt=Ct/(C0(R1COOR2)(C0(R1COOR2)-Ct))
(3)
本实验采用电导法测定皂化反应进程中反应体系的电导值随时间的变化来反映不同时刻反应物的浓度,因此体系电导的减少值与R1COONa的浓度Ct的增大成正比,设G0为溶液的起始电导,Gt为t时刻溶液的电导,G∞为t→∞时溶液的电导,则有:
t=t时,Ct=α(G0-Gt)
(4)
t→∞时,C0(R1COOR2)=α(G0-G∞)
(5)
式中,α为比例常数,将式(4)、式(5)代入式(3),得:
kt=(G0-Gt)/(C0(R1COOR2)(Gt-G∞))
(6)
或:
Gt=(1/kC0(R1COOR2))·(G0-Gt)/t+G∞
(7)
以Gt对(G0-Gt)×1000/t作图,求得斜率m=1/kC0(R1COOR2),于是有:
k=1/mC0(R1COOR2)
(8)
3 实验部分
本文选择两种典型的酯类物质——乙酸甲酯和乙酸丁酯,对其在水与有机溶剂组成的混合溶剂中进行碱性水解反应的动力学性能进行了研究。
3.1 实验仪器及试剂
电导率仪1台;电导电极1支;恒温槽1套;动力学数据实时采集软硬件系统1套;250mL反应器1个,小玻璃泡若干个,移液管数支。
乙酸甲酯,乙酸丁酯,NaOH,无水甲醇,无水乙醇,正丙醇,DMSO(二甲亚砜)。以上试剂中,除乙酸甲酯为化学纯外,其他均为分析纯。
3.2 实验步骤
1) 将恒温槽水浴温度调节至一定温度,温度波动为±0.1℃;用50mL移液管转移150mL蒸馏水于干燥的250mL反应器中,放入恒温槽内恒温。
2) 用注射器把约0.2mL纯酯注入已称量的小玻璃泡内,在煤气灯上封口,再次称量,求得酯的质量。
3) 向反应器中加入与酯等物质的量的标准NaOH溶液(0.4809mol·L-1),充分混合;同时将准备好的小玻璃泡放入特制的不锈钢管中,其中插入一根玻璃棒,此管再放入反应器中;将电导电极插入反应器,使电极片完全浸入溶液中;恒温20min后,点击数据采集软件中的“测G0”,测定溶液的起始电导,停30s后,再次测定电导直至读数恒定,以此作为体系初始电导值G0。
4) 用力压碎玻璃泡,立即点击“开始测量”,计算机采集系统即开始“跟踪”反应;彻底压碎玻璃泡,同时摇动反应器,使酯和NaOH混合均匀、充分反应,测量45min后停止计时。
5) 混合溶剂的配比如下:
① 醇类混合溶剂(与乙酸甲酯):120mL蒸馏水+30mL甲醇、乙醇或正丙醇。
② 不同浓度的甲醇溶剂(与乙酸甲酯):按总体积150mL计,甲醇体积占20%、40%、60%、80%,将其与蒸馏水混合。
③ 不同温度、不同浓度的DMSO溶剂(与乙酸丁酯):按总体积150mL计,DMSO体积占20%、40%、60%、80%,将其与蒸馏水混合。
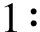
3.3 实验结果
按照上述实验步骤,分别测定乙酸甲酯、乙酸丁酯在不同混合溶剂中进行皂化反应的速率常数k。根据测得的实验数据,以Gt对(G0-Gt)/t作图,求得斜率m=1/kC0(R1COOR2),计算出k;每一种溶剂组成下测定3次,k取其平均值,实验结果示于表1~表5。
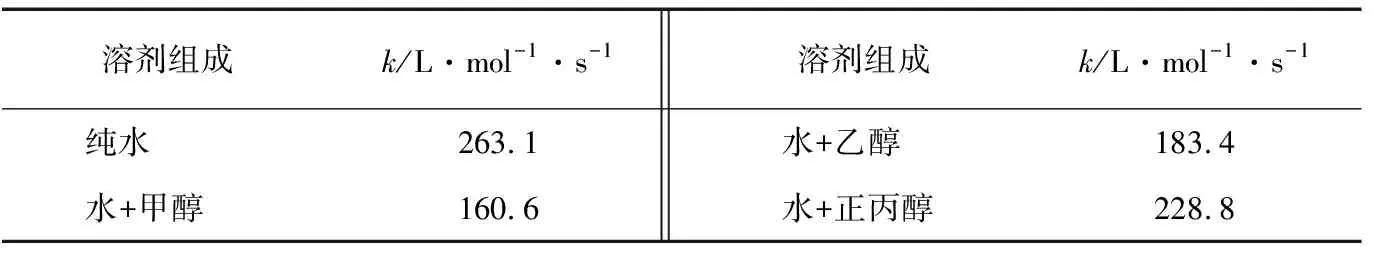
表1 30℃下混合溶剂(水+醇)中乙酸甲酯皂化反应的速率常数

表2 30℃下混合溶剂(水+甲醇)中乙酸甲酯皂化反应的速率常数

表3 25℃下混合溶剂(H2O+DMSO)中乙酸丁酯皂化反应的速率常数

表4 35℃下混合溶剂(H2O+DMSO)中乙酸丁酯皂化反应的速率常数

表5 35℃下混合溶剂(H2O+DMSO+C2H5OH)中乙酸丁酯皂化反应的速率常数
4 结果与讨论
4.1 醇类溶剂对乙酸甲酯皂化反应速率常数的影响
由表1可知,与纯水中的反应速率常数相比,加入醇将导致反应速率常数k减小,而且醇的相对分子质量越小,影响就越大,即:
k水>k水+正丙醇>k水+乙醇>k水+甲醇
对以上规律分析如下:加入水中的各溶剂的介电常数ε的关系为:ε(正丙醇)<ε(乙醇)<ε(甲醇)。随着ε的增加,反应速率常数k减小,且ε越大,k减小的程度越大。由此可知,醇类对乙酸甲酯的水解反应存在着负的动力学溶剂效应。定标粒子理论[1]认为, 溶质分子进入溶剂的过程可分为两步进行:第一步是在溶剂中造出一个具有确定半径的空腔,这个过程所需的可逆功通常称为造腔自由焓;第二步是把溶质分子硬球放进空腔,令其与周围的溶剂分子相互作用,这个过程所需的可逆功通常称为相互作用自由焓。液相体系中物质的偏摩尔自由焓可表示为造腔偏摩尔自由焓以及由体系中各种粒子之间的色散、取向、诱导、静电作用及其他相互作用如氢键等组成的相互作用偏摩尔自由焓之和。根据化学动力学过渡态理论,当反应物R1与R2发生化学反应,生成活化络合物X≠后转变为生成物P1和P2时,介质对反应速率的影响可归结为反应物和过渡态偏摩尔自由焓的改变。由于加入不同于水的另一种溶剂后,体系中各反应溶质粒子与醇分子之间的相互作用不等同于其与水分子之间的相互作用,导致体系中各组分的自由焓发生改变,致使反应的活化自由焓也发生改变。所以,随着加入溶剂的介电常数的增大,其溶剂效应也就增强;反应的活化自由焓改变越大,酯皂化反应的反应速率常数也就改变越大。
4.2 甲醇对乙酸甲酯皂化反应速率常数的影响
甲醇对乙酸甲酯的皂化起延缓作用,甲醇的浓度越大,皂化速率降低得就越多。随着甲醇的加入,体系中各组分与甲醇分子发生相互作用,其作用不同于其与水分子之间的相互作用,从而引起反应体系中各组分分子之间相互作用的改变。显然,甲醇的浓度越大,这种改变就越大,亦即速率常数的改变量越大。其变化规律示于图1。
4.3 DMSO对乙酸丁酯皂化反应速率常数的影响
与甲醇相比,DMSO属于质子惰性型溶剂,对乙酸丁酯的皂化起促进作用。DMSO的浓度越大,皂化速率升高得就越多。随着DMSO的加入,体系中各组分与DMSO分子发生相互作用,这种作用不同于其与水分子之间的相互作用,从而可引起体系中组分分子间相互作用的改变。显然,DMSO的浓度越大,这种改变就越大,亦即速率常数的改变量越大。其变化规律示于图2。此外,温度越高,DMSO浓度的变化对乙酸丁酯皂化反应速率的影响越大,这可能是由于温度升高,导致粒子之间碰撞的概率增大,相互作用增强,因而增大了对乙酸丁酯皂化反应速率的促进作用。
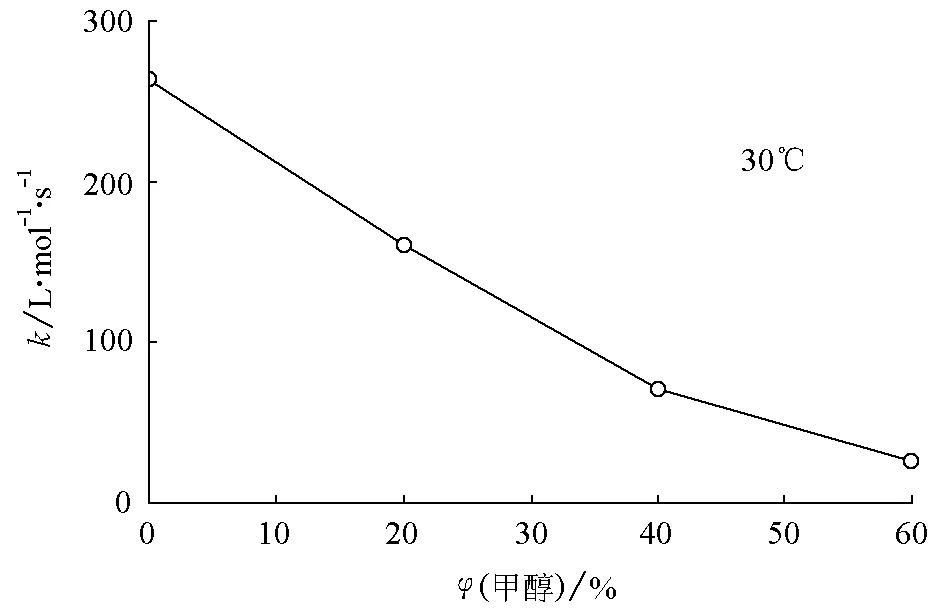
图1 乙酸甲酯皂化反应的速率常数随甲醇量的变化(30℃)
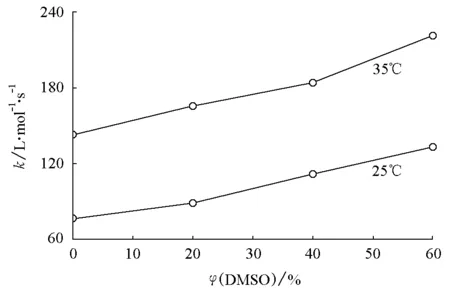
图2 乙酸丁酯皂化反应的速率常数随DMSO量的变化
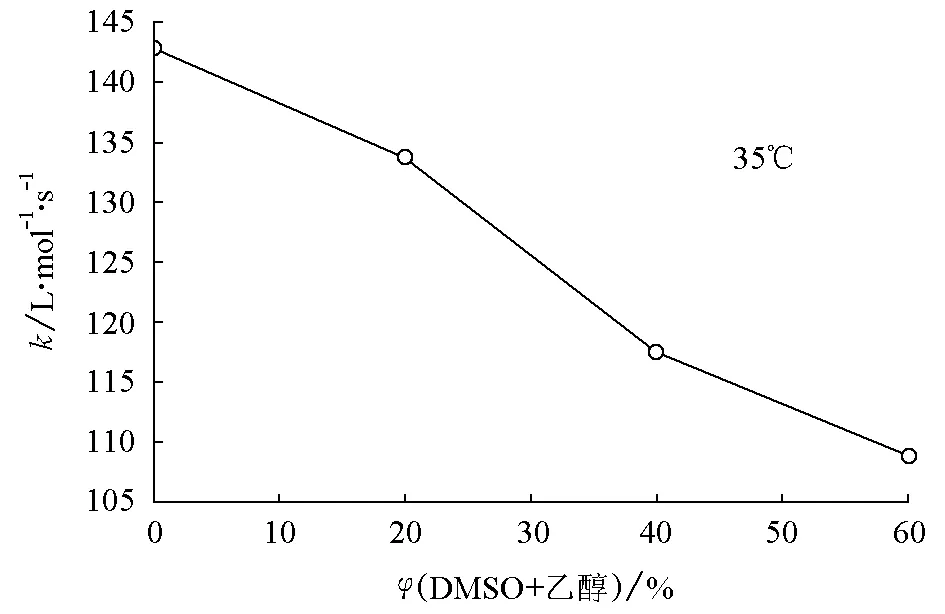
图3 乙酸丁酯皂化反应的速率常数随DMSO+乙醇混合溶剂浓度的变化(35℃)
4.4 DMSO+乙醇混合溶剂对乙酸丁酯皂化反应速率常数的影响
大量研究表明,混合溶剂的活度、酸度、溶解度、电离度等多种重要性能的变化,会引起反应速率常数的变化。就本实验而言,可得出以下结论:
① 羟基极性溶剂(醇)的加入导致乙酸甲酯皂化反应的速率常数减小,且溶剂极性越大,速率常数减小越大。对于甲醇溶剂,其浓度越大,皂化反应的速率常数减小越大。
② DMSO的加入导致乙酸丁酯皂化反应的速率常数增大,且DMSO的浓度越大,速率常数增加越大;温度越高,DMSO的浓度增加对反应速率常数的增加影响越大。
5 教学效果
本实验是从基础物理化学实验发展而来的一个研究性实验,实验测量并不复杂,但对实验结果的分析却需要用到溶液反应动力学方面的专门知识。学生需在学习溶液的定标粒子理论等的基础上,才能真正理解溶剂对酯类物质皂化反应速率的影响规律。这一要求促使学生带着问题去学习新知识、新理论,去多问“为什么”。我院在现代化学实验与技术课程中开出此实验,吸引了很多学生参加,教学效果良好。该实验所需费用不多,一般物理化学实验室都具备开设条件,所以具有普适性。
参 考 文 献
[1] 金家骏.液相化学反应动力学原理.上海:上海科学技术出版社,1984
[2] Cram D J,Rickborn B,Kingsbury C A,etal.JAmChemSoc,1961,83:3678
[3] Reichardt C.Solvent Effects in Organic Chemistry.New York:Verlag Chemie Weinsheim,1979
[4] 陈六平,邹世春.现代化学实验与技术.北京:科学出版社,2007
[5] 复旦大学.物理化学实验.第3版.庄继华修订.北京:高等教育出版社,2004
[6] 雷群芳.中级化学实验.北京:科学出版社,2005
[7] 金家骏,陈民生,张楚柏.高等学校化学学报,1983,4(5):600
[8] 金家骏.化学通报,1981(11):20
[9] 金家骏.化学通报,1974(4):28
