正常成人脑结构年龄相关性变化的扩散峰度成像研究
2013-09-24郑慧鑫王效春秦江波张锁旺吴晓峰
郑慧鑫,张 辉,王效春,谭 艳,秦江波,张锁旺,张 磊,王 乐,吴晓峰
人类的大脑在发育和老化过程中,其结构和形态发生变化,在青春期和成年初期白质体积在增大,而后续随老化而减小[1]。年龄相关性DTI指标的变化已经被广泛报道[2],符合上述组织微观结构的改变[3]。扩散峰值成像(DKI)是DTI的一个延伸,目的是描述非高斯方面水的扩散[4]。本研究的目的是了解DKI在健康成人大脑随年龄增长的变化规律,包括白质区域和深部核团,呈现健康成人大脑DKI参考值,可对今后疾病诊断和研究提供对照。
1 资料与方法
1.1 一般资料 对山西医科大学第一医院60名健康志愿者进行颅脑常规磁共振检查和DKI检查,男性28名,女性32名,年龄20岁~77岁,平均48.4岁。所有志愿者行MR检查无中枢神经系统疾患和其他影响中枢神经系统的全身性疾患。按年龄分为3组:20岁~39岁为青年组(20例);40岁~59岁为中年组(20例);60岁及以上为老年组(20例)。
1.2 检查方法 使用GE3.0T超导型磁共振成像仪,采用八通道头颈联合拓扑相控阵线圈进行磁共振扫描。先进行常规扫描,包括T1WI-FLAIR轴位和矢状位、T2WI轴位以及T2WI-FLAIR轴位扫描,排除颅脑器质性病变,然后进行DKI序列扫描。DKI序列采用平面回波(EPI)序列。
1.3 数据处理 在 GE Advantage Workstation 4.4工作站通过Functool处理软件进行后处理,得到平均峰度(MK)、部分各向异性(FA)、平均扩散(MD),图像分别于半卵圆中心、内囊前肢、内囊后肢,胼胝体膝部、胼胝体压部、丘脑、豆状核、尾状核头、额叶、顶叶、颞叶设置椭圆形感兴趣区(ROI),除胼胝体膝部、压部外,均采用镜面对称方式放置两侧。分别侧定每个ROI的MK值、FA值、MD值,每个ROI重复测量3次,取平均值。
1.4 统计学处理 应用SPSS15.0软件处理,计量资料以均数±标准差(±s)表示,采用单因素方差分析、Pearson相关分析。
2 结 果
2.1 不同部位DKI参数值与年龄的相关性(见表1) 除豆状核外,其他部位的 MK值、FA值均与年龄呈负相关(P<0.05)。豆状核的MK值、FA值均与年龄呈正相关(P<0.05)。半卵圆中心、内囊后肢,胼胝体膝部、胼胝体压部、额叶、颞叶、丘脑、豆状核、尾状核头的 MD值与年龄呈正相关(P<0.05);内囊前肢、顶叶的MD值与年龄的相关性无统计学意义,但有随年龄增长而增加的趋势。
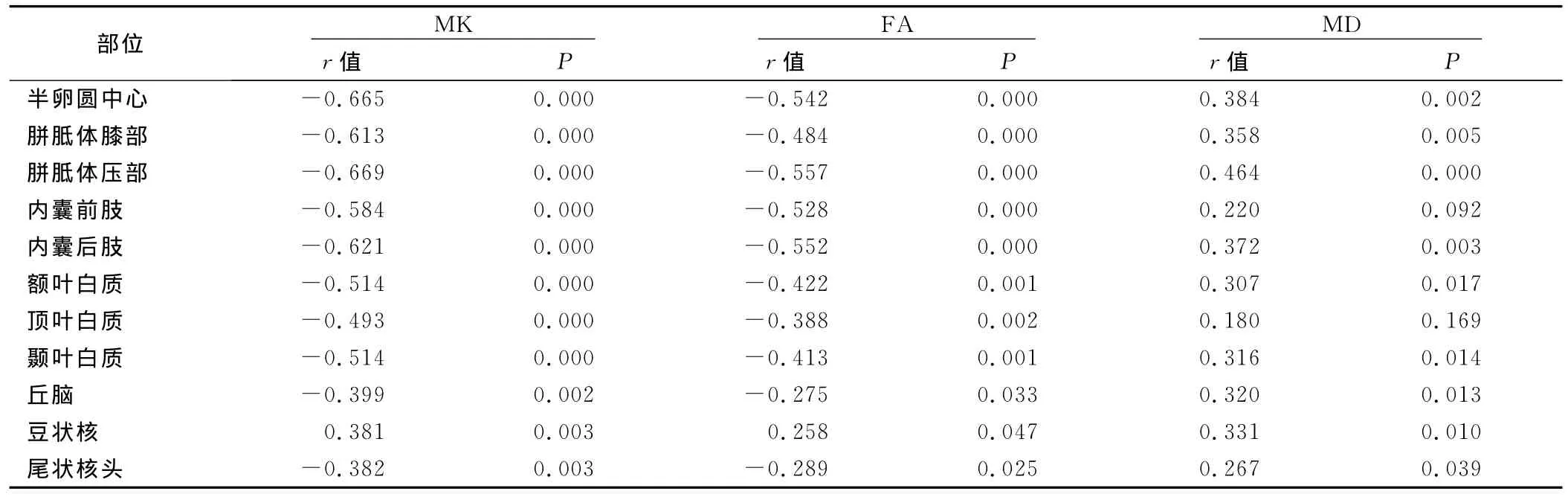
表1 60名正常成年人脑不同部位DKI参数值与年龄的相关性比较
2.2 不同部位各组间DKI参数值比较
2.2.1 平均峰度值组间比较 (见表2) 半卵圆中心、内囊后肢、胼胝体膝部、胼胝体压部、额叶、颞叶、豆状核、尾状核头的MK值各组间有统计学意义(P<0.05),青年组>中年组>老年组。内囊前肢、顶叶、丘脑的MK值在青年组与老年组、中年组与老年组比较有统计学意义(P<0.05)。豆状核的MK值在各组间差异有统计学意义(P<0.05),但趋势与其他部位相反,即为老年组>中年组>青年组。
表2 60名正常成人脑不同部位各年龄组间MK值比较(±s)
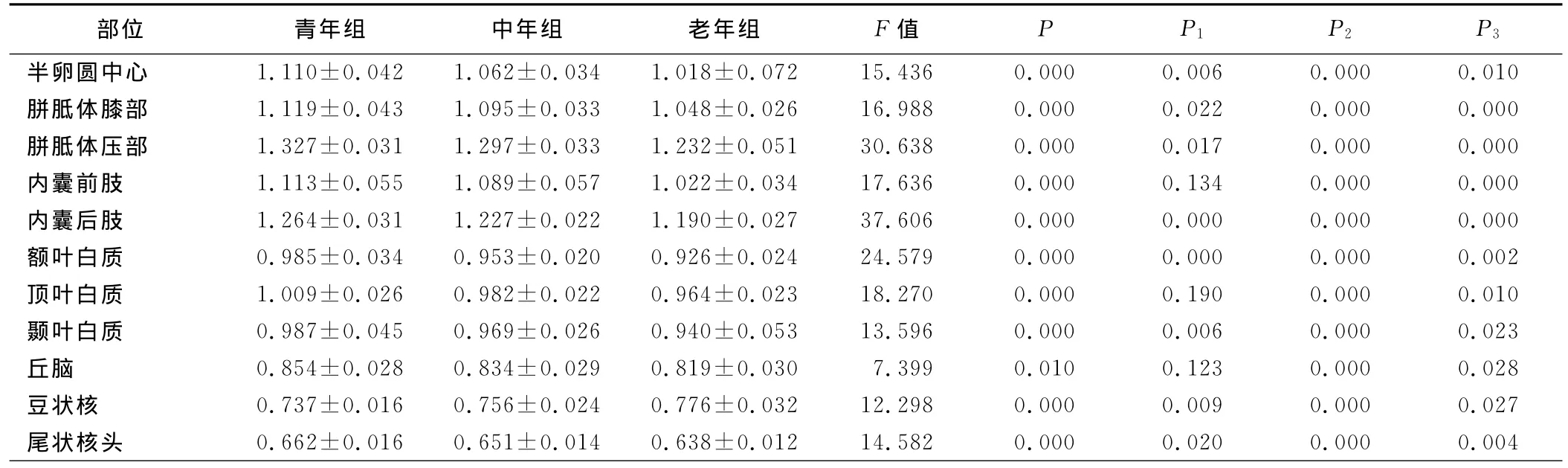
表2 60名正常成人脑不同部位各年龄组间MK值比较(±s)
注:P值为3组间比较结果;P1为青年组与中年组比较结果;P2为青年组与老年组比较结果;P3为中年组与老年组比较结果。
部位 青年组 中年组 老年组 F值 P P1 P2 P3半卵圆中心 1.110±0.042 1.062±0.034 1.018±0.072 15.436 0.000 0.006 0.000 0.010胼胝体膝部 1.119±0.043 1.095±0.033 1.048±0.026 16.988 0.000 0.022 0.000 0.000胼胝体压部 1.327±0.031 1.297±0.033 1.232±0.051 30.638 0.000 0.017 0.000 0.000内囊前肢 1.113±0.055 1.089±0.057 1.022±0.034 17.636 0.000 0.134 0.000 0.000内囊后肢 1.264±0.031 1.227±0.022 1.190±0.027 37.606 0.000 0.000 0.000 0.000额叶白质 0.985±0.034 0.953±0.020 0.926±0.024 24.579 0.000 0.000 0.000 0.002顶叶白质 1.009±0.026 0.982±0.022 0.964±0.023 18.270 0.000 0.190 0.000 0.010颞叶白质 0.987±0.045 0.969±0.026 0.940±0.053 13.596 0.000 0.006 0.000 0.023丘脑 0.854±0.028 0.834±0.029 0.819±0.030 7.399 0.010 0.123 0.000 0.028豆状核 0.737±0.016 0.756±0.024 0.776±0.032 12.298 0.000 0.009 0.000 0.027尾状核头 0.662±0.016 0.651±0.014 0.638±0.012 14.582 0.000 0.020 0.000 0.004
2.2.2 部分各向异性值的组间比较 (见表3) 半卵圆中心、胼胝体膝部、内囊前肢、内囊后肢、额叶白质FA值青年组与中年组有统计学意义(P<0.05),青年组>中年组。各部位青年组与老年组有统计学意义(P<0.05),除豆状核外,均为青年组>老年组;豆状核为青年组<老年组。胼胝体膝部、胼胝体压部、内囊后肢、顶叶、颞叶、丘脑、尾状核头FA值中年组与老年组间有统计学意义(P<0.05),中年组>老年组。
表3 60名正常成人脑不同部位各年龄组间FA值比较(±s)
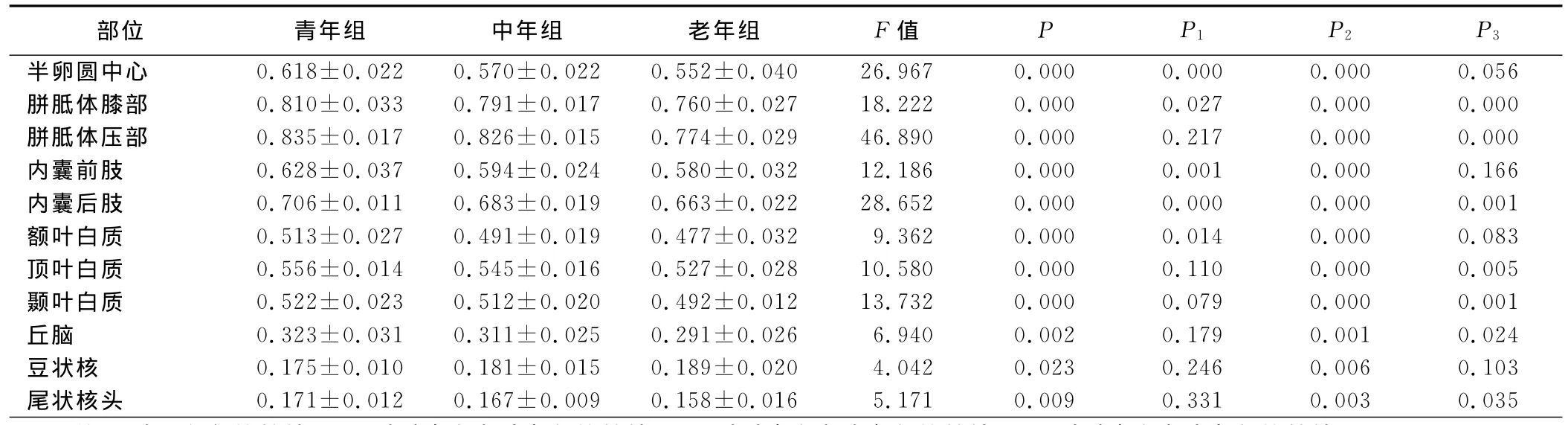
表3 60名正常成人脑不同部位各年龄组间FA值比较(±s)
注:P为3组间比较结果;P1为青年组与中年组比较结果;P2为青年组与老年组比较结果;P3为中年组与老年组比较结果。
部位 青年组 中年组 老年组 F值 P P1 P2 P3半卵圆中心 0.618±0.022 0.570±0.022 0.552±0.040 26.967 0.000 0.000 0.000 0.056胼胝体膝部 0.810±0.033 0.791±0.017 0.760±0.027 18.222 0.000 0.027 0.000 0.000胼胝体压部 0.835±0.017 0.826±0.015 0.774±0.029 46.890 0.000 0.217 0.000 0.000内囊前肢 0.628±0.037 0.594±0.024 0.580±0.032 12.186 0.000 0.001 0.000 0.166内囊后肢 0.706±0.011 0.683±0.019 0.663±0.022 28.652 0.000 0.000 0.000 0.001额叶白质 0.513±0.027 0.491±0.019 0.477±0.032 9.362 0.000 0.014 0.000 0.083顶叶白质 0.556±0.014 0.545±0.016 0.527±0.028 10.580 0.000 0.110 0.000 0.005颞叶白质 0.522±0.023 0.512±0.020 0.492±0.012 13.732 0.000 0.079 0.000 0.001丘脑 0.323±0.031 0.311±0.025 0.291±0.026 6.940 0.002 0.179 0.001 0.024豆状核 0.175±0.010 0.181±0.015 0.189±0.020 4.042 0.023 0.246 0.006 0.103尾状核头 0.171±0.012 0.167±0.009 0.158±0.016 5.171 0.009 0.331 0.003 0.035
2.2.3 平均扩散值的组间比较 (见表4) 半卵圆中心、胼胝体压部、内囊后肢、豆状核的MD值青年组与老年组、中年组与老年组,内囊前肢、顶叶MD值中年组与老年组,胼胝体膝部、额叶、颞叶、丘脑、尾状核头MD值青年组与老年组,胼胝体膝部MD值青年组与中年组有统计学意义(P<0.05),老年组>中年组、老年组>青年组、中年组>青年组。胼胝体膝部MD值中年组与老年组间有统计学意义(P<0.05),为中年组>老年组。
表4 60例正常成人脑不同部位各年龄组间的MD值比较(±s)
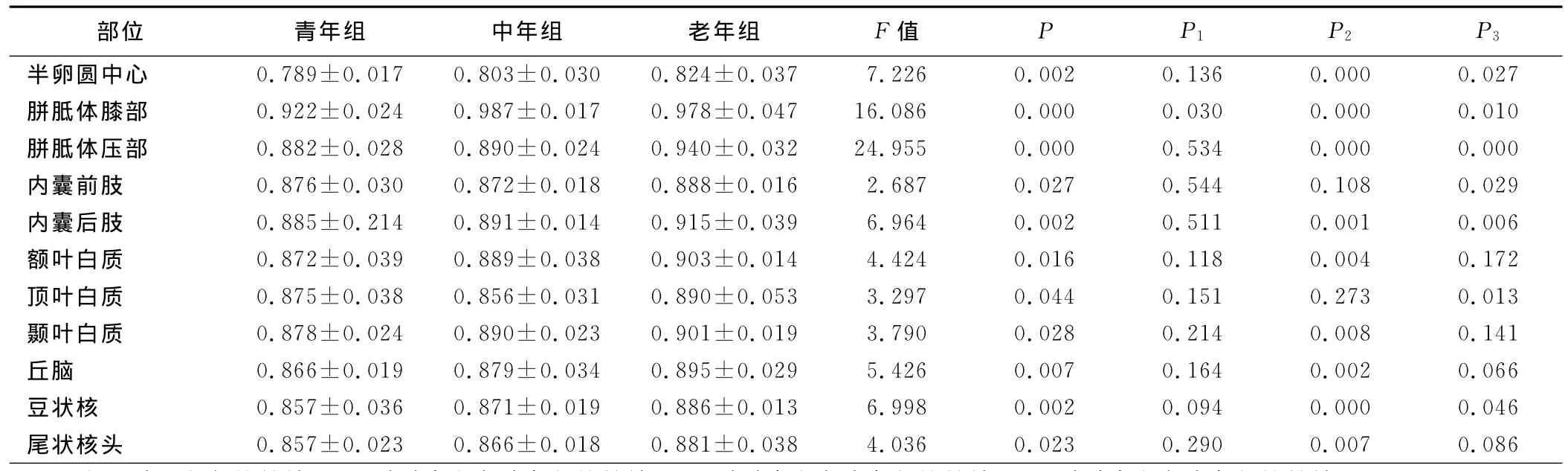
表4 60例正常成人脑不同部位各年龄组间的MD值比较(±s)
注:P为3组间比较结果;P1为青年组与中年组比较结果;P2为青年组与老年组比较结果;P3为中年组与老年组比较结果
部位 青年组 中年组 老年组 F值 P P1 P2 P3半卵圆中心 0.789±0.017 0.803±0.030 0.824±0.037 7.226 0.002 0.136 0.000 0.027胼胝体膝部 0.922±0.024 0.987±0.017 0.978±0.047 16.086 0.000 0.030 0.000 0.010胼胝体压部 0.882±0.028 0.890±0.024 0.940±0.032 24.955 0.000 0.534 0.000 0.000内囊前肢 0.876±0.030 0.872±0.018 0.888±0.016 2.687 0.027 0.544 0.108 0.029内囊后肢 0.885±0.214 0.891±0.014 0.915±0.039 6.964 0.002 0.511 0.001 0.006额叶白质 0.872±0.039 0.889±0.038 0.903±0.014 4.424 0.016 0.118 0.004 0.172顶叶白质 0.875±0.038 0.856±0.031 0.890±0.053 3.297 0.044 0.151 0.273 0.013颞叶白质 0.878±0.024 0.890±0.023 0.901±0.019 3.790 0.028 0.214 0.008 0.141丘脑 0.866±0.019 0.879±0.034 0.895±0.029 5.426 0.007 0.164 0.002 0.066豆状核 0.857±0.036 0.871±0.019 0.886±0.013 6.998 0.002 0.094 0.000 0.046尾状核头 0.857±0.023 0.866±0.018 0.881±0.038 4.036 0.023 0.290 0.007 0.086
3 讨 论
关于脑白质老化的研究报道是在DTI基础上测量的,包括在33岁以前成年人的FA值呈非线性增加,随后呈非线性降低,形如标准的抛物线。MD在白质显示了相反的模式,38岁以前呈非线性减少,之后类似的非线性增加,即一个倒抛物线[5]。在一些灰质,FA被证明能够遵循一个倒抛物线,最低约33岁[5]。FA 的这种减少已经证明在尾状核[6]和壳[7]。而关于FA及MD的研究是在水分子扩散的高斯领域,无法解决多神经纤维交叉问题。
DKI作为扩散成像的新技术,其技术的产生历经一个对组织内水分子扩散呈非正态分布的认识、四阶张量应用于磁共振成像的转变过程。可以量化真实水分子扩散与理想的高斯分布扩散的位移偏离大小,表征水分子扩散受限程度和扩散的不均质性,其MK是一个反映扩散受限程度的无量纲参数,更加敏感探测组织微观结构的改变,因此可能是疾病早期的标记,例如在帕金森病[8]、中风[9]、肿瘤[10]、多发硬化[11]、神经退行性疾病等领域已有初步研究。而且目前国外关于正常人DKI研究表明,MK值与年龄呈负相关,MK值随年龄增长明显下降。其可能与组织微观结构的复杂性如组织密度、方向、细胞膜完整程度、髓鞘层等改变有关。
目前对于DKI在健康成人大脑与年龄关系的研究报道较少,且研究结果不一。有文献报道[12,13],关于年龄和MK相关性在直方图的分析;从青年人到老年人所有白质和灰质的峰值减少。Nilssom等[14]对健康成人大脑的正常老化过程定量测定研究发现,随年龄增长,胼胝体膝部、半卵圆中心、额叶白质、丘脑等MK值明显下降,MK值与年龄呈线性回归,FA值及MD值与年龄无相关性。而有关于DTI研究报道,对健康成人大脑关于青年组、中年组与老年组间的FA值研究发现,内囊后肢、胼胝体膝部等FA值各组间有统计学意义(P<0.05),FA值与年龄呈负相关。本组研究表明,除豆状核外,其他部位的MK值与年龄呈负相关,这与Nilssom研究结果基本相符,而FA值与年龄呈负相关(除豆状核外),MD值与年龄呈正相关(除内囊前肢和顶叶外),这与Nilssom研究结果不相符,分析可能的原因为不同研究者选择兴趣区的方法不同和所选研究范围的不同。
本研究结果表明,在内囊前肢、顶叶的MK值青年组与老年组、中年组与老年组间有统计学意义(P<0.05),而青年组与中年组间无统计学意义,但青年组的平均MK值还是大于中年组,说明随年龄增长,MK仍有下降的趋势,可能由青年到中年下降的幅度较小,因而无统计学意义。是否增加样本数能使比较结果差异具有统计学意义,尚待进一步研究。
另外,本研究结果表明在胼胝体压部、半卵圆中心、额叶、颞叶、尾状核头MK值青年组、中年组、老年组间差异均有统计学意义,而在胼胝体压部、颞叶、尾状核头的青年组与中年组,半卵圆中心、额叶的中年组与老年组的FA值及胼胝体压部、半卵圆中心、额叶、颞叶的青年组与中年组,额叶、颞叶、尾状核头的中年组与老年组的MD值组间差异无统计学意义,说明MK值比FA值、MD值更敏感,是水扩散研究从高斯水进入非高斯水领域,解决了DTI无法解决的多神经纤维交叉问题,更加能够真实反应脑组织微观结构的变化。例如DKI在胶质瘤研究中[15],胶质瘤Ⅱ级与Ⅲ级的MK值有统计学意义,而FA值与MD值均无统计学意义。本组豆状核的MK、FA、MD与年龄呈正相关。豆状核的MK、FA与其他部位相反,即随年龄增长而增加,可能与其特定的解剖特点有关。豆状核包含壳和苍白球2部分,壳主要由致密排列的小神经元构成,其间有散在大的多极神经元,苍白球包含一些白色的有髓纤维束,因而豆状核是一种灰质与白质的复合体,其中灰质和白质水分子的扩散不同,而且较多血管在此走行,因而其变化非常复杂,也可能导致测量存在偏差。其确切机制有待进一步研究。
用DKI研究不同年龄段健康人脑MK值的差异及与年龄的相关性,能够更好地反映出脑组织灰质与白质微观结构的改变[16],为健康人脑内的 MK与某些神经功能障碍性疾病中脑MK的鉴别及临床诊断提供了重要依据。
[1] Lebel C,Walker L,Leemans A,et al.Microstructural maturation of the human brain from childhood to adulthood[J].Neuroimage,2008,40(3):1044-1055.
[2] Sullivan EV,Pfefferbaum A.Neuroradiological characterization of normal adult ageing[J].Br J Cardiol,2007,80:S99-S108.
[3] Lebel C,Gee M,Camicioli R,et al.Diffusion tensor imaging of white matter tract evolution over the lifespan[J].Neuroimage,2011,60(1):340-352.
[4] Jensen J,Helpern JA.MRI quantification of non-Gaussian water diffusion by kurtosis analysis[J].NMR Biomed,2010,23(7):698-710.
[5] Hasan KM,Sankar A,Halphen C,et al.Development and organization of the human brain tissue compartments across the lifespan using diffusion tensor imaging[J].Neuroreport,2007,18(16):1735-1739.
[6] Hasan KM,Halphen C,Boska MD,et al.Diffusion tensor metrics,T2relaxation,and volumetry of the naturally aging human caudate nuclei in healthy young and middle-aged adults:Possible implications for the neurobiology of human brain aging and disease[J].Magn Reson Med,2008,59(1):7-13.
[7] Camara E,Bodammer N,Rodriguez-Fornells A,et al.Age-related water diffusion changes in human brain:A voxelbased approach[J].Neuroimage,2007,34(1):1588-1599.
[8] Giannelli M,Toschi N,Passamonti L,et al.Diffusion kurtosis and diffusion-tensor MR imaging in Parkinson disease[J].Radiology,2012,265(2):645-646.
[9] Hui ES,Fieremans E,Jensen JH,et al.Stroke assessment with diffusional kurtosis imaging[J].Stroke,2012,43(11):2968-2973.
[10] Van Cauter S,Veraart J,Sijbers J,et al.Gliomas:Diffusion kurto-sis MR imaging in grading[J].Radiology,2012,263(2):492-501.
[11] Yoshida M,Hori M,Yokoyama K,et al.Diffusional kurtosis imaging of normal-appearing white matter in multiple sclerosis:Preliminary clinical experience[J].Jpn J Radiol,2013,31(1):50-55.
[12] Falangola MF,Jensen JH,Babb JS,et al.Age-related non-Gaussian diffusion patterns in the prefrontal brain[J].J Magn Reson Imaging,2008,28(6):1345-1350.
[13] Lu H,Jensen JH,Hu C,et al.Alterations in cerebral microstructual integrity in normal aging and in Alzheimer’s disease:A multicontrast diffusion MRI study[J].Proc Intl Soc Mag Reson Med,2006,14:723.
[14] Nilsson M,Wirestam R,Stahlberg F,et al.Regional values of diffusional kurtosis estimates in the healthy brain[J].J Magn Reson Imaging,2013,37(3):610-618.
[15] Raab P,Hattingen E,Franz K,et al.Cerebral Gliomas:Diffusional kurtosis imaging analysis of microstructural differences[J].Radiology,2010,254(3):876-881.
[16] Cheung MM,Hui ES,Chan KC,et al.Does diffusion kurtosis imaging lead to better neural tissue characterization a rodent brain maturation study[J].Neuroimage,2009,45(2):386-392.
