猪冷冻精液应激温度优化的试验
2013-09-23张雪峰张守亮宋永利尹柏双付连军
张雪峰,张守亮,张 良,李 智,宋永利,尹柏双,付连军
(吉林农业科技学院动物医学学院,吉林 吉林132101)
中国猪冷冻精液研究始于20世纪70年代,在随后的20多年里,猪冷冻精液取得很大的进步,技术也愈加成熟。但是由于多种因素影响,在中国对地方猪种资源进行活体保种困难较大,这就要求寻求更加有效的保种方式,精液冷冻保存技术为此提供了有效途径。现有的精液冷冻保护技术只有部分精子能够经受住冷冻,通过升温恢复原有部分活性。在冷冻过程中,溶液生成冰晶对精子产生的机械性损伤及由于渗透压改变引起的溶液性损伤是削弱精子冻后生理活性的重要原因[1-4],故对冷冻过程中冰晶生成机理等进行深入地研究也是精液冷冻领域内研究的一个重要内容。Polge等[5]发现了甘油在冷冻过程中的保护作用,使精液冷冻获得了成功,提出了微晶学说。当精液温度从体温降低到接近于冰点或从低温恢复到体温的过程,对精子具有非常严重的影响,精子活率会受到温度的反复变化造成不可逆的下降[6]。
冷冻过程中精子细胞不但要对保存温度(-196℃)有耐受能力,而且要能经受从射精时的集体温度到保存时超低温的变化而活力不会过度降低。因此,温度的控制就成了精液冷冻取得成功的关键因素之一,在冷冻时要求精液温度持续下降,不允许回升,不允许出现诸如二次结冰之类的温度回升现象,并在精液冷冻过程中,冷冻温度要求快速通过有害温区(0℃~60℃)。因此,本试验研究了应激温度对猪冷冻精液保存的影响研究。
1 材料与方法
1.1 试验材料及主要仪器 葡萄糖、乳糖、柠檬酸钠、甘氨酸、卵黄实验室提供;RBL-PA-Ⅱ型胚胎程序冷冻仪,北京若比邻电子信息技术有限责任公司生产。
1.2 方法
1.2.1 样品采集 精液采集于吉林农业科技学院种猪场,选择成年、体质健康、性欲旺盛、采精频率正常的种公猪,收集精液中段富含精子部分,经4层灭菌纱布过滤,在37℃左右保温瓶中运回实验室,在生物显微镜下进行精液品质常规检查,选择活率0.7以上,密度“中”级以上的精液用于试验。
1.2.2 精液的前处理 将采集的精液保存在保温瓶中(32℃~37℃)静置60min,为了防止长时间静置使精子进入假死状态,在静置0.5h后需轻轻晃动贮精保温瓶,使精子恢复活力,然后离心,弃掉绝大部分精清,保留约占离心后浓缩段精液量二分之一的精清。
1.2.3 稀释液的配制 用电子天平准确称量各种试剂,用注射器吸取一定体积的卵黄,按比例用双蒸水溶解,摇匀,盛入编号试剂瓶中,配制成稀释液基础液,过滤后高压灭菌,待冷却至室温放入5℃冰箱中备用。采精前,取出基础液按比例加入卵黄配制成稀释Ⅰ液(葡萄糖:22.0g/L;乳糖:30.0g/L;柠檬酸钠:3.0g/L;甘氨酸:8.0g/L;卵黄:300mL/L)。置于37℃隔水电热恒温培养箱中预热。向Ⅰ液加3%甘油即为Ⅱ液。
1.2.4 精液的稀释与平衡 采用二次稀释法进行稀释。先将Ⅰ液按1∶1比例缓慢倒入离心后的精液中进行等温稀释(32℃~35℃),用16层纱布包裹离心管,连同Ⅱ液一起放入5℃冰箱中平衡2h再加入占第一次稀释后精液总量二分之一的Ⅱ液,继续平衡2h,保持精液最终稀释比例为1∶2。
1.2.5 精子活力检测 只有直线前进的精子才是正常的运动形式,直线运动的精子数占总精子数的百分率称为精子活力。精子活力检查常采用目测法,用恒温载物台将精子加热到35℃~37℃,在100~400倍显微镜下观察精子的运动状态,每个样本观察3个以上的视野。精子活力常用10级制,即0.1~1.0,一般低于0.4级的精子不宜用于输精,许多种公猪站以精子活力为0.7~0.8作为筛选标准[7-9]。观察3种方案冷冻前后精子活力。将待检精子稀释为1×107个/mL,取5μL稀释精子滴于载玻片上,加盖玻片后在相差显微镜下观察、计数,至少计数200个精子,精子活力=直线运动的精子数/计数精子总数。
1.2.6 精液冷冻 向经过稀释与平衡的精液中加入与精液同温的冷冻保护剂(甘油),设置浓度为3% ,将Ⅱ液和精液平衡2h后,用程序冷冻仪冻存,放入液氮本试验使用3种方案冷冻精液(见表1~3),然后制作细管型冻精(为0.5mL)。
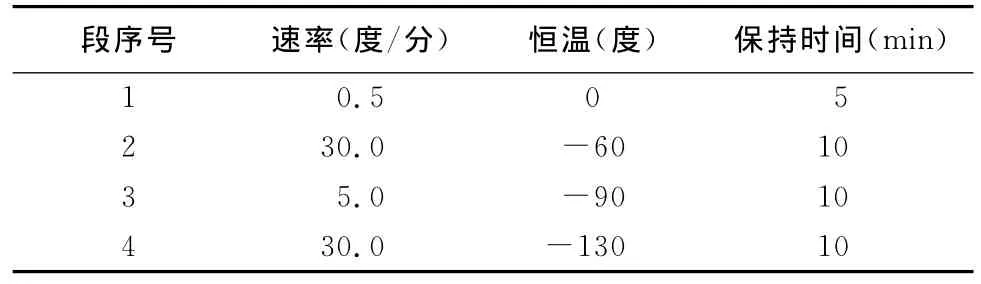
表1 冷冻方案1的降温程序
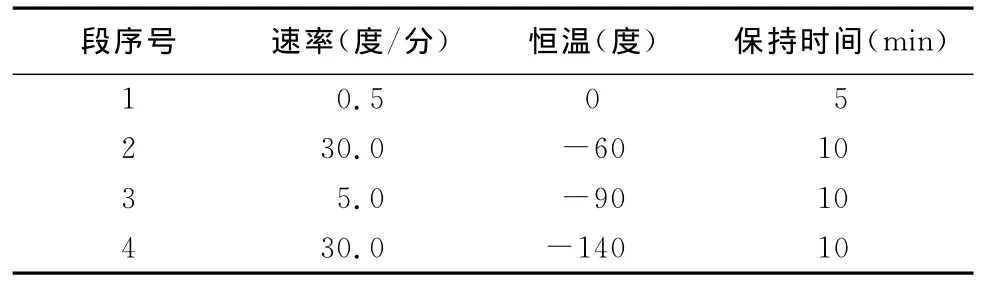
表2 冷冻方案2的降温程序
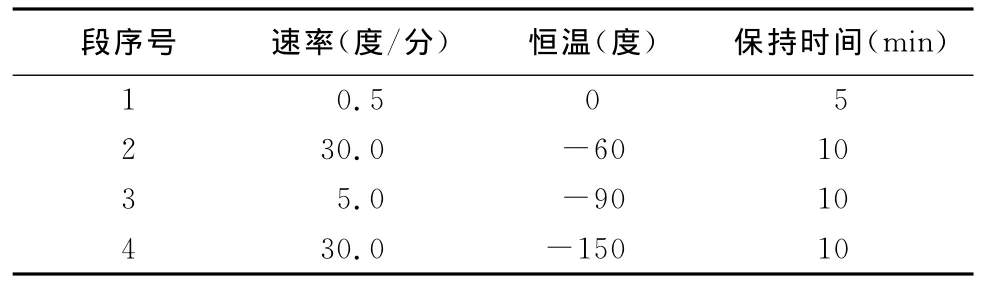
表3 冷冻方案3的降温程序
2 结果
2.1 鲜精活力检测 经过精子活力测定结果表明,鲜精精子活力为0.70±0.02,说明采集的鲜精精子存活率较高,可以做人工授精。
2.2 加入保护剂后精子活力检测 加入保护剂平衡2h后,检测精子活力为0.41±0.02,与鲜精相比,精子活力下降很大,加入保护剂甘油后,对精子的毒性较大,本试验只加了3%甘油,但效果仍然不理想,保护剂的含量及保护剂的成分还需进一步研究,另外,精子的冷冻程序还需要进一步研究来优化精子的冷冻效果,探讨更适合精子冷冻的方法。
2.3 解冻后3种方案精子活力检测 3种方案冷冻精子后,在37℃、30s的条件解冻后精子活力为0.16±0.02、0.17±0.04、0.34±0.03,第3种方案相对较好,还有待于今后进一步来研究,来探讨最佳的精子冷冻、解冻方案。使精子冷冻效果更佳。
3 讨论
迄今为止,国际上己经召开了5次关于猪精液冷冻保存的大型国际会议,研究者们在保存方法、精液冷冻处理程序等方面作了大量的工作,并对猪精液冷冻保存的发展起到了积极的推动作用。但是由于繁殖成绩不理想,猪冷冻精液仍没有得到大范围推广。以目前水平来看,猪冷冻精液的产仔率40%~70%,窝产仔数为7~10头,分别比常规液态保存精液低20%~30%,少2~3头。
到目前为止,由于冷冻精液人工授精后母猪受胎率较低,大多数地区采用猪冷冻精液进行人工授精的数量急剧下降。因此,必须解决猪冷冻精液的方法。
精子射出时经副性腺分泌的精浆稀释,同时获得运动能力。保存时稀释精液能减弱精子运动、抑制代谢、延长体外存活时间、扩大精液体积并提高精液利用率。因此,稀释液对冷冻效果也有影响。较低程度的稀释促进精子运动,可能是冲淡了精浆中一些抑制代谢的物质。而过度稀释导致精子丧失运动能力、代谢活性和受精能力,即稀释效应[10]。高度稀释的猪精子添加10%精浆后,存活率和顶体完整率均提高[11]。精浆中有维持精子运动和存活所必需的离子等,还有维持精子膜稳定和受精能力的蛋白质、抗氧化物质以及其他有益成分,过度稀释使这些成分浓度过低,无法保护精子。过度稀释带来大量电解质,造成精子表面电荷过多,产生头对头凝集等有害反应。猪精浆中可能存在去获能因子,在体外保存中可抑制精子获能,而稀释会使其浓度下降,使精子过早获能,从而加速死亡[10]。精浆中也存在一些损害精子功能的物质,降低浓度或除去更利于精子保存,如精浆中的芳基磺胺酶能从对质膜有稳定作用的硫酸盐复合糖上脱去硫酸盐,并促进精子获能[12],多种因素影响精子冷冻效果,本试验只是研究了应激温度对猪精液冷冻的影响。
目前猪精液冷冻主要参照牛的精液冷冻,没能针对猪精子特性提出一套适合猪精液的冷冻稀释液、冷冻程序和方法。针对猪精子特性,建立一套有效的适合猪精液的冷冻方法是目前研究者们急需解决的方法。
[1] Wtson P.The ceauses of redueed fertility with eryoPreservedsemen[J].Anim ReProd sci,2005,60-61:481-492.
[2] Van Wagtendonk-de Leeuw A W,Haring R M,Kaal-Lansbergen LMTE,etal.Fertility results using bovine semen eryoPreserved with extenders based on egg yolk and soy bean extraet[J].Thenogenology,2004,54(1):57-67.
[3] Songsasen N,Betteridge K,LeiboS.Birth of live mice resulting from oocytes fertilized in vitro with cryopreserved spermatozoa[J].Biol Reprod,2007,56(1):143-152.
[4] Willoughby C E,Mazur P,Peter A T,etal.Osmotic tolerance limits and ProPerties of murine spermatozoa[J].Biol Re-Prod,1996,55(3):715-727.
[5] Smith A U,Polge C.Survival of spermatozoa at low temperatures[J].Nature,1950,166(4225):668-669.
[6] 马美湖.猪精液冷冻保存研究进展[J].中国畜牧杂志,1995,23,33-36.
[7] 杨霞.猪精液冷冻技术的研究进展[J].饲料博览,2009,10:13-16.
[8] 陈龙,朱化彬,沙里金.猪精液冷冻保存影响因素研究进展及展望[J].中国生物工程杂志,2008,28(6):113-117.
[9] 禚艳书,王坚,刘铁铮.猪精液冷冻保存研究进展[J].江苏农业科学,2006,3:136-139.
[10]Maxwell W M C,Johnson L A.Physiology of spermatozoa at high dilution rates:the influence of seminal Plasma[J].Theriogenology,1999,52(8):1353-1362.
[11]Maxwell W M,Weleh G R,Johnson L A.Viability and membrane integrity of spermatozoa after dilution and flow cytometric sorting in the Presence or absenee of seminal plasma[J].ReProd Fertil Dev,2006,8(8):1165-1178.
[12]Gadella B M,Colenbrander B,Vangolde L M G,etal.Characterization of 3Arylsulfatases in Semen-Seminolid Sulfohydrolase Activity is Present in Seminal Plasma[J].Biochimica Et Biophysica Acta,2007,1128(2-3):155-162.
