刺五加皂苷的提取工艺
2013-09-22赵萍,田晶,费旭,徐龙权,李景,喻毅
赵 萍, 田 晶, 费 旭, 徐 龙 权, 李 景, 喻 毅
(1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.大连工业大学 现代教育技术部, 辽宁 大连 116034)
0 引 言
刺五加为五加科植物,刺五加的根、茎、叶皆可作药用。目前对刺五加根及根茎的研究报道较多,而对更具开发价值的刺五加叶的研究较少[1]。近年研究表明,刺五加叶中含有丰富的皂苷类、黄酮类化合物等多种活性物质,其皂苷类成分主要是以齐墩果酸为配基的三萜皂苷[2]。皂苷除用作药物外,还可以作为高级化妆品和食品添加剂。因此,开展对刺五加皂苷的提取工艺的研究具有十分重要的意义[3]。
目前报道的刺五加皂苷提取方法主要有回流浸提法[4]、超声法[5]、微波法[6]等。超声法和微波法具有快速、高效等特点,但目前较难应用于工业化生产。有机溶剂回流浸提法易于操作、适合大规模工业化生产,但其工艺条件还有待进一步优化,尤其是纯化步骤更需要改进。本论文以刺五加叶为原料,针对刺五加皂苷提取工艺存在的问题,将有机溶剂回流浸提与大孔吸附树脂法相结合,改进了提取工艺,优化了纯化方法,为刺五加皂苷的规模化生产提供参考依据。
1 材料与方法
1.1 试 剂
刺五加叶,河北中药之家药材店;齐墩果酸标准品,上海晶纯实业有限公司,纯度>98%;AB-8大孔吸附树脂,天津南开合成科技有限公司;乙醇、石油醚、正丁醇、香草醛、甲醇、浓硫酸等试剂均为分析纯。
1.2 主要仪器
Lambda-35紫外-可见分光光度计,美国PE公司;RE-52旋转蒸发器,上海亚荣生化仪器厂;TGL-16高速冷冻离心机,上海安亭科学仪器厂;FD-1A-50真空冷冻干燥机,北京比朗实验设备有限公司。
1.3 方 法
1.3.1 刺五加皂苷的提取纯化方法
取一定量粉碎后的刺五加叶,用不同体积分数的乙醇回流浸提一定时间,然后,依次进行减压抽滤、石油醚脱色素、正丁醇萃取、浓缩,浓缩后的提取液减压蒸馏除去正丁醇溶液。提取物进一步采用AB-8大孔树脂柱层析法对提取到的刺五加皂苷进行纯化。先用一定量的去离子水洗脱多糖等杂质,弃去洗脱液,再用不同浓度的乙醇洗脱刺五加皂苷,洗脱液经减压浓缩,真空冷冻干燥,即得刺五加皂苷[7]。
η=m1/m0×100%
式中:η为刺五加皂苷的得率,%;m1为提取所得的刺五加皂苷质量,g;m0为刺五加原料的质量,g。
1.3.2 刺五加皂苷质量分数的测定
采用紫外-可见分光光度法[2]分析检测刺五加皂苷质量分数。
1.3.2.1 标准溶液的配制
精密称取齐墩果酸标准品0.010 g,用甲醇溶解并定容至10.0 mL, 即得质量浓度为1 mg/mL的齐墩果酸标准溶液。
1.3.2.2 测定波长的选择
精密吸取质量浓度为2 mg/mL的样品溶液110 μL置于10.0 mL具塞试管中,水浴挥去溶剂。加入新配置的8%香草醛-乙醇溶液0.5 mL,72%硫酸5 mL摇匀闭塞后,置于60 ℃恒温水浴10 min,立即取出试管,放入冰水中冷却15 min,取出摇匀,用紫外-可见分光光度计于400~600 nm 波长测定吸收曲线,同时以甲醇溶液代替样品溶液作空白对照,确定最大吸收波长[8]。
1.3.2.3 标准曲线的绘制
分别精密吸取标准溶液30、50、70、90、100 μL,分别置于具塞试管中,其余步骤同“1.3.2.2”,然后在最大吸收波长处测定吸光度,同时甲醇溶液作空白对照。以齐墩果酸浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
1.3.2.4 皂苷质量分数的计算
w=m2/m1×100%
式中:w为刺五加皂苷皂苷质量分数,%;m2为提取物中刺五加皂苷的质量,g;m1为刺五加皂苷提取物的质量,g。
2 结果与讨论
2.1 最大吸收波长的确定
由于刺五加皂苷的测定波长在520~550 nm不等,因此对刺五加叶皂苷的测定波长进行优化,在400~600 nm波长范围进行紫外-可见光谱扫描,结果如图1所示。图1中表明标准品和刺五加样品与香兰素-浓硫酸反应生成的产物均在537 nm处有最大吸光度,因此确定537 nm为最大吸收波长。
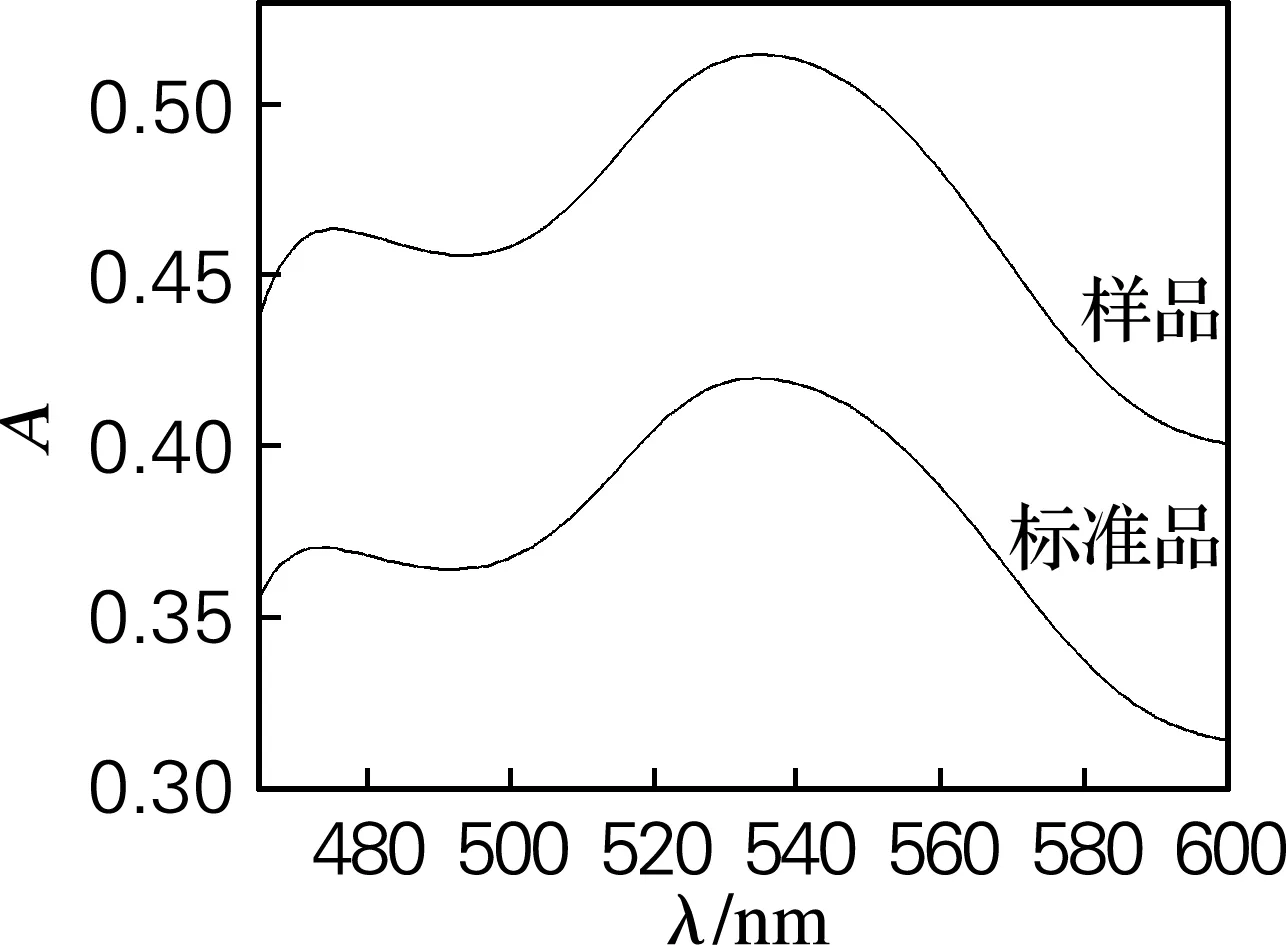
图1 标准品及刺五加皂苷紫外-可见光谱波长扫描图
Fig.1 UV-Vis wavelength scanning of standard sample andAcanthopanaxsenticosussaponins
2.2 标准曲线的绘制
实验结果绘制得到标准曲线,吸光度Y与皂苷质量浓度X(mg/mL)之间的回归方程为:Y=5.462X+0.002,相关系数R2=0.999 0,线性关系良好。
2.3 刺五加皂苷的提取条件
2.3.1 提取温度
称取10.0 g干燥刺五加粉5份,置于5个250 mL的圆底烧瓶中,用体积分数为70%的乙醇作为提取剂,按1∶10(g/mL)的料液比分别在40、50、60、70、80 ℃条件下回流提取2 h,然后进行纯化步骤,洗脱体积流量为27.22×10-6m3/min,洗脱剂乙醇的体积分数为50%,洗脱液减压蒸馏,浓缩液经真空冷冻干燥,结果见图2。
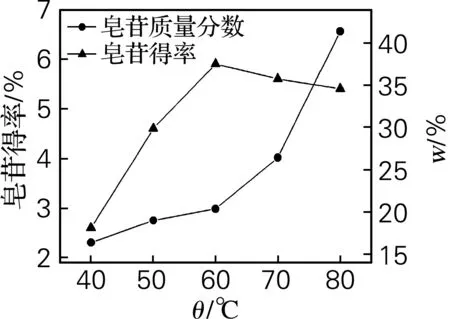
图2 温度对刺五加皂苷提取的影响
从图2可以看出,60 ℃条件下刺五加皂苷的得率最高,但皂苷质量分数不高,而80 ℃条件下皂苷得率相对较高,皂苷质量分数也最高。此外,实验过程中发现,当温度高于80 ℃,提取液沸腾,有乙醇损失,给后续操作带来不便,同时增大了成本。故确定80 ℃为皂苷提取效果最好的温度。
2.3.2 乙醇体积分数
称取10.0 g干燥刺五加粉5份,置于5个250 mL的圆底烧瓶中,然后向其加入体积分数为50%、60%、70%、75%、80%的乙醇,按1∶10的料液比,在温度为80 ℃时回流提取刺五加皂苷2 h,经纯化后,结果见图3。
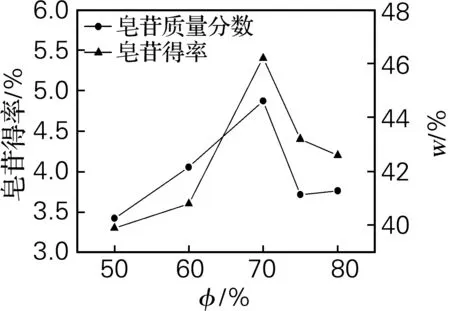
图3 乙醇体积分数对刺五加皂苷提取的影响
由图3可以看出,乙醇体积分数为70%时刺五加皂苷的得率最高,皂苷质量分数也最高,故选取最佳的乙醇体积分数为70%。
2.3.3 料液比
称取10.0 g干燥刺五加粉5份,置于5个250 mL的圆底烧瓶中,然后向其中加入体积分数为70%的乙醇溶液,料液比分别为1∶6、l∶7、1∶8、1∶9、1∶10摇匀,在温度为80 ℃时回流提取刺五加皂苷2 h,经纯化后,结果见图4。

图4 料液比对刺五加皂苷提取的影响
由图4可以看出,料液比为1∶6的刺五加皂苷的得率最高,而超过1∶6时料液比呈下降的趋势,可能是由于刺五加叶中的刺五加皂苷大量溶于提取剂乙醇溶液当中,说明刺五加中的有效成分的提取已经比较充分,继续增加料液,含量没有多大的变化,反而增加了浓缩的时间,损失量相对也会增加。而采用料液比为1∶5进行回流提取时,所得提取液太少,在实验操作中不可行。从皂苷含量角度出发,料液比1∶6、1∶7和1∶8相比较,皂苷质量分数差别不大。此外,由于刺五加粉末的吸湿性强,考虑原料节省因素,故选取1∶6 的料液比为最佳料液比。
2.3.4 提取时间
称取10.0 g干燥刺五加粉5份,置于5个250 mL的圆底烧瓶中,然后向其中加入体积分数为70%的乙醇溶液,按 1∶6的料液比,分别在80 ℃ 水浴中回流提取刺五加皂苷2、3、4、5、6 h,经纯化后,结果见图5。

图5 提取时间对刺五加皂苷提取的影响
由图5可以看出,随着提取时间的增加,刺五加皂苷的得率也随之增高,且皂苷质量分数也是呈上升的趋势。但是,若浸提时间过长,一些大分子物质溶出,造成提取液的颜色变深,一些活性成分被破坏,不利于皂苷的提取,因此选择提取时间为5 h。
2.4 纯化工艺
2.4.1 样品制备及预处理
精密称取干燥的刺五加叶粉末10.0 g,按最佳工艺条件提取,提取液经过滤、脱色素浓缩、减压蒸馏除去正丁醇,用水溶解后作为样品液。
2.4.2 洗脱液体积流量的确定
样品液加入预处理好的层析柱,反复吸附,去离子水脱杂质后,用乙醇体积分数为50%的洗脱液分别以6.8×10-6、13.61×10-6、20.42×10-6、27.22×10-6、34.03×10-6m3/min 的体积流量洗脱皂苷,分别收集洗脱液,冷冻干燥后分析结果见图6。
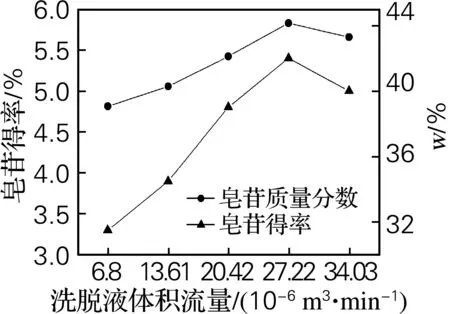
图6 洗脱液体积流量对刺五加皂苷纯化的影响
由图6可以看出,洗脱液体积流量在27.22×10-6m3/min 时,刺五加皂苷的质量分数最高,且皂苷得率也是最高的。因此,选择27.22×10-6m3/min为最佳体积流量。
2.4.3 乙醇体积分数的确定
样品液加入预处理好的AB-8树脂柱,反复吸附,去离子水脱杂质后,用体积流量为27.22×10-6m3/min ,体积分数为40%、50%、60%、70%的乙醇作为洗脱剂洗脱吸附在大孔树脂上的刺五加皂苷,结果如图7所示。由图7可以看出,当乙醇体积分数为60%时,刺五加皂苷的得率和质量分数都达到最高。因此,选取最佳乙醇洗脱体积分数为60%。

图7 洗脱剂乙醇的体积分数对刺五加皂苷纯化的影响
Fig.7 Purification ofAcanthopanaxsenticosussaponins in different ethanol elution volume fraction
3 结 论
考察了提取温度、浸提时间、乙醇的体积分数和料液比4个因素对刺五加皂苷提取结果的影响;优化了乙醇的体积流量及体积分数等大孔吸附树脂法纯化刺五加皂苷的工艺;采用紫外-分光光度法对刺五加皂苷进行定量分析。结果表明,最佳提取条件为:浸提温度80 ℃,浸提时间5 h,乙醇的体积分数70%,料液比1∶6;最佳纯化条件为:乙醇的体积流量27.22×10-6m3/min,洗脱剂乙醇的体积分数60%。在最优提取纯化条件下,刺五加皂苷的得率为5.9%,质量分数为44.1%。
[1] 谢新,狄留庆. 刺五加叶化学成分和药理作用研究进展[J].中国现代中药, 2008, 10(11):6-8.
[2] PHUONG N T, LEE K A, JEONG S J, et al. Capillary electrophoretic method for the determination of diterpenoid isomers inAcanthopanaxspecies[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 40(1):56-61.
[3] 李健,陈姝娟,张若男,等. 超声辅助溶剂法提取肉桂总皂苷工艺的研究[J]. 食品科学, 2008, 29(4):177-180.
[4] 王玉琴,郑清. 刺五加中刺五加皂苷提取条件的优化[J].盐城工学院学报:自然科学版, 2005, 18(1):49-51.
[5] 杨磊,高岩峰,刘洋,等. 超声波提取刺五加主要酚苷及苷元的工艺优化[J]. 林产化学与工业, 2009, 29(3):93-99.
[6] 刘忠英,晏国全,卜凤泉,等. 中药刺五加叶中有效成分的几种微波辅助提取方法研究[J]. 分析化学研究简报, 2005, 33(4):531-534.
[7] 雷建飞,贾莉萍. 大孔吸附树脂分离纯化皂苷工艺研究进展[J]. 中国现代医药, 2006, 8(11):22-24.
[8] 马伟光,玉波罕,黄押稳,等. 大孔吸附树脂柱层析法对西双版纳产刺五加总皂苷吸附性能的研究[J]. 云南中医学院学报, 2008, 31(2):9-11.
