利用离子液体[Bmim]Br制备富含锐钛矿微晶的SiO2-TiO2复合气凝胶
2013-09-22宁丽媛,戴洪义,于春玲,高学明,朱美玲
宁 丽 媛, 戴 洪 义, 于 春 玲, 高 学 明, 朱 美 玲
(大连工业大学 轻工与化学工程学院, 辽宁 大连 116034)
0 引 言
TiO2作为传统的光催化剂,对其进行了长期的研究和探讨,普遍认为高的比表面积和一定尺寸的锐钛矿型微晶结构是TiO2具有高光催化活性的有利条件。
为了提高催化剂的比表面积和多孔性网络结构,近几年来,SiO2-TiO2复合气凝胶作为光催化剂引起人们的关注[1-2]。气凝胶的制备传统方法是采用凝胶-凝胶缩聚,再经过超临界干燥。超临界干燥的目的在于避免常压干燥过程中凝胶骨架的收缩坍塌。这种方法技术要求高,且成本昂贵,从而限制了气凝胶的工业化推广应用。因此,常压干燥制备气凝胶逐步成为人们研究的热点[3-4]。
由于离子液体独特的性质,如极低的蒸汽压和表面张力、极强的溶解能力和较高的热稳定性等[5],人们开始利用离子液体在常压干燥条件下制备SiO2气凝胶。但是利用离子液体常压干燥制备SiO2-TiO2复合气凝胶的报道极少。本课题组曾以离子液体[Hmim]Br为模板剂,在常压干燥条件下制备出了具有较高比表面积的多孔结构的SiO2-TiO2复合气凝胶[6],但气凝胶必须经过高温煅烧才具有较好的锐钛矿晶型,且经煅烧凝胶的比表面积大幅度减小。
本实验采用[Bmim]Br作为助溶剂和模板剂,在常压干燥和不经煅烧的条件下制备出具有锐钛矿微晶结构的多孔性、高比表面积的SiO2-TiO2复合气凝胶,气凝胶具有良好的光催化活性,应用前景良好。
1 实 验
1.1 SiO2-TiO2气凝胶的制备
采用两步溶胶-凝胶法,以正硅酸乙酯(TEOS)和钛酸丁酯(TBT)为前驱体,无水乙醇(EtOH)为溶剂,以冰乙酸和尿素分别作为酸、碱催化剂,以离子液体1-丁基-3-甲基咪唑溴[Bmim]Br (以IL表示)为模板剂和助溶剂,在常压干燥条件下制备了SiO2-TiO2复合气凝胶。
离子液体([Bmim]Br)的制备参照文献[7-8]中的方法。考虑到TEOS的水解缩聚速率低于TBT的水解缩聚速率,先制备SiO2溶胶,其中n(TEOS)∶n(EtOH)∶n(H2O)∶n(CH3COOH)∶n[(NH2)2CO]∶n(IL)=1∶7∶4.62∶0.002∶0.04∶1。将TEOS和一半的EtOH充分混合制得A溶液,将其余的原料充分混合制得B溶液,然后在剧烈搅拌条件下将B溶液缓慢滴加到A溶液中,即得SiO2溶胶。30 min后以相同的方法制备TiO2溶胶,其中n(TBT)∶n(EtOH)∶n(H2O)∶n(CH3COOH)∶n[(NH2)2CO]∶n(IL)=1∶18∶3.75∶1.8∶0.04∶1。约1 h后,将SiO2溶胶和TiO2溶胶按照n(SiO2)/n(TiO2)=1/10的比例快速混合,并在常温下剧烈搅拌30 min。将最后得到的混合溶胶倒入广口瓶中,置入60 ℃恒温水浴锅中。凝胶后用水溶液作为老化液老化4 d。将老化后的湿凝胶分别用环己烷和无水乙醇反复浸泡、洗涤。在常压条件下、在60和80 ℃各干燥8 h,即得到SiO2-TiO2复合气凝胶。
1.2 表 征
采用扫描电镜(SEM)(Hitachi S-2500)观察气凝胶的表面形貌。采用美国Quantachrome公司NOVA2200e型物理吸附仪测定SiO2-TiO2复合气凝胶的比表面积和孔径分布。采用日本D/max3B 型X射线衍射仪(Cu-Ka,40 kV,30 mA) 测定气凝胶的XRD图谱,进行物相分析,并根据谢乐公式(D=0.89λ/βcosθ)计算平均晶粒尺寸。
2 结果与讨论
2.1 SiO2-TiO2气凝胶的形貌
图1为SiO2-TiO2气凝胶的电镜扫描图,可以看出,SiO2-TiO2气凝胶为表面凸凹,分布均匀的多孔海绵状结构。
2.2 SiO2-TiO2气凝胶的比表面积和孔径分布
图2是SiO2-TiO2复合气凝胶的N2吸附-脱附等温线,为典型的Ⅳ等温线,表明制备的复合气凝胶具有多孔结构。该气凝胶的比表面积是385.2 m2/g,孔体积为0.549 cm3/g,介孔孔径为4~50 nm,最可几孔径为22 nm。

图1 SiO2-TiO2气凝胶的SEM照片
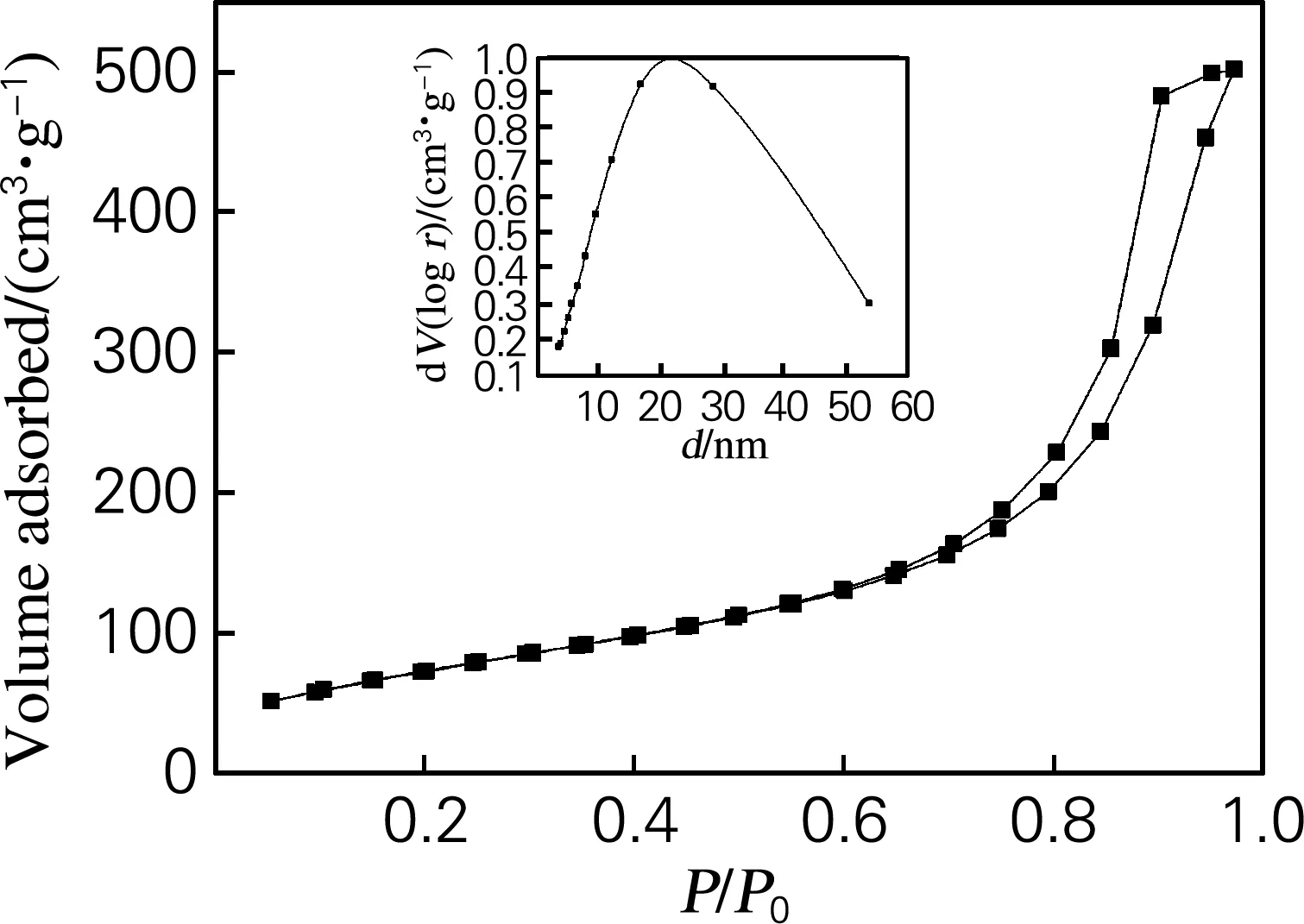
图2 SiO2-TiO2气凝胶的N2吸附-脱附等温线及孔径分布图
Fig.2 N2adsorption-desorption isotherm and pore size distribution profile of SiO2-TiO2aerogels
2.3 离子液体[Bmim]Br对SiO2-TiO2气凝胶晶型和晶粒尺寸的影响
图3为不同IL添加量制备的SiO2-TiO2气凝胶的XRD图。当n(IL)/n(SiO2+TiO2)=1时,由图3(b)可以看出,SiO2-TiO2复合气凝胶中TiO2具有良好的锐钛矿晶型,且无其他晶型出现。晶体衍射峰峰型尖锐,按谢乐公式以(101)晶面计算,晶粒粒径为6.2 nm。为了考察在凝胶制备过程中离子液体对TiO2晶粒形成的影响,改变离子液体添加量n(IL)/n(SiO2+TiO2)分别为0和3,其他试剂用量同“1.1”,其XRD图谱分别如图3(a)、图3(c)所示。不难看出,采取溶胶-凝胶法制备SiO2-TiO2复合气凝胶,无论使用离子液体与否,其TiO2微粒均以锐钛矿的晶粒形式存在。当n(IL)/n(SiO2+TiO2)=0时,如图3(a)所示,衍射峰型平缓,半峰宽大,粒径为2.6 nm,说明适量的离子液体存在有利于TiO2结晶。但如果离子液体的浓度过高,反而不利于TiO2结晶形成(如图3(c)所示)。当n(IL)/n(SiO2+TiO2)=3时,晶粒粒径为1.7 nm。
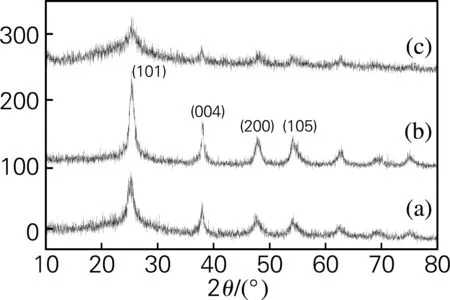
(a) n(IL)/n(SiO2+TiO2)=0;(b) n(IL)/n(SiO2+TiO2)=1;(c) n(IL)/n(SiO2+TiO2)=3
图3 不同IL添加量制备的SiO2-TiO2气凝胶的XRD图
Fig.3 XRD patterns of SiO2-TiO2aerogels prepared by different IL additions
YOO等[9]在TiO2气凝胶的制备过程中也发现类似的现象。IL有利于晶体的结晶可能是由于IL的高溶解性和其极低的表面张力。在实验中也发现,[Bmim]Br作为助溶剂和模板剂,一方面可以有效地使TEOS、TBT前驱体与催化剂等组分形成均相溶液,即使是硅、钛形成的预聚物也可以被迅速地溶解分散;另一方面也可以使预聚物以IL为模板剂逐渐形成介孔网络结构。这为晶体的结晶溶解平衡提供了良好的局部环境。同时,IL的低表面张力可有效地阻止微晶粒子的团聚。但是,当IL的浓度过高, IL的高黏度会阻止离子的扩散,不利于结晶溶解平衡的建立,因此也不利于较大晶粒的生长。只有适当的离子液体添加量才有利于锐钛矿相TiO2微晶结构的形成。在本实验中,最佳的[Bmim]Br添加量为n(IL)/n(SiO2+TiO2)=1。
3 结 论
以离子液体[Bmim]Br为助溶剂和模板剂,可以在常压干燥条件下不经过煅烧制备出具有锐钛矿微晶结构的SiO2-TiO2复合气凝胶,气凝胶具有介孔网络结构和大的比表面积(385.2 m2/g)。同时,不同添加量的离子液体作为助溶剂和模板剂对复合气凝胶中TiO2晶型及晶粒度影响很大。本实验中,最佳的离子液体助溶剂添加量为n(IL)∶n(SiO2+TiO2)=1,所得的锐钛矿TiO2粒径最大,为6.2 nm。
[1] 陈希慧,潘艳坤,黄初升,等. TiO2-SiO2光催化纸业废水有色有机物的降解[J]. 分子催化, 2005, 19(3):172-176.
[2] 伏宏彬,金灿,夏平,等. 硅钛复合气凝胶的制备工艺与光催化能力研究[J]. 无机盐工艺, 2009, 41(11):26-28.
[3] NAYAK J P, BERA J. Preparation of silica aerogel by ambient pressure drying process using rice husk ash as raw material[J]. Transaction of the Indian Ceramic Society, 2009, 68(2):1-4.
[4] 刘敬肖,冷小威,史非,等. 常压干燥制备TiO2-SiO2复合气凝胶的结构与性能[J]. 硅酸盐学报, 2010, 38(12):2296-2302.
[5] 于培盈,郑亚萍,张娇霞,等. 离子液体在纳米材料中的应用进展[J]. 化工进展, 2010, 29(7):1251-1255.
[6] 李艳春,于春玲,戴洪义,等. 离子液体中TiO2-SiO2复合气凝胶的制备[J]. 大连工业大学学报, 2013, 32(1):43-46.
(LI Yanchun, YU Chunling, DAI Hongyi, et al. Preparation of TiO2-SiO2composite aerogels in ionic liquids[J]. Journal of Dalian Polytechnic University, 2013, 32(1):43-46.)
[7] 何爱珍,王坤,刘红光,等. 离子液体中间体1-丁基-3-甲基咪唑溴盐的合成[J]. 精细石油化工进展, 2009, 10(11):22-25.
[8] 吉锦秀,杨文忠,刘山,等. 离子液体中间体的合成及表征[J]. 精细石油化工进展, 2007, 24(6):55-57.
[9] YOO K, CHOI H, DIONYSIOU D D. Ionic liquid assisted preparation of nanostructured TiO2particles[J]. Chemical Communications, 2004(17):2000-2001.
