不同前处理方式对沙枣叶总黄酮提取的影响
2013-09-22穆立蔷周智博
王 漫,穆立蔷*,周智博,姜 鹤
(东北林业大学 林学院,黑龙江 哈尔滨 150040)
沙枣(Elaeagnus angustifoliaL.),系胡颓子科(Elaeagnaceae)胡颓子属(Elaeagnus)落叶乔木,主要分布于我国东北、西北等地区,具有抗旱、抗盐碱、耐贫瘠、防风固沙的特性[1],是集生态效益与经济效益于一体的资源植物。沙枣的枝皮、果实、叶片和花粉中都含有总黄酮,总黄酮是植物在代谢过程中产生的一类天然化合物[2-3],其结构类型多样,生物活性广泛,无论在食品还是医药领域都具有广阔的开发利用前景。研究表明,沙枣总黄酮具有降低血清胆固醇、抗氧化、抗病毒、增强免疫力、清除羟基自由基、治疗慢性气管炎、冠心病等功效[4-7]。目前,关于沙枣叶总黄酮的研究多集中于提取工艺优化方面,尚未见其前处理方式的相关报道。其实验以超声波法提取总黄酮,紫外-可见分光光度法测定其含量,研究了干燥方法、烘干温度、破碎度对其总黄酮得率的影响,比较了各生长期总黄酮含量差异,为沙枣资源更有效合理地开发利用提供理论基础,同时为其工业化生产提供借鉴。
1 材料与方法
1.1 材料与试剂
沙枣叶:采摘于黑龙江省肇东市,黑龙江大学生命科学学院宋富强教授提供。
芦丁标准品:中国药品生物制品检定所;无水乙醇、石油醚、硝酸铝、亚硝酸钠、氢氧化钠等均为国产分析纯。
1.2 仪器与设备
DHG-9240电热恒温鼓风干燥箱:上海一恒科学仪器有限公司;JA2003电子天平:上海良平仪器仪表有限公司;LGJ-10型冷冻干燥机:北京四环科学仪器厂;KQ3200超声波清洗机:昆山市超声仪器有限公司;R-205B旋转蒸发仪:上海申胜仪器公司;721分光光度计:天津泰斯特仪器公司;FJ-200高速万能粉碎机:上海精密科学仪器有限公司。
1.3 方法
1.3.1 供试沙枣叶片含水量测定[8]
取采摘的新鲜沙枣叶片200g,平铺于干燥铝盘中,厚度不超过20mm,于105℃干燥5h,迅速将铝盘移置干燥器中冷却30min,精确称其质量。以上沙枣叶样品再干燥1h后冷却,称其质量,至两次连续称质量差异小于1g;重复测定3次,取平均值,沙枣叶含水量计算公式如下:
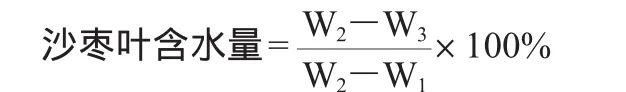
式中:W1为铝盘质量,g;W2为铝盘与新鲜沙枣叶质量,g;W3为铝盘与烘干沙枣叶质量,g。
1.3.2 沙枣叶前处理工艺
①干燥方法
取同一批次采摘沙枣鲜叶每份100g,以不同干燥方式进行干燥(干燥程度均达到叶片质硬而脆,相互之间质量差异小于1g),记录干燥时间,具体干燥方法见表1。

表1 沙枣叶不同干燥方法Table 1 Different drying methods ofElaeagnus angustifoliaL.leaves
②破碎程度
取80℃条件下烘干沙枣叶,粉碎处理,分别过40目、60目、80目、100目和120目筛备用,采用超声波法进行总黄酮的提取,分析其得率变化。
③生长期
黑龙江省物候期稍迟,选定2012年5月至9月此段生长期,于每月第15日对标记的沙枣树进行叶片采摘,以最佳前处理方式处理后测定各生长期总黄酮含量,选定叶片最佳采摘时期。
1.3.3 脱脂、除杂
经干燥、粉碎后的沙枣叶样品,按1∶10(w/v)比例加入60℃~90℃沸程的石油醚,置于40℃水浴恒温摇床中以100r/min振荡浸提2h,抽滤,重复3次,除去油脂、色素等杂质,挥干石油醚备用。
1.3.4 芦丁标准曲线制备
精确称取干燥至质量恒定的芦丁标准品20.6mg于100mL容量瓶中,加入70%vol乙醇进行溶解并定容配制成质量浓度为0.206mg/mL的芦丁标准溶液。精密吸取芦丁标准品溶液0mL、0.5mL、1.0mL、1.5mL、2.0mL、2.5mL和3.0mL分别置于7支10mL具塞试管中(按顺序分别以0,1…6号进行编号),补充70%vol乙醇至5mL,再分别加入质量分数为5%NaNO2溶液0.3mL,混匀,放置6min后分别加入质量分数为10%Al(NO3)3溶液0.3mL,混匀,6min后分别加入质量分数为4%NaOH溶液4mL,混匀,用70%vol乙醇标定至刻度线,放15min,设0号管为空白对照,于510nm波长处测定吸光度,制作标准曲线,得到回归方程:y=11.429x+0.0037(y为吸光度值,x为芦丁质量浓度,R2=0.9999)。
1.3.5 沙枣叶总黄酮超声波提取法及含量测定[9-12]
称取备用沙枣叶样品1.00g置于锥形瓶中,在75%vol乙醇为提取液、料液比为1∶25、超声功率为300W,温度为45℃条件下超声波提取30min,抽滤,重复进行提取3次,合并提取液并真空浓缩,干燥后得沙枣叶总黄酮提取物。
精确量取沙枣叶75%vol乙醇提取液1.0mL,以芦丁为标准物,按照1.3.5项标准曲线的制备方法加NaNO2-Al(NO3)3-NaOH体系显色,采用紫外-可见分光光度法测定总黄酮含量,做3次平行实验。总黄酮含量计算公式如下:
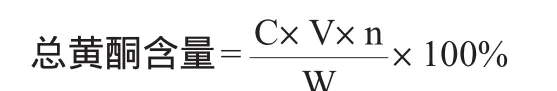
式中:C为根据回归方程计算得到总黄酮质量浓度,mg/mL;n为稀释倍数;V为提取液体积,mL;W为所用原料叶质量,g。
2 结果与分析
2.1 新鲜沙枣叶片含水量测定
新鲜沙枣叶含水量平行测定3次,得摘取沙枣叶的平均含水量为64.85%。
2.2 干燥方法对沙枣叶总黄酮得率影响
将新鲜沙枣叶按照1.3.2项干燥方法进行处理,粉碎过40目筛,以1.3.5项超声波法进行提取,记录干燥时间,比较总黄酮得率,结果分别见图1、图2。

图1 不同干燥方法对总黄酮得率的影响Fig.1 Effect of different drying method on the yield of total flavonoids
由图1、图2可知,5种干燥处理从总黄酮得率角度比较,优选顺序为:冻干>90℃烘干>阴干>50℃烘干>晒干。从干燥时间角度比较,优选顺序为:90℃烘干>冻干>50℃烘干>晒干>阴干。综合总黄酮得率与干燥耗时分析,实验中冻干处理总黄酮得率最高,达到1.62%,干燥时间较短4h,但设备昂贵,能耗大,生产能力有限;其次是90℃烘干处理,得率为1.39%,干燥时间最短为1.2h,且更利于生产实践。阴干处理耗时最长,晒干处理后总黄酮得率最低,为1.18%,且耗时较长为34h,因此采摘沙枣叶时应避免使用晒干法。
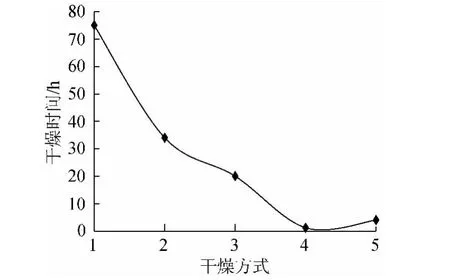
图2 不同干燥方法与时间关系Fig.2 The relationship between drying method and drying time
2.3 烘干温度对沙枣叶总黄酮得率影响
将鲜叶分别在50℃、60℃、70℃、80℃、90℃、100℃条件下烘干至质量恒定,记录烘干时间,粉碎过40目筛,比较沙枣叶总黄酮得率,结果见图3、图4。
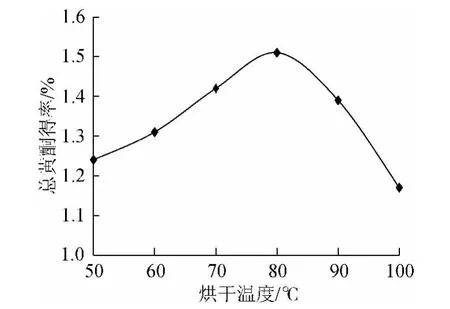
图3 不同烘干温度对总黄酮得率的影响Fig.3 Effects of different drying temperature on the yield of total flavonoids
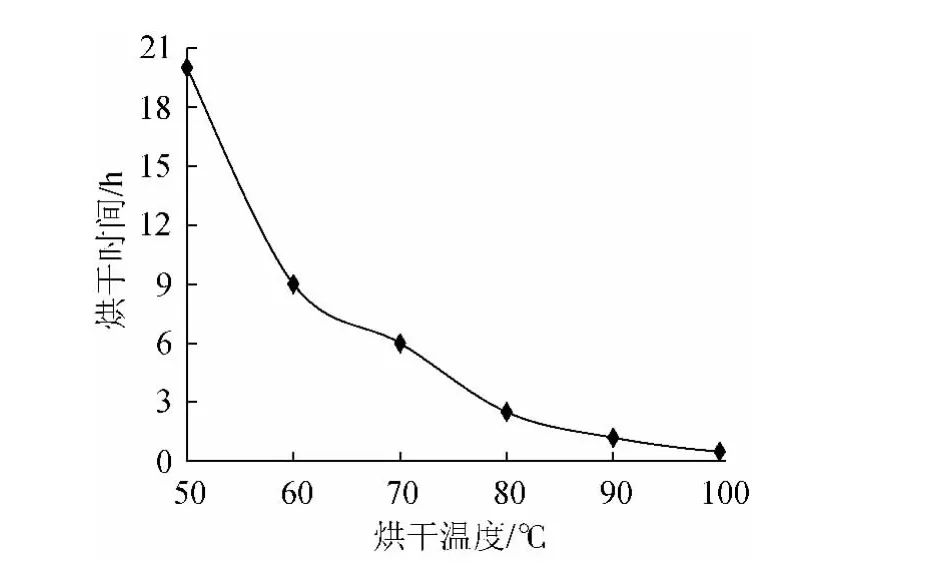
图4 不同烘干温度与时间的关系Fig.4 The relationship between drying temperature and drying time
生产实践中烘干法为最适干燥方法,由图3、图4表明,随着烘干温度升高,烘干时间不断缩短,沙枣叶总黄酮得率也随之出现变化。在50℃~80℃范围内随着烘干温度升高,总黄酮得率不断升高,当烘干温度为80℃时,得率达到最高,为1.51%,烘干时间相对较短为2.5h;当温度超过80℃后,随着烘干温度的升高,总黄酮得率逐渐降低,100℃时总黄酮得率,为1.17%,相对于80℃时下降了22.5%。当烘干过程中温度超过100℃时,叶片需及时翻动,否则极易焦化。
2.4 破碎程度对沙枣叶总黄酮得率影响
按照1.3.2项破碎程度处理方式对沙枣叶处理,进行总黄酮的提取,比较总黄酮得率,结果见图5。
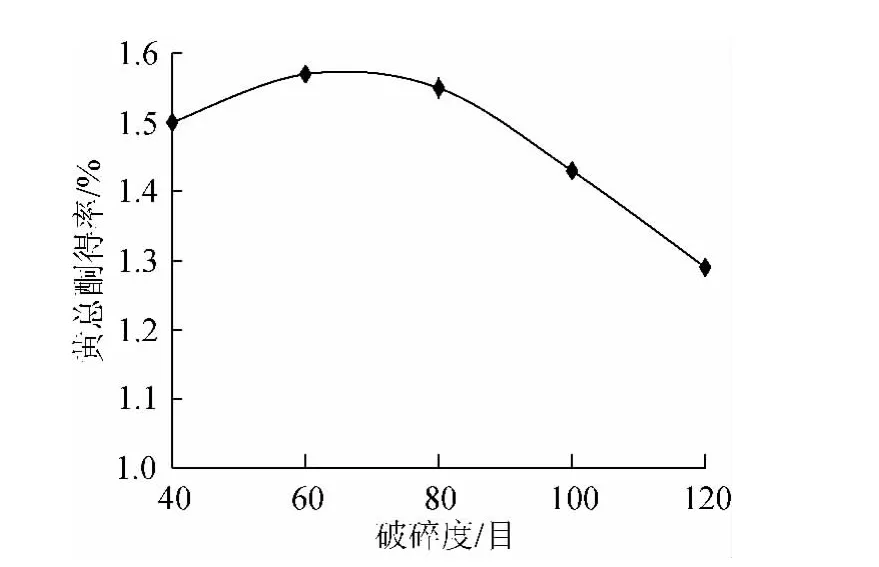
图5 不同粒度对总黄酮得率的影响Fig.5 Effects of different grind degrees on the yield of total flavonoids
沙枣叶样品粒度不同,总黄酮得率也不同,由图5可知,粒度从40目到60目时随破碎程度增加,总黄酮得率有所增加。沙枣叶样品粒度60目时总黄酮得率达到最大1.57%;但破碎度超过60目后,沙枣叶总黄酮得率逐渐减少,沙枣叶样品粒度120目时,总黄酮得率仅为1.29%,下降了17.8%。可能因为沙枣叶粉末过细,固液分离的难度增大,损失增加,所以实际操作中选择粒度60目为宜。
综上所述,沙枣叶提取总黄酮冻干法得率最高,其次为烘干法(最适于生产实践),50℃~100℃范围内最佳烘干温度为80℃,最佳破碎度为粉碎过60目筛。
2.5 不同生长期沙枣叶中总黄酮含量变化
按照1.3.2项选择生长期采摘沙枣叶片,80℃烘干后粉碎过60目筛,按照1.3.5项方法测定总黄酮含量,结果见图6所示。
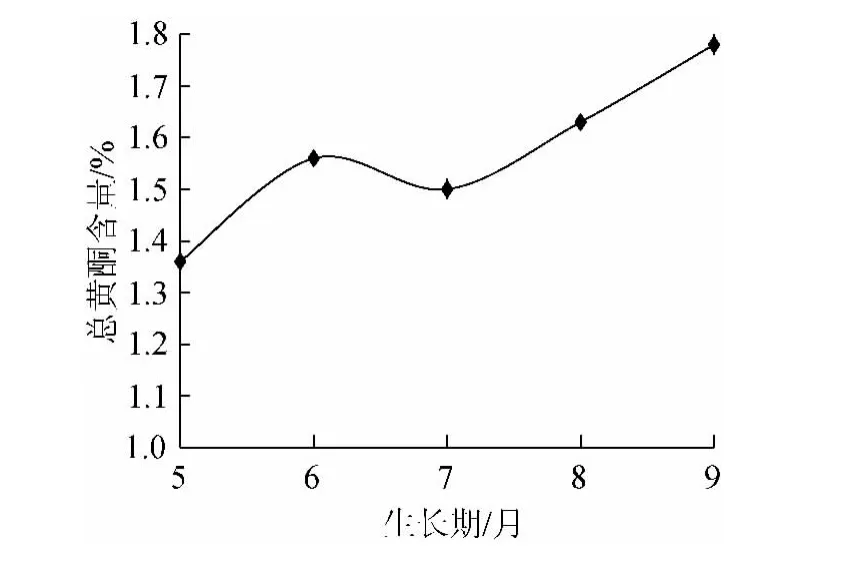
图6 不同生长期对总黄酮含量的影响Fig.6 Effects of different growth periods on the yield of total flavonoids
黑龙江地区物候期稍迟,实验选定生长期为5月~9月。由图6可知,总黄酮含量优选顺序为,9月>8月>6月>7月>5月,9月份沙枣叶总黄酮含量最高,达到1.78%,在黑龙江省9月沙枣进入生长后期,经过一个生长季的发育生长,一些次生代谢产物有了较多的积累,且沙枣此时已成熟,采摘沙枣叶片不会影响沙枣植株生长及沙枣收获。
3 讨论
3.1 不同干燥方法对沙枣叶总黄酮得率影响
植物鲜样提取有效成分不易保存并且受季节条件限制,干燥处理成为必要工艺。不同的干燥方法对沙枣叶中总黄酮得率有较大影响,实验中冷冻干燥后总黄酮得率最高,处理时间较短,但设备昂贵,操作复杂,生产能力有限;晒干处理后总黄酮得率最低,可能是由于沙枣叶总黄酮中部分物质对光不稳定,在太阳光照射下易发生氧化,从而使样品中总黄酮得率下降。阴干与晒干处理易受天气影响,并需要很长时间和较大场地,在生产中不好实现。相比而言,烘干处理得率高,所需时间短,更便于实际应用。实验得出,80℃为最佳烘干温度,总黄酮得率达到1.51%,烘干时间相对较短2.5h。说明沙枣叶提取的总黄酮耐热性较稳定,只有部分成分在烘干温度过高(超过80℃)时会发生分解[13],因而生产实践中选择最适干燥方式为80℃条件下烘干。
3.2 不同破碎程度对沙枣叶总黄酮得率影响
沙枣叶破碎程度对总黄酮得率的影响较大,沙枣叶总黄酮提取时样品粒度选择60目为宜。通过破碎可以在减少扩散微粒的半径同时增大扩散面积,传质作用面积增大,得率增加[14],即一定范围内,随着破碎度的增加,得率提高。而当样品过于粉碎,粉末目数达一定程度时,固液分离的难度加大,过滤时滤饼中残留的滤液量增多,损失加大,使得率反而下降,且粉末过细,浸提出的杂质和副产物越多,不利于纯化。
3.3 不同生长期对沙枣叶总黄酮含量影响
总黄酮是植物生长过程中产生的次生代谢产物,植物体内次生代谢产物的产生和积累与植物的生长发育程度及外界环境因素密切相关[15]。从实验结果可知,沙枣叶中的总黄酮含量9月份最高;从生理情况看,黑龙江省物候期稍迟,5月份沙枣处于发芽、幼叶生长时期,需要消耗大量营养物质,致使总黄酮含量大幅度下降;6、7月份主要处于开花、结果时期,叶片总黄酮含量相对较低,不宜采摘;8月份早熟沙枣果已趋成型,叶中总黄酮含量明显升高。9月份黑龙江省已进入沙枣植株生长后期,经过一个生长季的发育生长,一些次生代谢产物有了较多的积累,这可能是沙枣中总黄酮类含量9月份要高于其他月份的原因。因此,选定9月开始逐步采摘沙枣叶,既有利于沙枣植株生长,又有利于其总黄酮的提取。
4 结论
不同前处理方式对沙枣叶总黄酮提取有较大影响。实验结果表明,冻干法干燥后提取沙枣叶总黄酮得率最高,达到1.62%;其次为烘干法,最佳烘干温度为80℃,最佳破碎度为60目,此条件下总黄酮得率为1.57%,且烘干法更便于实际应用;生长期间,9月摘取沙枣叶最为适宜,沙枣叶总黄酮含量为1.78%。
[1]郭丽君,王玉涛.沙枣种质资源特性及利用价值[J].中国野生植物资源,2008(5):32-34.
[2]SI CL,XU J,WU L,et al.Antioxidant flavonoids from bark ofElaeagnus angustifolia[J].Planta Med,2009,75(9):19-22.
[3]王婧杰,马凤鸣,穆立蔷.响应面优化紫椴枝皮黄酮提取工艺的研究[J].中国酿造,2012,31(10):96-97.
[4]RAMAMOORTHY P K,BONO A.Antioxidant activity,total phenolic and flavonoid content ofMorinda citrifoliafruit extracts from various extraction processes[J].J Eng Sci Technol,2007,2(1):70-80.
[5]SHI Y,LU T,WANG Y.Studies on the hydroxy-group free radical eliminated of flavonoids ofElaeagnus angustifoliaL.Flowrse[J].Food Sci,2004,11:102-103.
[6]张万年,刘泽鹰,王哲民.沙枣树药用价值和有效成分研究的进展[J].中草药,1986,17(7):41-44.
[7]YAN E,YUPING SHI,YONGNING W,et al.Hydroxyl radical eliminating activities of flavonoid extracted from foliages ofElaeagnus angustifoliaL.[J].J Qinghai U,2006(3):69-71.
[8]中华人民共和国卫生部药典委员会.中国药典[S].北京:化学工业出版社,2000.
[9]王延峰,李延清,封德顺,等.超声法提取银杏叶黄酮的研究[J].食品科学,2002,23(8):166-167.
[10]孙 芸,刘 艺,燕雪花,等.新疆沙枣总黄酮含量测定及提取工艺优化[J].湖北农业科学,2012,51(16):163-164.
[11]焦 翔,殷丽君,程永强.沙棘叶黄酮的提取及抑菌作用研究[J].食品科学,2007,28(8):124-125.
[12]蒋新龙.蓖麻叶与花总黄酮提取及含量测定[J].中国酿造,2010,29(1):129-131.
[13]苏东林,单 杨,李高阳,等.酶法辅助提取柑桔皮总黄酮的工艺优化研究[J].农业工程学报,2008,24(4):240-245.
[14]孙国金.超声辅助竹叶黄酮提取研究[D].杭州:浙江大学硕士论文,2003.
[15]ENDT DV,KIJNE JW.Transcription factors controlling plant secondary metabolism:what regulates the regulator[J].Phytochemistry,2002,61(2):107-114.
