酶氧化鸡脂制备鸡肉味香料前体物
2013-09-22袁雪芬张智海
袁雪芬,张智海,朱 凯*
(南京林业大学 化学工程学院,江苏 南京 210037)
肉香味形成的主要前体物包括2大类:水溶性物质和脂质[1]。水溶性物质主要形成肉类的一般性风味,而脂质则是形成不同肉类特征性风味的主要物质。很多研究表明[2-4],在肉类烹调过程中,是由美拉德反应、脂质氧化降解反应及两者之间的相互作用反应共同形成了浓郁的肉香味。
早前,关于还原糖和氨基酸反应直接制备肉味香料的研究很多[5-6],关于植物油脂氧化制备香味料的报道也较多[7],而关于脂肪氧化降解对肉味香料的贡献的研究却相对较少。脂质在氧化过程中,不饱和脂肪酸与氧发生自由基链反应生成氢过氧化物,氢过氧化物虽无色无味,但进一步降解可形成醛类、酮类等具有芳香性气味的小分子物质,并且可与美拉德反应相互作用,改变其反应途径,产生一些特征性香味物质[8-9]。普通的脂肪氧化途径有两种:自氧化和加热氧化。自氧化一般是酸败的表现,而加热氧化需要的温度相对较高。研究发现,大豆等植物中存在的脂肪氧合酶能专一催化含有cis,cis-1,4戊二烯结构的直链脂肪酸、脂肪酸酯和醇,通过分子内加氧反应形成含有共轭双键的氢过氧化衍生物[10-12]。以酶催化脂肪氧化,不仅反应条件温和且反应过程绿色无污染。
1 材料与方法
1.1 材料与试剂
鸡脂:南京华扬香精香料实业有限公司;大豆:市场购买;亚油酸:阿拉丁试剂公司;石油醚:无锡市亚盛化工有限公司;碘化钾:国药集团化学试剂有限公司;异辛烷:上海凌峰化学试剂有限公司;硫代硫酸钠:上海久亿化学试剂有限公司。
1.2 仪器与设备
DHJF-4002型低温恒温反应搅拌浴:郑州市科工贸有限公司;XDW600XZ-65L无油空气压缩机:浙江省磐安工业园区;TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 脂肪氧合酶提取[13-14]
将大豆粉碎后40目过筛,经石油醚(沸程60℃~90℃)浸提2h,得脱脂豆粉。每批次取20g脱脂大豆粉,加入200mL蒸馏水,室温条件下搅拌浸提1h,再由离心机在常温5000r/min条件下离心25min,得脂肪氧合酶粗酶液。
1.3.2 鸡脂氧化方法测定[15]
在装有电动搅拌器、温度计、导气管及回流冷凝管的四口烧瓶中加入一定量的鸡脂、硼酸盐缓冲液及脂肪氧合酶粗酶液,通入压缩空气,反应一定时间后,取上层鸡脂,测定其过氧化值。
1.3.3 酶活测定方法[13,16]
酶活定义:在25℃,pH值为9.0,以亚油酸为反应底物,以1min内3mL反应体系在波长234nm处的吸光度增加0.001作为一个酶活力单位。
底物配制:在10mLpH值为9的硼酸盐缓冲液(0.2mol/L)中,加入0.25mL吐温-20,混合均匀,再逐滴加入0.27mL亚油酸,充分混合。加入1mol/L氢氧化钠溶液使体系澄清,用1mol/L盐酸溶液调节pH值至9,然后将该溶液稀释至500mL。
分光光度法测定吸光度:取0.2mL粗酶液(已稀释一定倍数)移入25℃,1.5mL的底物溶液中,混合均匀后于25℃的恒温水浴中保温3min。用5mL无水乙醇终止反应,加入5mL蒸馏水,混合均匀后于波长234nm处测定反应液吸光度值。空白为0.2mL粗酶液中加入5mL无水乙醇,再加1.5mL底物溶液,于25℃保温3min,然后加入5mL蒸馏水。
1.3.4 过氧化值测定方法
过氧化值测定方法参见国家标准GB/T5538—2005《动植物油脂过氧化值测定》。
2 结果与分析
2.1 时间对氧化反应的影响
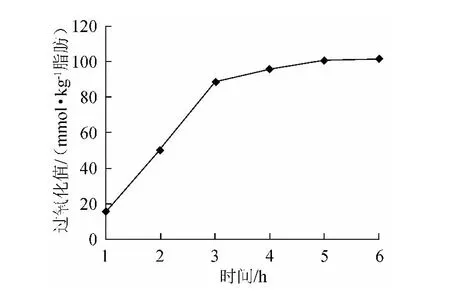
图1 反应时间对氧化反应的影响Fig 1 Effect of reaction time on the oxidation reaction
由图1可知,过氧化值随着反应时间的延长而增加,于5h后趋于平缓,因此5h为较合适的反应时间。反应开始初期,反应时间越长,氧化反应进行的越充分,当反应完全之后,随着时间的增加,过氧化值不再变化。
2.2 温度对氧化反应的影响
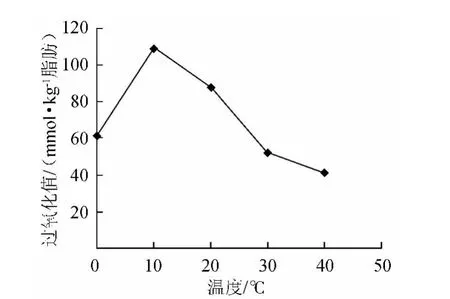
图2 反应温度对氧化反应的影响Fig.2 Effect of reaction temperature on the oxidation reaction
由图2可知,脂质的过氧化值随着温度的降低而降低,说明大豆脂肪氧合酶在较低温度下反应活性较高,而温度太低时脂肪凝固,不易反应进行,故低于10℃时,过氧化值较低,10℃时,过氧化值最高,故宜选取10℃作为反应温度。
2.3 底物浓度对氧化反应的影响
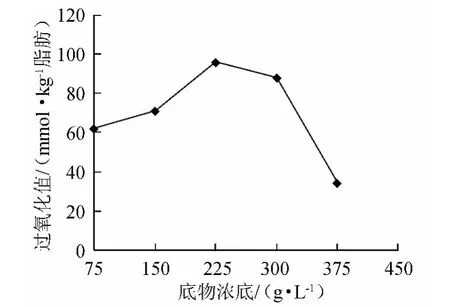
图3 底物浓度对氧化反应的影响Fig.3 Effect of substrate concentration on the oxidation reaction
由图3可知,随着底物质量浓度的增加,过氧化值也呈增加的趋势,当底物质量浓度约为225g/L时,氧化产物的过氧化值最高。因为随着底物质量浓度的增加,传质面积增大,反应进行的更加完全。当底物质量浓度继续增大时,可能对反应产生了抑制作用,过氧化值随之降低。故底物质量浓度为225g/L时为反应较好的选择。
2.4 pH值对氧化反应的影响

图4 pH值对氧化反应的影响Fig.4 Effect of pH value on the oxidation reaction
由图4可知,随着pH值的增大,产物过氧化值增加,当pH值为9时,氧化产物的过氧化值最高,之后随着pH值得增大,过氧化值下降。故pH值为9为反应的较佳选择。
2.5 空气流速对氧化反应的影响
由图5可知,空气流速为0.2m3/h时,反应产物的过氧化值最大。故空气流速为0.2m3/h为反应的较佳选择。
2.6 脂肪氧化反应条件优化
以氧化反应时间、反应温度、底物浓度,pH值及空气流速5个因素设计正交试验,以确定酶催化脂肪氧化的最佳反应条件。正交试验因素水平见表1,正交试验结果与分析见表2,方差分析见表3。
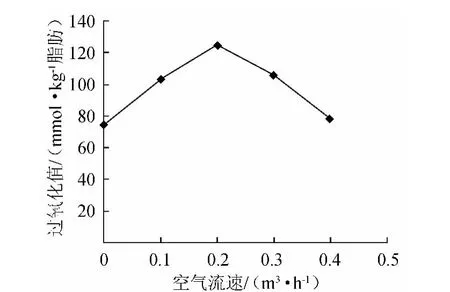
图5 空气流速对氧化反应的影响Fig.5 Effect of air velocity on the oxidation reaction
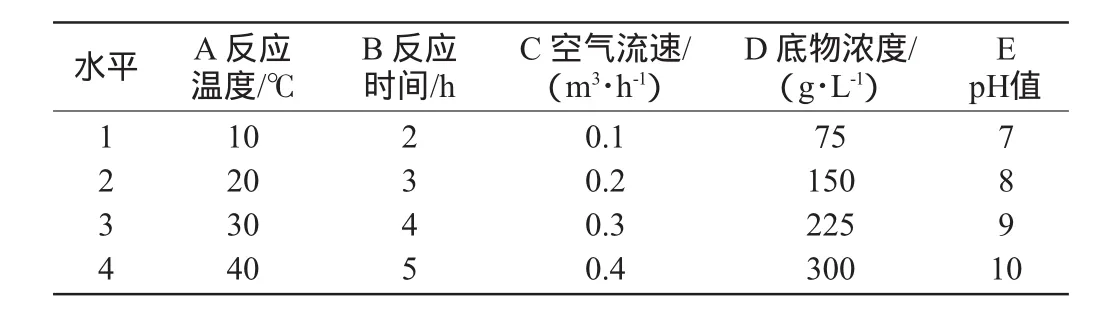
表1 氧化反应条件优化正交实验因素与水平Table 1 Factors and levels of orthogonal experiments for oxidation reaction condition optimization

表2 氧化反应条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for oxidation reaction condition optimization

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2可知,5个因素对氧化反应的影响顺序是:反应温度>底物浓度>反应时间>pH值>空气流速。其中氧化温度是最重要的影响因素。由表3可知,A和D因素的F比均大于1,说明这两个因素对试验结果影响较为显著,是主要影响因素,B、C、E因素为次要影响因素。综合分析,得到较高过氧化值氧化产物的最优氧化反应条件组合为A1B4C2D3E3,即反应温度10℃,反应时间5h,底物浓度225g/L,pH值为9,空气流速0.2m3/h。经3次验证度验结果表明,在此最佳条件下,反应产物过氧化值可达180mmol/kg脂肪。
3 结论
单因素及正交试验的结果表明,氧化温度对反应的结果影响最大,空气流速对反应结果的影响最小,获得较高过氧化值的最优氧化反应条件为反应温度10℃,反应时间5h,底物浓度225g/L,pH值9,空气流速0.2m3/h,在此最佳条件下,最高过氧化值可达180mmol/kg脂肪。
[1]MOTTRAM DS.Flavour formation in meat and meat products:a review[J].Food Chem,1998,62(4):415-424.
[2]JAYASENA DD,AHND U,NAM KC,et al.Flavour chemistry of chicken meat:a review[J].Asian Austral J Anim Sci,2013,26(5):732-742.
[3]ZAMORA R,HIDALGOF J.The Maillard reaction and lipid oxidation[J].Lipid Technol,2011,23(3):59-62.
[4]李 耀.浅谈鸡肉风味物质的形成机理[J].食品工业科技,2011,32(3):446-452.
[5]陈海燕,姜 梅.美拉德反应及其在咸味香精生产中的应用[J].中国调味品,2008(10):38-41.
[6]肖朝耿,唐宏刚,陈黎宏.美拉德反应制备天然鸡肉风味调料的研究[J].浙江农业学报,2012,24(3):499-502.
[7]杨桂敏,谢建春,孙宝国.以酶催化氧化油脂的方法制备想味料的研究进展[J].食品科技,2006,31(10):176-180.
[8]ELMORE JS,CAMPO MM,ENSER M,et al.Effect of lipid composition on meat-like model systems containing cysteine,ribose and polyunsaturated fatty acids[J].Agric Food Chem,2002,50(5):1126-1132.
[9]谢建春,孙宝国,刘晶鑫.氧化及未氧化脂肪对半胱氨酸-核糖体系热反应肉香味形成的影响[J].食品与发酵工业,2009,35(3):1-5.
[10]GLIABERT MP,CARMONA FG.Chromatographic analysis of lipoxygenase products[J].Anal Chim Acta,2002,465(1-2):319-335.
[11]蔡 锟,方 云,夏咏梅.植物脂肪氧合酶的研究进展[J].现代化工,2003(增刊 2):23-27.
[12]REDDANNA P,WHELAN J,MADDIPATI KR,et al.Purification of arachidonate 5-lipoxygenase from potato tubers[J].Method Enzymol,1990,187(29):268-277.
[13]蔡 琨.大豆脂肪氧合酶的提取及影响酶活因素的研究 [J].林产化学与工业,2004,24(2):52-56.
[14]陈书婷,孔祥珍,华欲飞,等.大豆脂肪氧合酶的分离纯化及其性质研究[J].食品工业科技,2011,32(5):176-177.
[15]AL-OBAIDYH M,SIDDOIA M.Properties of faba bean lipoxygenase[J].J Food Sci,1981,46(2):622-625.
[16]钟 秋,谢建春,孙宝国,等.“酶催化氧化鸡脂-热反应”制备鸡肉香味[J].中国食品学报,2010,10(4):124-129.
