一株产β-葡萄糖苷酶黑曲霉菌株的分离筛选
2013-09-22刘德海解复红权淑静刘金刚
刘德海,解复红,贾 彬,权淑静,马 焕,刘金刚
(1.河南省科学院 生物研究所有限责任公司,河南 郑州 450008;2.河南省工业酶工程技术研究中心,河南 郑州 450008;3.河南农业大学 生命科学学院,河南 郑州 450002)
β-葡萄糖苷酶亦称纤维二糖酶,能够水解β-D-葡萄糖苷键。β-葡萄糖苷酶在食品工业很多方面得到应用,可作为特殊的风味酶应用于改良果汁风味[1]、果酒增香[2]、茶叶增香等方面[3],能起到较好的增香效果。β-葡萄糖苷酶还可应用于生产大豆异黄酮活性苷元[4],其能使大豆异黄酮苷等生物苷类物质脱去糖基,变成分子量较小的高生物活性苷元,进而提高生物利用率。据报道,豆奶中添加β-葡萄糖苷酶或接种产β-葡萄糖苷酶的微生物,都能够将豆奶及豆奶粉中生物有效性较低的异黄酮糖苷化合物高效转化为高活性的异黄酮苷[5]。此外,利用β-葡萄糖苷酶法生产的龙胆低聚糖可预防食品中的淀粉老化和保持食品中的水分,具有增味作用和显著的保健功能,这种酶法生产龙胆低聚糖具有反应条件温和、菌种安全、污染性小、成本低廉、易于分离等优点,是生产龙胆低聚糖的主要研究方向[6]。
β-葡萄糖苷酶广泛存在于自然界各种微生物中,在一些动植物体内也有分布,在微生物来源方面,主要研究集中在酵母、细菌、霉菌等,而其中对曲霉和康氏木霉研究较多[7]。黑曲霉不产生毒素,是公认的安全微生物[8],且产胞外β-葡萄糖苷酶。本研究从酿造公司酿造砖曲中分离、筛选得到一株能高效生产β-葡萄糖苷酶的菌株,经菌株形态观察和分子生物学鉴定将该菌株初步鉴定为黑曲霉菌(Aspergillus niger)。1材料与方法
1.1 材料与试剂
酿造砖曲,河南省伏陈醋业有限公司提供。
TaqDNA聚合酶、dNTP购于宝生物工程大连有限公司;Marker、DL2000购于上海莱枫生物科技有限公司;Tris平衡酚购于北京索宝莱科技有限公司;水杨苷购于北京博奥拓科技有限公司;纤维二糖购于美国Amresco公司;羧甲基纤维素钠购于美国Sigma公司产品;3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)购于军事医学科学院药材供应站;链霉素购于北京索莱宝科技有限公司。
1.2 仪器与设备
QYC-2102C全温培养摇床:上海福玛实验设备有限公司;PHSJ-3F酸度计:瑞士Mettler Toledo公司;DRP-9052型电热恒温培养箱:上海森信实验仪器有限公司;T6新世纪紫外可见光分光光度计:北京普析通用仪器有限责任公司;TGL-16B离心机:上海安亭科学仪器厂;DYY-6C电泳仪:北京市六一仪器厂;SW-CT-ICU超净工作台:上海博讯实业有限公司;UPWS超纯水器:杭州永洁达净化科技有限公司;YP2102电子天平:上海光正医疗仪器有限公司。
1.3 培养基
1.3.1 菌株保藏培养基
Czapek’s琼脂培养基:NaNO33.0g,KCl0.5g,FeSO4·7H2O 0.01g,K2HPO41.0g,MgSO4·7H2O0.5g,蔗糖30.0g,琼脂15.0g,蒸馏水1000mL,pH6.0~6.5。
1.3.2 菌株活化培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取洗净去皮、挖去芽眼的马铃薯200g,切成片状或丝状,加水1000mL,煮沸15min,用纱布过滤,加20g琼脂、20g葡萄糖,再加热使其溶化,补水至体积为1000mL。
1.3.3 富集培养基
酵母膏5.0g,蛋白胨10.0g,NaCl 10.0g,蒸馏水1000mL,pH7.0,加入适量链霉素(含链霉素30U/mL)。
1.3.4 纤维二糖固体平板分离培养基[9]
(NH4)2SO44.0g ,NaCl 2.0g,CaCO34.0g,KH2PO41.0g,纤维二糖5.0g,琼脂15.0g,蒸馏水1000mL,加入适量链霉素。
1.3.5 纤维素-刚果红平板分离固体培养基
CMC-Na 2.0g,(NH4)2SO42.0g,MgSO4·7H2O 0.5g,琼脂15.0g,蒸馏水1000mL,pH值7.0,链霉素适量。
1.3.6 液体摇瓶发酵产酶培养基
麸皮3g,NH4NO30.5g,KH2PO40.3g,MgSO4·7H2O0.04g,CaCl20.05g,FeSO4·7H2O 0.5g,蒸馏水100mL。
1.4 实验方法
1.4.1 菌种分离纯化方法
多点取样四分法处理后,无菌操作条件下称取酿造砖曲样品适量,使之悬浮在无菌水中,振荡10min~15min,然后加入盛有富集培养基的三角瓶中,30℃、180r/min摇床培养3d左右。培养好的富集培养液1.0mL分别稀释至10-1、10-2、10-3、10-4、10-5、10-6,分别吸取10-4、10-5和10-6稀释度的稀释液0.1mL,于菌株活化培养基平板上,立即用无菌玻璃刮板进行平板涂布,然后倒置在恒温培养箱中进行培养,于28℃~30℃培养3d~5d左右,挑取长势较好的真菌菌落采用平板划线分离法重复以上操作,直至平板上出现单菌落,转接入菌株固体斜面保藏培养基培养3d,4℃保藏备用。
1.4.2 菌株的筛选[9]
选取上述分离纯化后所得的菌株,用无菌水洗下斜面真菌菌落孢子,适当稀释后混合置于纤维二糖固体分离培养基平板上,于28℃~30℃培养,待长出菌落后,再转接于纤维素-刚果红平板分离固体培养基平板上,于28℃~30℃培养3d~5d左右,观察有无透明圈及透明圈大小,挑取能够在纤维二糖固体分离培养基平板上生长,且在纤维素-刚果红平板分离固体培养基平板上有明显透明圈的菌种,转接入液体摇瓶发酵产酶培养基进行产酶实验复筛,培养条件为30℃,180r/min的摇床培养3d后,进行β-葡萄糖苷酶酶活力检测分析。
1.4.3 形态学观察[10]
将所分离菌株在PDA培养基上适当稀释后培养,获得单菌落,观察其菌落形态;并利用显微镜观察菌丝的特征。
1.4.4 分子生物学鉴定
(1)真菌总DNA的提取[11]
真菌总DNA的提取采用溴化十六烷基三甲铵(cetyltrimethyl ammonium bromide,CTAB)法,具体步骤如下:①用无菌解剖刀从培养皿中刮取菌丝0.1g~0.2g至1.5mL离心管中;②加入等体积的灭菌石英砂和200μL、65℃浴热后的2%CTAB抽提液(CTAB 4g,无水乙醇5mL,蒸馏水100mL,加热溶解,依次加入56mL的5mol/L NaCl、20mL的1mol/L pH 8.0的Tris-HCl、8mL的0.5mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),用蒸馏水定容至200mL摇匀,经高压灭菌,冷却后加入2mL的1%2-巯基乙醇,4℃保存),用无菌研磨棒研磨至匀浆;③加入400μL、65℃预热的CTAB抽提液,颠倒混匀后于65℃水浴0.5h~1.0h;④冷却至室温后,12000r/min离心10min,取上清液至另一离心管中;⑤加入1/2体积的Tris饱和酚(pH 8.0)及1/2体积的氯仿∶异戊醇(24∶1),颠倒混匀后静置至其开始分层;⑥12000r/min离心10min,取其上清液至另一离心管中;⑦重复5~6步2~3次,视两相界面处杂质的多少而定;⑧加入等体积的氯仿∶异戊醇(24∶1),轻轻颠倒混匀;12000r/min离心10min,取上清液至另一离心管中;⑨向上清液中加入等体积的异丙醇,轻轻颠倒混匀后于-4℃或-20℃沉淀1h;12000r/min离心10min,弃上清液,加入500μL、70%vol乙醇悬浮沉淀;⑩12000r/min离心5min,弃上清液,室温干燥;加50μL无菌水或TE(10mmol/L Tris-HCl 1mmol/L EDTA)缓冲液溶解沉淀,-20℃储存备用。
(2)18S rDNA基因的PCR扩增
在50μL PCR反应体系中依次加入以下试剂:双蒸水(dd H2O)37.0μL;10×扩增缓冲液5.0μL;d NTP 2μL;上游引物2μL;下游引物2μL;TaqDNA聚合酶0.6μL;提取的真菌模板基因组DNA 2μL,反应总体积为50μL。
扩增18S rDNA基因的引物片段为北京六合华大基因公司提供的通用真菌引物,上游引物ITS1:5’-TCCGTAGG TGAA CCTG CGG-3’和下游引物ITS4:5’-TCCT CCGC TTAT TGAT ATGC-3’。
PCR扩增条件:94℃预变性4min,94℃预变性30s,56℃预退火30s,72℃预延伸60s,30个循环,72℃预延伸10min。
PCR扩增产物电泳分析:PCR反应结束后,取6μL扩增产物进行1%的琼脂糖凝胶电泳检测,所用电压170V,电泳时间30min,加溴化乙锭(ethidium bromide,EB)染色15min后,用清水洗脱,然后置于BIO-RAD凝胶成像系统下观察其电泳条带。
(3)测序及序列分析
18S rDNA基因的PCR扩增产物经检测出现明显电泳条带后,送北京六合华大基因科技股份有限公司进行测序,将测序结果基因序列提交到GenBank核酸序列数据库中与已有的相关同源序列BALST比对分析,Clustal W程序进行多序列比对后,利用MEGA 3.1构建系统发育树。
1.4.5β-葡萄糖苷酶活力的测定方法[12]
β-葡萄糖苷酶活力的测定采用DNS法:取一支25mL的比色管,加入1.0mL 1%的水杨酸溶液(pH值为4.8的乙酸-乙酸钠缓冲液配制),于50℃水浴中热2min~3min,加入适当稀释酶液(发酵酶液12000r/min离心10min,取上清液)1.0mL,50℃保温30min,反应结束后立即取出加入3.0mL 3,5-二硝基水杨酸溶液,沸水浴煮沸5min显色冷却后定容至25mL,于波长530nm处测定OD值。另取一支比色管加入1%水杨酸溶液1.0mL,先加入3,5-二硝基水杨酸溶液3.0mL,再加灭活酶液1.0mL,作为空白对照,操作同上。
酶活力定义:在上述反应条件下,以1min内催化底物水解生成1μg还原糖(葡萄糖)所需的酶量定义为一个酶活力单位(U)。
2 结果与分析
2.1 分离筛选结果
对不同的真菌菌株进行分离纯化,共得到33支菌株斜面。经纤维二糖固体分离培养基平板与纤维素-刚果红平板分离固体培养基平板培养初筛,得到9株既能在纤维二糖固体分离培养基平板上生长且在纤维素-刚果红平板分离固体培养基平板上有明显透明圈的菌株。再经液体摇瓶发酵产酶培养基进行产酶实验,获得3株有较好β-葡萄糖苷酶生产能力的菌株,然后经发酵和多次传代,发现R16菌株稳定性较好,其遗传稳定性见图1,确定该菌株进行实验。R16菌株在纤维素-刚果红平板上产生的水解圈见图2。
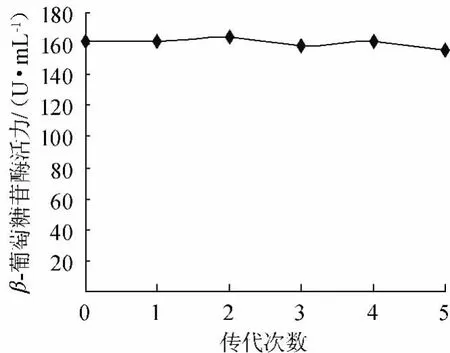
图1 菌株R16遗传稳定性Fig.1 Genetic stability of strain R16

图2 R16菌株在纤维素-刚果红平板上的水解圈Fig.2 Hydrolysis circle of R16 on CMC plate
2.2 菌株R16的形态特征
菌株R16在Czapek’s琼脂培养基上培养3d后,直径达1.5cm~3.0cm,其形态特征见图3。在菌落中心初为白色菌丝绒毛状凸起,随着培养时间的延长逐渐成浅黄色,最后变成褐黑色,产生大量褐黑色孢子,呈厚绒状,色泽均一,无杂色,菌落不透明,无光泽,无渗出物,边缘不整齐可见少量白色丝状菌丝,背面与培养基结合紧密,无色,不分泌色素,有放射状饰纹。
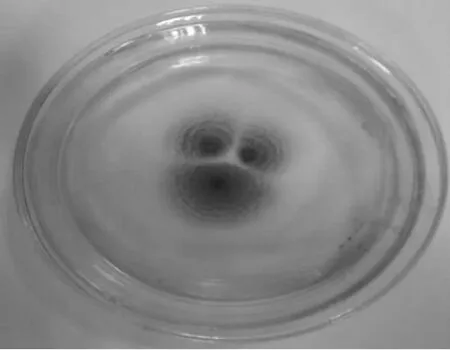
图3 R16菌株的菌落形态Fig.3 Colonial morphology of strain R16
菌株R16在高倍镜下的形态见图4。菌丝透明,有分支和横隔,有足细胞,分生孢子呈球形或接近球形,呈褐色,分生孢子头的顶囊呈球形或接近球形,分生孢子着生于分生孢子梗顶囊表面。从菌落、菌丝及孢子形态观察可以看出,根据魏景超[10]《真菌鉴定手册》及相关文献有关报道,初步将菌株R16鉴定为黑曲霉菌(Aspergillus niger)。
2.3 菌株R16的分子生物学鉴定
2.3.1 菌株R16的18S rDNA基因的获得
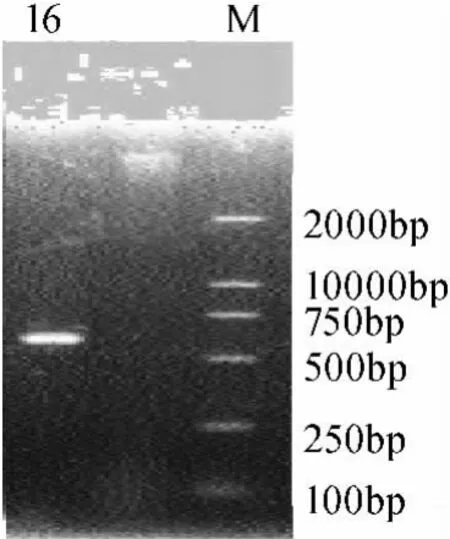
图5 R16菌株18S rDNA的PCR电泳结果Fig.5 Electtrophresis PCR amplification ITS sequence from strain R16
用ITS1、ITS4真菌通用引物,以提取的该菌基因组为模板进行PCR扩增,PCR产物经琼脂糖凝胶电泳检测的条带在500bp~700bp,结果见图5。
2.3.2 菌株R16的18S rDNA的序列分析
测序后,对得到的序列图谱进行分析,从图谱中可以看出测序结果没有杂峰和套峰,说明测序结果真实可靠,去除载体引物序列拼接处理后,得到完整的18S rDNA的基因序列,其测序序列片段长度为572bp,具体序列见表1。

表1 R16菌株18S rDNA序列Table 1 18S rDNA gene sequence of strain R16
2.3.3 R16菌株18S rDNA基因系统进化树
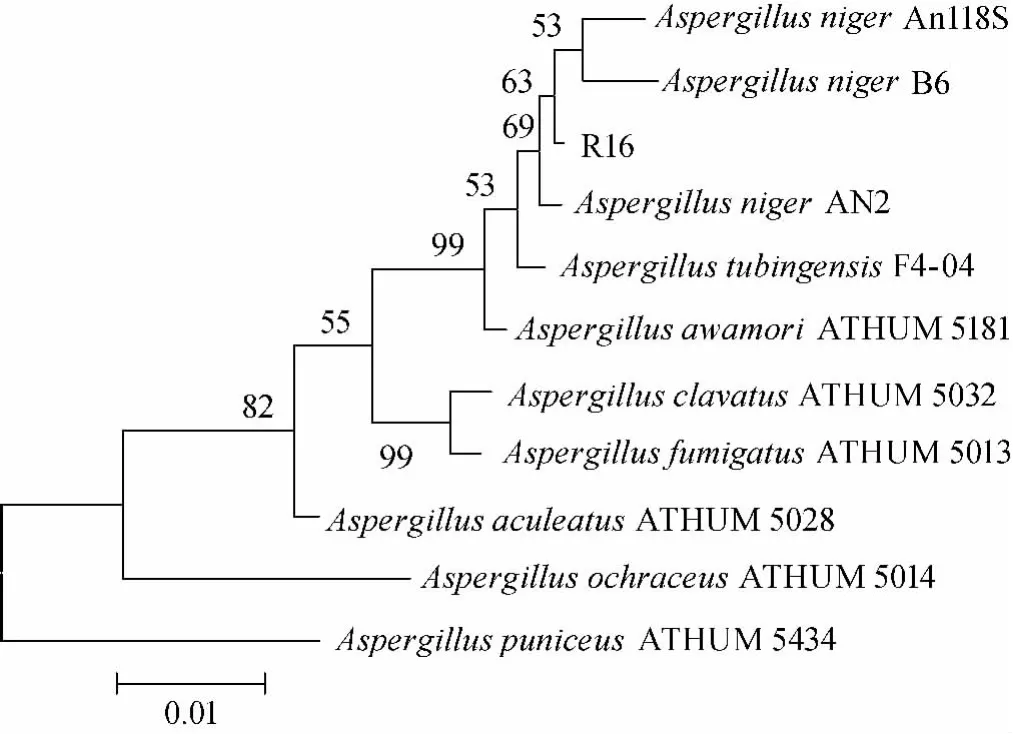
图6 菌株R16的系统发育树Fig.6 Phylogenetic tree of strain R16
将测序结果基因序列提交到GenBank核酸序列数据库中与已有的相关同源序列BALST比对分析,结果表明,R16菌株18S rDNA基因序列与GenBank中已有的黑曲霉菌(Aspergillus niger)相似性都在99%,亲缘关系最近,并在18S rDNA基因序列同源性基础上构建系统发育树,见图6。结合R16菌株形态特征观察,表明该菌株为黑曲霉属(Aspergillus)黑曲霉菌(Aspergillus niger)。
3 结论
酿造用曲中含有多种有益微生物,方春玉等[13]从泸型大曲分离出黑曲霉菌进行了酸性蛋白酶产酶研究,秦臻等[14]从保宁麸醋醋曲中定向筛选出生淀粉分解酶梨头霉进行了产酶研究,李江华等[15]从酒曲中分离筛选出一株真菌α-淀粉酶产生菌米曲霉进行了研究。
利用纤维二糖固体平板分离培养基、纤维素-刚果红平板分离固体培养基初筛,液体发酵产酶培养基摇瓶复筛相结合,从酿造砖曲中分离筛选出一株能高效生产β-葡萄糖苷酶的菌株R16。通过菌株菌落的形态特征、显微形态,及菌株18S rDNA的序列同源性和系统发育分子生物学分析,鉴定为黑曲霉属(Aspergillus)黑曲霉菌(Aspergillus niger)。该菌株遗传稳定性好,其产生的β-葡萄糖苷酶安全性好,具有较高的研究应用价值。
[1]孙爱东,葛毅强,倪元颖,等.不同来源的增香酶酶解橙汁(皮)中键合态主要芳香物质的效果分析[J].食品与发酵工业,2001,27(11):1-4.
[2]潘利华,罗建平.β-葡萄糖苷酶的研究及应用进展[J].食品科学,2006,27(12):803-806.
[3]王 力,林 智,吕海鹏,等.茶叶香气影响因子的研究进展[J].食品科学,2010 31(15):293-298.
[4]邓 媛,汪大敏,杨国武,等.自筛β-葡萄糖苷酶高产菌-N1制备大豆异黄酮苷元的研究[J].中国食品添加剂,2010(3):139-142.
[5]徐茂军.β-葡萄糖苷酶对豆奶及豆奶粉中大豆异黄酮糖苷化合物的转化作用研究[J].中国食品学报,2005,5(4):28-33.
[6]刘玲玲,朱 松,朱 婷,等.重组β-葡萄糖苷酶生产龙胆低聚糖的工艺条件优化[J].微生物学报,2009,49(5):597-602.
[7]石彩蕊,王义强,陈介南,等.产β-葡萄糖苷酶微生物育种研究进展[J].生物技术通报,2011(3):59-65.
[8]闫会平,陈士华,吴 兴.黑曲霉β-葡萄糖苷酶的研究进展[J].纤维素科学与技术,2007,15(1):59-63.
[9]张冬冬,刘新育,徐新慧,等.β-葡萄糖苷酶高产菌株的筛选及其性质研究[J].河南农业大学学报,2012,46(2):173-176.
[10]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979.
[11]陈国参,刘德海,解复红,等.一株产复合酶真菌菌株的筛选、鉴定及发酵产酶研究[J].中国酿造,2012,31(9):70-74.
[12]KARAFFA L,FEKETE E,GAMAUF C,et al.D-Galactose induces cellulase gene expression inHypocrea jecorinaat low growth rates[J].Microbiology,2006,152(6):1507-1514.
[13]方春玉,周 健,邓 静,等.泸型大曲黑曲霉产酸性蛋白酶条件的优化及其酶学性质的研究[J].食品与发酵科技,2011,47(2):13-17.
[14]秦 臻,蔡素梅,黄 钧,等.一株产生淀粉分解酶犁头霉的分离鉴定及其酶学性质[J].微生物学通报,2011,38(5):729-735.
[15]李江华,房 峻.真菌α-淀粉酶产生菌的筛选及其固态发酵条件的初步研究[J].食品科学,2007,28(11):373-378.
