红小豆粉液化及糖化条件研究
2013-09-22孟芮羽杜双奎
胡 静,孟芮羽,张 盈,孙 琳,杜双奎*
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
红小豆(Vigna angularis)为豆科植物赤豆的种子,外被赤褐色或红色外衣包裹,又名赤小豆、红豆。因其富含淀粉,可为人类提供膳食能量,所以又称之为“饭豆”。红小豆,全国各地都有栽培,每年产量为20~40万t,主要分布于华北、东北地区,南方部分地区也有少量种植[1]。据报道,每100g红小豆中除含有糖类58.5g、蛋白质20.0g、脂肪0.5g、粗纤维4.9g以及微量元素外,还含有色素、三菇皂甙、植物甾醇等有效成分。国内外研究表明,红小豆具有补脾、补血、生津、益气、益肾、补肝等保健功能,在糖尿病、肿瘤等疾病的预防和控制方面具有一定的作用[2-4]。红小豆豆皮中含有的多酚类物质具有抗氧化作用[2]。红小豆除直接食用外,常加工成豆沙或豆馅[5],近年来也相继开发了红豆奶、红豆冰激淋、红豆酸奶等相关产品[6-7]。韩涛等[8]对红小豆种皮中红色素的理化性质进行研究,高群玉等[9-10]对红小豆淀粉理化特性研究,何梅等[11]对红小豆膳食纤维开展了研究,YOUSIF AM等[12]研究了贮藏对红小豆蛋白质和淀粉性质的影响。由此可见,对红小豆的加工利用、性质研究越来越深入,但涉及发酵研究鲜见报道。红小豆中含有丰富的淀粉,可经糊化、液化、糖化处理后成为可发酵性糖,从而为发酵微生物所用。本研究以红小豆为试验材料,对红小豆粉液化、糖化工序进行研究,探讨液化、糖化条件,以期为红小豆的深加工、红小豆发酵食品的开发奠定基础。
1 材料与方法
1.1 材料与试剂
红小豆:购于陕西杨陵大型超市,籽粒饱满,色泽正常,符合NY/T 599-2002。
DNS试剂(称取3.25g 3,5-二硝基水杨酸溶于少量蒸馏水中,移入500mL容量瓶,加2mol/L氢氧化钠溶液162.5mL,再加入22.5g丙三醇,摇匀,定容至500mL,贮存于棕色瓶放置7d后备用);α-淀粉酶(活力≥3700U/g)、糖化酶(活力≥100000 U/g):北京奥博星生物技术有限公司;HCl溶液、NaOH溶液等。
1.2 仪器与设备
UV-1200分光光度计:上海光谱仪器有限公司;SHA-C恒温振荡器:常州国华电器有限公司;KDC-40低速离心机:科大创新股份有限公司中佳分公司;S-3400N型扫描电子显微镜:株式会社日立制作所(HITACHI);MSP-1S型离子溅射仪:日本真空装置有限公司;FW100高速万能粉碎机:天津泰斯特仪器有限公司;DHG-9146A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 工艺流程
红小豆→粉碎→加水→糊化→液化→糖化
1.3.2 操作要点
(1)粉碎:将红小豆放入粉碎机中粉碎,过40目筛,收集红小豆粉备用。
(2)加水:取红小豆粉,按料水比1∶4(m∶v)加入蒸馏水,为红小豆淀粉的糊化做准备。
(3)糊化:将红小豆粉-水混合物沸水浴30min,使红小豆淀粉充分吸水膨胀,发生糊化,期间不断搅拌,有利于充分糊化。
(4)液化:液化是将淀粉水解成为可溶性的低聚糖或糊精的过程,液化效果的好坏直接影响后续的糖化作用。α-淀粉酶可以随机降解淀粉内的α-1,4糖苷键,使淀粉水解。按试验设计加入一定量的α-淀粉酶,控制试验温度、pH值,酶解30min,碘液显色为无色,表明液化完全。
(5)糖化:糖化是进一步将液化水解的产物水解成为小分子的糖的过程。糖化酶能催化水解α-1,6糖苷键,使淀粉水解更加彻底。在液化体系中加入一定量的糖化酶,在一定温度、pH值条件下,糖化20h,分析糖化效果。
1.3.3 液化工序单因素试验
以还原糖含量为试验指标,以α-淀粉酶添加量(0.005%~0.065%)、温度(40℃~80℃)、pH值(4~8)为试验因素设计单因素试验,分别研究液化条件对液化规律的影响,确定α-淀粉酶的酶解条件。
1.3.4 糖化工序单因素试验
以还原糖含量为试验指标,以糖化酶加量(0.1%~1.7%)、温度(50℃~80℃)、pH值(3~7)为试验因素设计单因素试验,分别研究糖化因素对糖化效果的影响,确定糖化酶的酶解条件。
1.3.5 还原糖测定
采用DNS法测定液化液、糖化液中的还原糖含量。取适量液化液、糖化液于离心管中,于3800r/min离心30min,取上清液采用DNS法测定还原糖含量。
1.3.6 微观结构观察
分别取少量红小豆粉、糖化残渣固定在扫描电子显微镜的样品台上,并进行喷金处理。经过短暂干燥后,用扫描电子显微镜观察并拍摄具有代表性的微观结构,以观察红小豆的水解情况。
2 结果与分析
2.1 红小豆液化条件的确定
2.1.1 α-淀粉酶加量对红小豆液化效果的影响
固定液化温度为60℃,pH值为5,设置α-淀粉酶添加量分别为0.005%、0.02%、0.035%、0.05%、0.065%(以红豆粉质量计),液化30min,α-淀粉酶加量对红小豆液化效果的影响见图1。

图1 α-淀粉酶添加量对红小豆液化效果的影响Fig.1 Effects of α-amylase amount on liquefaction of adzuki bean
由图1可以看出,随着α-淀粉酶添加量的增加,还原糖含量呈增加趋势。当α-淀粉酶添加量大于0.035%,还原糖含量增加趋于平缓。这可能是由于α-淀粉酶添加量达到0.035%时,α-淀粉酶与底物结合基本完全,致使还原糖含量基本保持不变。因此确定液化α-淀粉酶添加量为0.035%。
2.1.2 液化温度对红小豆液化效果的影响
控制α-淀粉酶添加量为0.035%,pH值为5,分别在40℃、50℃、60℃、70℃、80℃液化30min,液化温度对红小豆液化效果的影响见图2。

图2 温度对红小豆液化效果的影响Fig.2 Effects of temperature on liquefaction of adzuki bean
由图2可知,随着液化温度的升高,还原糖含量呈先逐渐增大后减小趋势,温度为60℃时,还原糖含量最大。这与所选用α-淀粉酶为中温生物酶有关。当温度超过60℃,α-淀粉酶的活性有所减弱,液化效果下降,还原糖含量逐渐减小。所以60℃为适宜的液化温度。
2.1.3 pH值对红小豆液化效果的影响
固定α-淀粉酶添加量为0.035%,温度为60℃,分别在pH值为4、5、6、7、8时液化30min,pH值对红小豆液化效果的影响见图3。
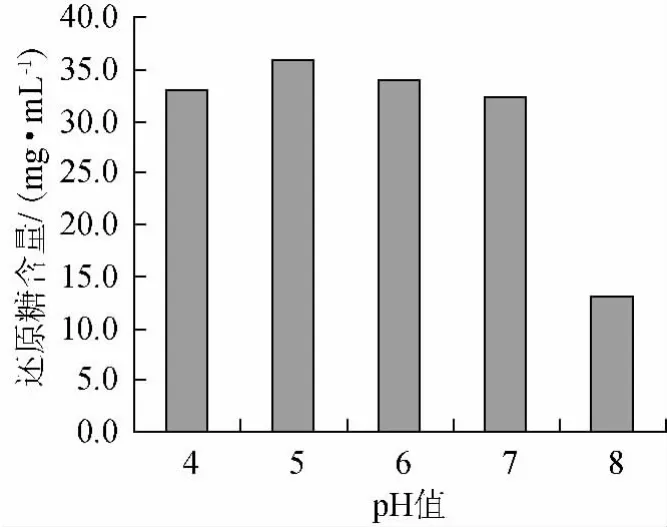
图3 pH值对红小豆液化效果的影响Fig.3 Effects of pH on liquefaction of adzuki bean
由图3可以看出,随着pH值的升高,还原糖含量有先增大后减小趋势。当pH值为5时,还原糖含量最高。这可能是由于随着pH值的增加,接近了α-淀粉酶的最适pH值,α-淀粉酶的活力逐渐增强,还原糖含量逐渐增加。随着pH值的继续增大,α-淀粉酶的活力越来越弱,作用力下降,还原糖含量逐渐减小。确定选取液化最适pH值为5。
2.2 红小豆糖化条件的确定
2.2.1 糖化酶添加量对红小豆糖化效果的影响
待液化完全后,按红豆粉质量分别添加0.1%、0.5%、0.9%、1.3%、1.7%(以红豆粉质量计)糖化酶,在60℃、pH 5的条件下糖化20h,以还原糖含量为指标,分析糖化酶添加量对红豆糖化效果的影响,结果见图4。
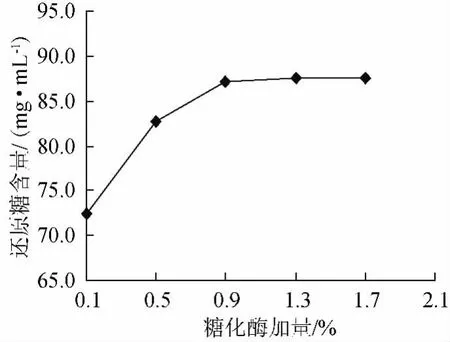
图4 糖化酶加量对红小豆糖化效果的影响Fig.4 Effects of glucoamylase amount on saccharification of adzuki bean
由图4可知,随着糖化酶加量的增加,还原糖含量呈不断增加趋势。当糖化酶添加量为0.9%时,还原糖含量最大。当糖化酶添加量超过0.9%,还原糖含量增加趋于平缓,表明糖化酶与底物已达到了饱和作用。确定糖化时的适宜加酶量为0.9%。
2.2.2 糖化温度对红小豆糖化效果的影响
控制糖化酶加量为0.9%,pH值为5,糖化温度分别设为50℃、60℃、70℃、80℃,糖化20h,试验结果见图5。

图5 糖化温度对红小豆糖化效果的影响Fig.5 Effects of temperature on saccharification of adzuki bean
由图5可以看出,糖化温度对还原糖含量有影响,随着温度的升高,还原糖含量有下降趋势,60℃时还原糖含量最高,表明糖化酶作用效果充分;70℃、80℃时还原糖含量明显下降,这可能与部分糖化酶失活有关。因此确定糖化时的最适温度为60℃。
2.2.3 pH值对红小豆糖化效果的影响
固定糖化酶加量为0.9%,温度为60℃糖化20h,pH值对红小豆糖化效果的影响见图6。

图6 pH对红小豆糖化效果的影响Fig.6 Effects of pH on saccharification of adzuki bean
由图6可知,随着糖化体系pH值升高,还原糖含量呈先增大后减小趋势。当pH值为4时,还原糖含量最大,但与pH值为3时的还原糖含量差异不显著,pH值为7时,还原糖含量最低。这与试验用糖化酶适宜作用pH值为3~5有关。选择pH值为4为最佳条件。
2.3 微观结构分析
对红小豆粉、糖化残渣进行电镜扫描观察,结果见图7。
由图7可以看出,红小豆粉中的粉状颗粒呈分散状态,淀粉颗粒比较完整,为圆形、肾形,由蛋白膜、纤维等包裹。糖化残渣中蛋白膜展开,体系成为絮状的团块结构,蛋白膜上有凹陷或空洞,这可能是淀粉颗粒原来所在位置,淀粉颗粒基本完全消失,表明淀粉颗粒基本水解完全。

图7 电镜扫描图片(400×)Fig.7 Scanning electron microscopy images
3 结论
通过对红豆粉液化与糖化条件单因素试验分析,红小豆粉液化时α-淀粉酶加量为0.035%,液化温度为60℃,pH值为5,液化30min还原糖含量为35.63mg/mL。其液化液在0.9%糖化酶、60℃、pH值为4时糖化20h,还原糖含量达87.10mg/mL,还原糖含量显著提高。对糖化残渣进行电镜扫描观察,红小豆淀粉已基本水解完全,为后续发酵的进行奠定良好的基础。
[1]艾启俊,赵 佳.即食红小豆粉的研制[J].北京农学院学报,2003,18(4):285-288.
[2]于章龙,段 欣,武晓娟,等.红小豆功能特性及产品开发研究现状[J].食品工业科技,2011(1):360-362.
[3]李新贵.浅谈红小豆的经济药用价值与加工综合利用[J].现代化农业,2005(7):19-22.
[4]NISHI S,SAITO Y,SOUMA C,et al.Suppression of serum cholesterol levels in mice by adzuki bean polyphenols[J].Food Sci Technol Res,2008,14(2):217-220.
[5]赵建京,范志红,周 威.红小豆保健功能研究进展[J].中国农业科技导报,2009,11(3):46-50.
[6]容元平,蒋世云,杨悦莹.红豆奶加工工艺和配方研究[J].广西工学院学报,2004(3):45-48.
[7]孔 青,代志强,周 伟,等.红豆酸奶的研制[J].中国酿造,2009,28(2):179-181.
[8]韩 涛,甘育新,李丽萍,等.红小豆种皮红色素的提取及其理化性质的研究[J].中国粮油学报,1997,12(6):58-61.
[9]高群玉,黄立新,张力田.红豆淀粉的性质[J].无锡轻工大学学报,2001,20(5):449-452.
[10]杜双奎,于修烛,问小强,等.红小豆淀粉理化性质研究[J].食品科学,2007,28(12):92-95.
[11]何 梅,杨月欣,王光亚,等.我国农村谷类和干豆类食物中膳食纤维含量的研究[J].中国粮油学报,2008,23(2):199-204.
[12]YOUSIF AM,BATEY IL,LARROQUE OR,et al.Effect of storage of bean(Vigna angularis)on starch and protein properties[J].LWT-Food Sci Technol,2003,36(6):601-607.
