锦州虾油小黄瓜中耐盐乳酸菌的生物性能研究
2013-09-22白凤翎刘邑娥吕欣然石金鑫励建荣
白凤翎,刘邑娥,马 驰,李 莹,吕欣然,石金鑫,励建荣
(渤海大学 化学化工与食品安全学院,辽宁省食品安全重点实验室“,食品贮藏加工及质量安全控制工程技术研究中心”辽宁省高校重大科技平台,辽宁 锦州 121013)
锦州虾油小黄瓜是由辽西地区特有的顶花带刺的小黄瓜用锦州地区特制的虾油腌渍而成,色泽碧绿、清脆爽口、气味荤香,是锦州小菜的特征品种。然而,由于虾油的盐含量过高致使产品的风味不足,口感欠佳,这也是锦州小菜市场化的最大障碍。在自然条件下,微生物的发酵作用对腌渍蔬菜产品的风味形成、质地改善等方面都具有非常重要的作用。乳酸菌发酵在保持蔬菜原料中原有的营养成分和形成风味物质的基础上,还赋予产品具有益生作用的生物学功效[1]。国外乳酸菌发酵蔬菜的主要代表是德国的酸白菜(Sauerkraut)、酸黄瓜(Sour cucumber)和韩国的泡菜(Kimchi),德国的酸黄瓜主要由肠膜明串珠菌(Leuconostoc mesenteroides),短乳杆菌(Lactobacillus brevis),植物乳杆菌(Lactobacillus plantarum)和戊糖片杆菌(Pediococcus pentosaceus)等多种乳酸菌共同发酵而成。韩国的泡菜中肠膜明串珠菌(Leuconostoc mesenteroides)是发酵过程中的优势乳酸菌菌群,对产品的品质起到了主要作用,此外还发现了新的乳酸菌类群[2]。目前从产品中获取优良的乳酸菌株,进行基因序列以及生物学特性研究[3-6]。国内应用乳酸菌改善发酵蔬菜的品质,武晋海等[7]以腌渍液作为发酵剂,结合植物乳杆菌(Lactobacillus plantarum)进行预发酵,获得了2.24%NaCl的低盐腌渍小黄瓜,使产品品质获得了良好的提升。李春等[8]应用纯菌接种恒温发酵黄瓜研究表明了人工接种乳酸菌可以改善产品品质。本文从锦州虾油腌渍小黄瓜中分离获得的6株耐盐乳酸菌,对其抗氧化和产生风味物质生物性能进行研究,旨在通过选育优良性能的乳酸菌作为发酵剂对锦州虾油小黄瓜进行品质改良,达到提高产品风味、降低产品盐度和增加产品功能的目的。
1 材料与方法
1.1 材料
1.1.1菌种
菌株L3、L4、L5、L7、L15、L16,自锦州虾油小黄瓜中分离,经形态学和生理生化初步鉴定,结果表明菌株L3、L4属于肠球菌属(Enterococcussp.),菌株L5、L7、L15、L16均属于乳杆菌属(Lactobacillussp.)[9]。
1.1.2 培养基与试剂
MRS培养基:葡萄糖10.0g,牛肉膏10.0g,蛋白胨10.0g,酵母膏5.0g,无水乙酸钠4.8g,柠檬酸二铵2.0g,K2HPO42.0g,MgSO40.58g,MnSO40.25g,蒸馏水1.0L,pH6.2~6.4,121℃高压灭菌15min。
1.1.3 仪器与设备
LDZX-40S型立式自控电热压力蒸汽灭菌器,上海申安医疗器械厂;BCM-1000A型生物洁净工作台,苏州市华宇净化设备有限公司;SHP-250型生化培养箱,上海精宏试验仪器有限公司;UV-4802紫外可见分光光度计,尤尼柯(上海)仪器有限公司;DELTA 320 pH计,梅特勒-托利多仪器(上海)有限公司。
1.1.4 数据处理
实验均平行测定3次,应用Excel2003对数据进行处理,用Origin8.0进行作图。
1.2 方法
1.2.1 菌体和胞外分泌物的制备
将供试菌于MRS培养基37℃培养24h后,发酵液以4000r/min离心20min,收集菌体,并用蒸馏水洗涤3次,最后将乳酸菌细胞数调至106cell/mL,即为菌体。
供试菌于MRS培养基37℃培养24h后,收集发酵液,用蒸馏水将乳酸菌细胞数调至1010cfu/mL,在4000r/min转速下离心20min,收集上清液,即为胞外分泌物。
1.2.2 耐盐乳酸菌抗氧化性能测定
清除羟自由基试验:参考文献[10]中的方法,按公式(1)计算羟自由基清除率。

式中:A为不含样品液含H2O2的吸光度值;A0为不含样品液和H2O2时溶液的吸光值;Ai为含样品液和H2O2的吸光度值。
清除DPPH自由基试验:按文献[11]方法略作修改。取1mL样品液,加入0.2mmol/L的DPPH无水乙醇溶液2mL,在517nm下测定吸光度值,按公式(2)计算DPPH自由基清除率。
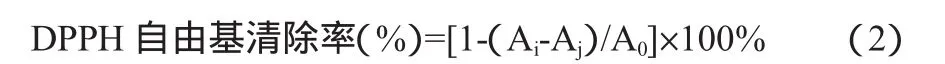
式中:Ai为DPPH和样品的吸光度值;Aj为乙醇和样品的吸光度值;A0为DPPH和乙醇的吸光度值。
还原能力测定:按文献[12]进行。
清除超氧阴离子自由基试验:在4.5mL的25℃水浴20min Tris-HCl缓冲液(PBS:0.05mol/L,pH8.2)中,加入4.4mL菌株样品液和0.1mL邻苯三酚溶液(25.0mmol/L),25℃水浴5min。然后加入1.0mLHCl(8.0mol/L),用10.0mmol/L HCl作空白,在325nm处测吸光度值。分别测定乳酸菌菌体、胞外分泌物,按公式(3)计算超氧阴离子自由基的清除率。

式中Ai为样品液的吸光度值;A0为生理盐水(空白)的吸光度值。
1.2.3 耐盐性乳酸菌风味物质测定
乙醛含量测定:按文献[13]中方法进行,将活化后的乳酸菌培养液在4℃下以4000r/min离心20min,收集上清为样品液,按公式(4)进行计算乙醛含量。

式中:V1为碘标准溶液用量;V2为空白试验碘标准溶液用量;M为碘标准溶液摩尔浓度。
双乙酰含量测定:按文献[14]的操作方法进行,按公式(5)计算双乙酰含量。
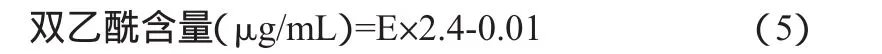
式中:E为吸光度值;2.4为吸光度值和双乙酰含量的换算关系;0.01为校正值。
2 结果与讨论
2.1 耐盐乳酸菌的抗氧化性能
2.1.1 乳酸菌的清除羟自由基性能
6株耐盐乳酸菌清除羟自由基的作用如图1所示,可以看出菌体对羟自由基的平均清除率为胞外分泌物的22倍,因此,对羟自由基的清除作用主要来自于具体本身。其中,菌株L7的清除作用最强,清除率达38.56%;其次是菌株L3,清除率超过30%,最差的为菌株L17。乳酸菌的抗氧化性能在菌体、菌体破碎物、发酵产物在自由基或过氧反应体系中,均表现出不同程度的抗氧化性能[15-17]。从锦州腌渍小黄瓜中耐盐乳酸菌的清除羟自由基能力主要表现在菌体,而不在其产物或发酵液中,说明是菌体内的氧化酶体系可能发挥主体作用。当菌体被破碎及产物中该酶体系被破坏,清除能力损失殆尽。
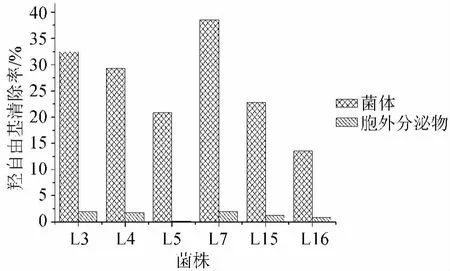
图1 6株耐盐乳酸菌对羟自由基的清除作用Fig.1 Scavenging effects of six salt-tolerance LAB strains on hydroxyl radical
2.1.2乳酸菌的清除DPPH自由基性能
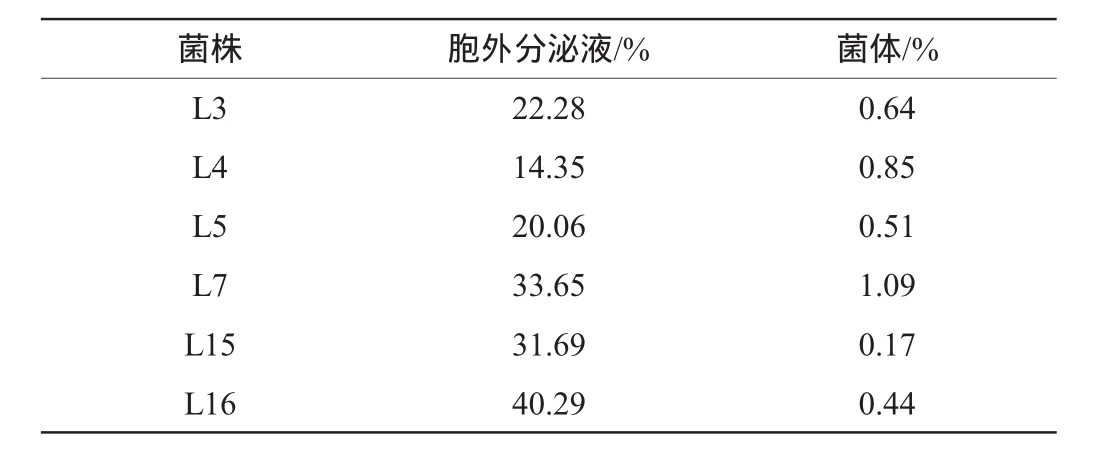
表1 6株乳酸菌对DPPH自由基的清除作用Table 1 Scavenging effects of six LAB strains on DPPH radical
6株耐盐乳酸菌清除DPPH自由基的作用由表1所示,从表1中可以看出乳酸菌胞外分泌物的清除作用明显强于菌体,其中菌株L16的胞外分泌物对DPPH自由基的作用最强,清除率达40%;其次是菌株L7,清除率为33.65%;其余菌株在14.3%到31.2%之间。这主要是因为菌体能产生有一些抗氧化酶和一些抗氧化物质,从而使得胞外分泌物的还原能力比菌体强[18]。
2.1.3 乳酸菌的还原性能
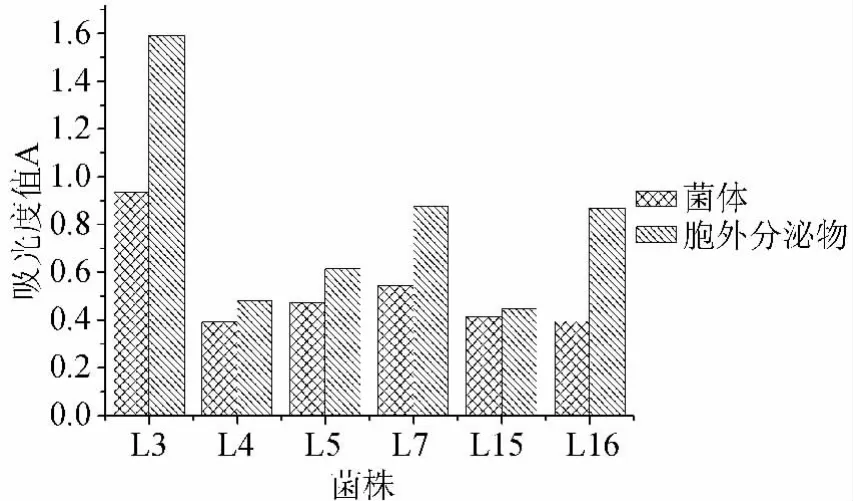
图2 6株耐盐乳酸菌的还原能力Fig.2 Results of reducing ability of six salt-tolerance LAB strains
由图2可知,6株乳酸菌菌体以及胞外分泌物均有较强还原能力,且它们的胞外分泌物的还原能力均较菌体的还原能力强。菌株胞外分泌物的还原能力试验所得吸光度值在0.449~1.591之间,还原能力最强的为菌株L3,其吸光度值为1.591;其次为菌株L7,吸光度值为0.875,最差的为菌株L15。
2.1.4 乳酸菌的清除超氧阴离子自由基性能
由图3可知,胞外分泌液和菌体对超氧阴离子都具有清除作用。与菌体比较而言,胞外分泌具有更强的清除作用。菌株中L7的作用最佳,清除率达36.63%,其他菌株的胞外分泌液清除率在10%~30%之间。
2.2 乳酸菌形成风味物质性能
乳酸菌形成乙醛和双乙酰两种风味物质的结果如表2所示,6株乳酸菌产生的乙醛含量较高,其中菌株L16产生的含量最高超过了5.5μg/mL;其次是菌株L7,产生的乙醛含量为5.02μg/mL;菌株L3、L4、L5、L15产生的乙醛含量相近,均在2.5~3.5μg/mL之间。而产生的双乙酰含量相对较低,产生最多的是菌株L7,含量为3.65μg/mL;其次是菌株L15;菌株L16的含量最少,几乎不产生。乙醛和双乙酰都是由乳酸菌在发酵过程中产生的醇、醛、酮等多种风味物质和乳酸菌在糖酵解过程中产生的乳酸、乙酸、丙酸等有机酸相互作用形成的,具有独特风味的物质[19]。
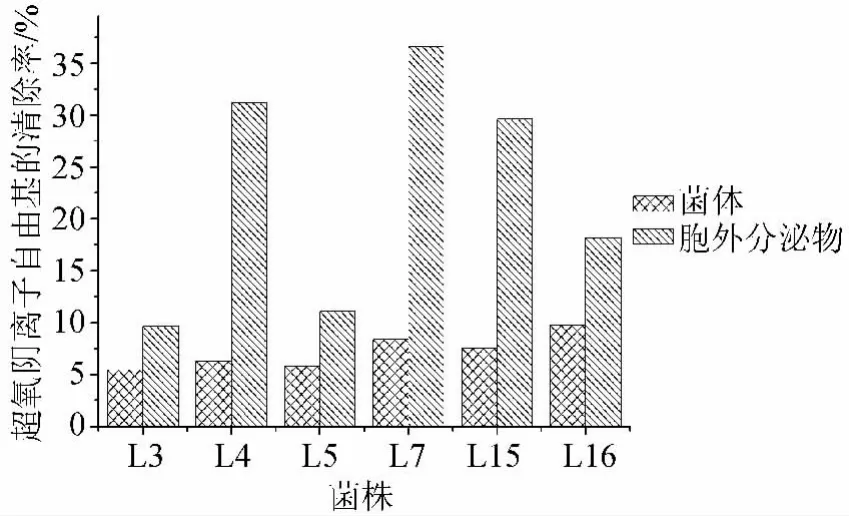
图3 6株乳酸菌对超氧阴离子自由基的清除作用Fig.3 Scavenging effects of six salt-tolerance LAB strains on superoxide anion free radical
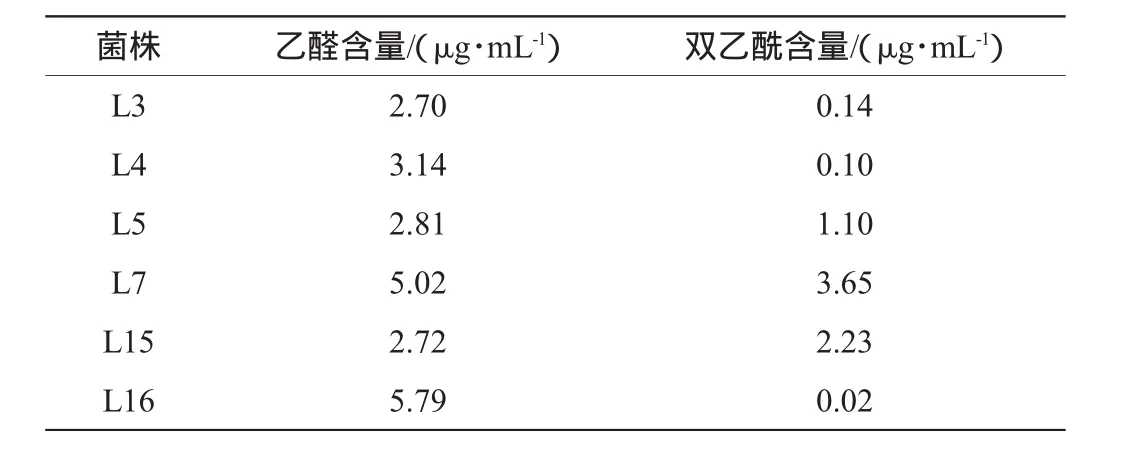
表2 6株乳酸菌乙醛和双乙酰测定结果Table 2 Determination results of acetaldehyde and diacetyl of six LAB strains
3 结论
从实验结果中可以看出,菌株L7对羟自由基的清除率为38.56%,DPPH自由基清除率为33.65%,还原能力较强,超氧阴离子清除率为36.65%;其中,除羟自由基的清除作用来自于菌体自身的抗氧化性能外,其余抗氧化能力均来自于乳酸菌胞外分泌物。与此同时,菌株L7还能产生含量较高的风味物质:乙醛和双乙酰的含量分别为5.02μg/mL和3.65μg/mL。因此,综合耐盐性乳酸菌菌株清除各种自由基和产生风味物质的性能,从中筛选出菌株L7作为改进锦州腌渍小黄瓜品质的试验菌株。
耐盐性乳酸菌是腌制蔬菜制品中的优势菌群,对产品的质量有着致关重要的影响。本实验从锦州传统风味食品虾油小黄瓜发酵液分离筛选出的6株具有较好耐盐性的乳酸菌中,得到生物性能较强的L7菌株。通过对耐盐性乳酸菌的性能研究筛选出优良菌株L7,旨在提高乳酸菌发酵性能,为提升锦州腌渍小菜产品质量、改善其风味以及降低含盐量提供理论基础。
[1]纪凤娣,籍保平,李 博,等.前期盐渍因子及后期调味配方对低温发酵蔬菜产品品质的影响[J].食品科学,2005,26(9):246-250.
[2]YOON JH,KANG SS,MHEEN TI,et al.Lactobacillus kimchiisp.nov.,a new species from kimchi[J].Int J Syst Evol Microb,2000,50:1789-1795.
[3]BREIDT FJR.A genomic study ofLeuconostoc mesenteroidesand the molecular ecology of sauerkraut fermentations[J].J Food Sci,2004,69(1):30-33.
[4]NAM SH,CHLI SH,KANG A,et al.Genome sequence ofLeuconostoc fallaxKCTC 3537[J].J Bacteriol,2011,193(2):588-589.
[5]LEE SH,JUNG JY,LEE SH,et al.Complete genome sequence ofLeuconostoc Kimchiistrain C2,isolated from kimchi[J].J Bacteriol,2011,193(19):5548.
[6]KIM DS,CHOI SH,KIM DW,et al.Genome sequence ofLeuconostoc gelidumKCTC 3527,isolated from kimchi[J].J Bacteriol,2011,193(3):799-800.
[7]武晋海,王昌禄,王玉荣.低盐腌渍黄瓜半固态纯种发酵工艺中试[J].农业工程学报,2009,25(1):265-270.
[8]李 春,张 毅,李琳琳,等.人工接菌黄瓜发酵过程中的品质变化[J].中国酿造,2006,25(7):59-61.
[9]曲玲童,牛文静,孙 征,等.锦州腌渍小菜中耐盐乳酸菌的筛选与产酸性能研究[J].中国酿造,2012,31(6):83-86.
[10]张江巍,曹郁生,李海星,等.乳酸菌抗氧化活性及检测条件[J].中国乳品工业,2005,33(9):53-56.
[11]IN MY,CHANG FJ.Antioxidative effect of intestinal bacteriaBifidobacterium longumATCC15708 andLactobacillusacidophilusATCC 4356[J].Digest Dis Sci,2000,45(8):1617-1622
[12]孙 涛,巢 骏,胸小英,等.C60-D-氨基葡萄糖衍生物的制备及其抗氧化性的研究[J].上海海洋大学学报,2010,19(3):404-409.
[13]刘 鹏,王 丹,任新宇,等.酸奶中乙醛含量测定方法的初步探讨[J].中国乳品工业,1992,20(4):151-154.
[14]王 丹,刘 鹏.酸奶中联乙酰含量测定方法的初步探讨[J].中国乳品工业,1992,20(4):60-62.
[15]LIN MY,YEN CL.Antioxidative ability of lactic acid bacteria[J].J Agric Food Chem,1999,47:1460-1466.
[16]LIN MY and YEN CL.Inhibition of lipid peroxidation byLactobacillus acidophilusandBifidobacterium longum[J].J Agric Food Chem,1999,47:3661-3664.
[17]KULLISAAR T,ZILMER M,MIKELSAAR M,et al.Two antioxidativeLactobacillusstrains as promising probiotics[J].Int J Food Microbiol,2002,72:215-224.
[18]邵 伟,仇 敏,熊 泽.酸豆奶中乳酸菌体外清除自由基能力比较[J].食品研究与开发,2007,128(12):159-161.
[19]丹 彤,包秋华,孟和毕力格,等.发酵乳风味物质乙醛、双乙酰的合成途径及其调控机制[J].食品科技,2012,37(7):75-79.
