羊蹄根对体外肝星状细胞增殖的影响
2013-09-21卢兴兵练正秋白莉莎
卢兴兵,练正秋,白莉莎
(成都市第三人民医院,成都 610031)
肝纤维化是所有慢性肝病进展成肝硬化的共同病理基础与必经阶段,是由炎性刺激导致肝星状细胞(hepatic stellate cells,HSCs)活化后,合成并分泌以胶原蛋白为主的细胞外基质(extracellular matrix,ECM)沉积于肝所致。HSCs活化是肝纤维化发生的细胞学基础,是各种病因肝纤维化发生的共同中心环节,一直是近年的研究热点。由于肝纤维化在进入肝硬化前尚可逆转,因此,开发有效的治疗肝纤维化的药物对预防慢性肝病的进一步发展十分重要[1,2]。羊蹄根为蓼科多年生草本植物羊蹄的干燥根,始见于《神农本草经》,经成分预试含蒽醌类、皂苷类、挥发油及油脂等类物质,其单味汤剂可治疗咯血、吐血和衄血,临床应用多为复方制剂[3]。本文旨在探讨羊蹄根对体外HSCs增殖的影响。
1 材料和方法
1.1 材料及仪器
DMEM培养基、DMSO和0.25%肝星状胰蛋白酶-EDTA(均购于美国Gibco公司),肝星状细胞株、胎牛血清(杭州四季青),MTT试剂(购于美国sigma);thermo细胞培养箱,奥林巴斯倒置相差显微镜;thermo加样器,(BIO-RAD company)酶标仪,细胞培养瓶、羊蹄根制剂(由吉林医药学院检验学院提供)。
1.2 实验方法
1.2.1 细胞培养及分组 将刚复苏的HSCs接种在含10%胎牛血清、100U/mL二抗溶液(终浓度为青霉素100U/mL,链霉素100U/mL)的DMEM完全培养基中,培养于5%CO237℃培养箱中。待细胞处于生长对数期并贴满整个瓶底时,0.25%胰酶消化后传代培养,调配细胞浓度为105/m并转移至96孔板,每孔100μL HSCs悬液。待细胞生长稳定后同步分为对照组和羊蹄根不同剂量组A1、A2、A3,每组10个平行孔。然后,更换无血清DMEM培养基饥饿培养8h后,每孔均加入10μL转化生长因子(TGF-β)于5%CO237℃条件下培养12h后,分别加入A1(1∶1 200)、A2(1∶1 800)和 A3(1∶2 400)3种不同浓度的羊蹄根溶液10μL诱导48h。
1.2.2 MTT检测细胞增殖 待细胞贴壁同步诱导48h后,每孔加入MTT 20μL培养4h后,弃上层培养基后每孔加入150μL DMSO液,置于振荡器上充分震荡10min,通过酶标仪570nm波长测取每孔吸光度(OD)值。计算药物对细胞增殖的抑制率IE(%)=(1-ODn/OD0)×100%,其中IE表示药物对细胞增殖抑制率,OD0表示对照组细胞的吸光度值,ODn表示某浓度下的吸光度值。
1.2.3 相差显微镜观察细胞形态学变化 在倒置相差显微镜下观察对照组、羊蹄根不同剂量组处理前后的细胞形态学变化。
1.3 统计学方法
采用SPSS 13.0软件进行单因素方差分析,两两比较用q检验,实验结果用均数±标准差(±s)表示,P<0.05为差异有统计学意义。
2 实验结果
2.1 MTT检测羊蹄根对HSCs的增殖情况
与对照组比较,羊蹄根组OD值显著下降(P<0.05),各剂量对HSCs的增殖均有显著抑制作用(P<0.05),并且高剂量组(A1)与中(A2)、低(A3)剂量组相比OD值差异有统计学意义(P<0.01),但中剂量组A2与低剂量组A3相比OD值之间差异无统计学意义(P>0.05),随着羊蹄根浓度的增加,HSCs增殖抑制率也逐渐升高,3组抑制率分别为69.36%、32.01%和29.14%(见表1)。
表1 羊蹄根对体外HSCs增殖的影响(±s)
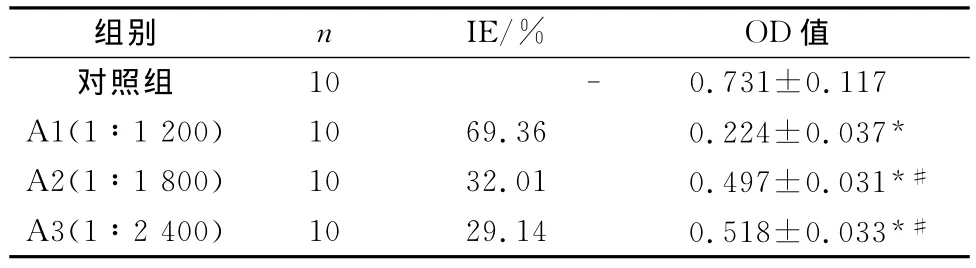
表1 羊蹄根对体外HSCs增殖的影响(±s)
与对照组相比,*P<0.05;与高剂量组A1相比,#P<0.01
组别 n IE/% OD值10 - 0.731±0.117 A1(1∶1 200) 10 69.36 0.224±0.037*A2(1∶1 800) 10 32.01 0.497±0.031*#A3(1∶2 400) 10 29.14 0.518±0.033*#对照组
2.2 羊蹄根对HSCs的细胞形态变化
经过复苏、传代后,HSCs体外生长稳定,镜下可见细胞典型星芒状及梭形,少数细胞间有伪足相互连接,偶见细胞融合成片,细胞结构轮廓清晰、可见胞核(见图1)。加入TGF-β刺激后,镜下可见细胞密度增加,细胞排列紊乱,细胞之间相互连接并大量融合,细胞轮廓模糊、胞内颗粒样物质增多,随着时间的推移,HSCs融合成片聚集、结构完全破坏,整个背景脏乱(见图2、3)。加入羊蹄根药物干预后,细胞形态发生了显著变化:细胞由典型的星形变成了椭圆形或梭形,细胞密度明显减少,细胞体积减小,细胞排列整齐、结构完整,细胞之间伪足连接少见,融合基本消失,随着羊蹄根浓度的增加,HSCs细胞形态呈现差异(见图4、5、6)。
3 讨论
目前,世界范围内每年约有0.5万~1.2万人因感染乙肝病毒而死亡[4]。我国是乙肝高发区,由于肝炎病毒早期临床表现及症状不明显,当就诊时却已经发展为慢性肝炎,加上地区医疗条件和自身的不重视而未得到及时有效的诊断治疗,在各种慢性肝病进展中,肝内纤维生成与降解失衡,导致过量的ECM在肝内沉积,最终肝细胞逐渐纤维化,严重时发展为肝硬化、肝癌[5],因此肝纤维化具有较高的致病率和病死率[6]。研究[7]表明肝纤维化是肝组织对慢性损伤的修复反应,是大多数慢性肝病共同的病理特征,目前多数学者认为肝纤维化进程可逆,预防和治疗肝纤维化是肝病防治的重要环节。HSCs活化是肝纤维化形成的重要因素之一,由于人肝纤维化细胞的获取困难,大鼠HSCs与人HSCs在生长习性、形态及结构上相似度很高,细胞株稳定性好,适合长期传代培养,加之在肝纤维化发生过程中,TGF-β起重要调节促进作用[8],通过加入 TGF-β来刺激HSCs活化合成大量的ECM,激活的HSCs自身也能合成、分泌TGF-β。为此,本组实验采用大鼠HSCs细胞株复苏、传代后,在TGF-β刺激下最终成为羊蹄根对HSCs增殖影响的理想细胞模型。目前,有关中药抗纤维化治疗的研究很多,也取得了一定成绩,但有关羊蹄根中药对抗纤维化方向的研究却很少。
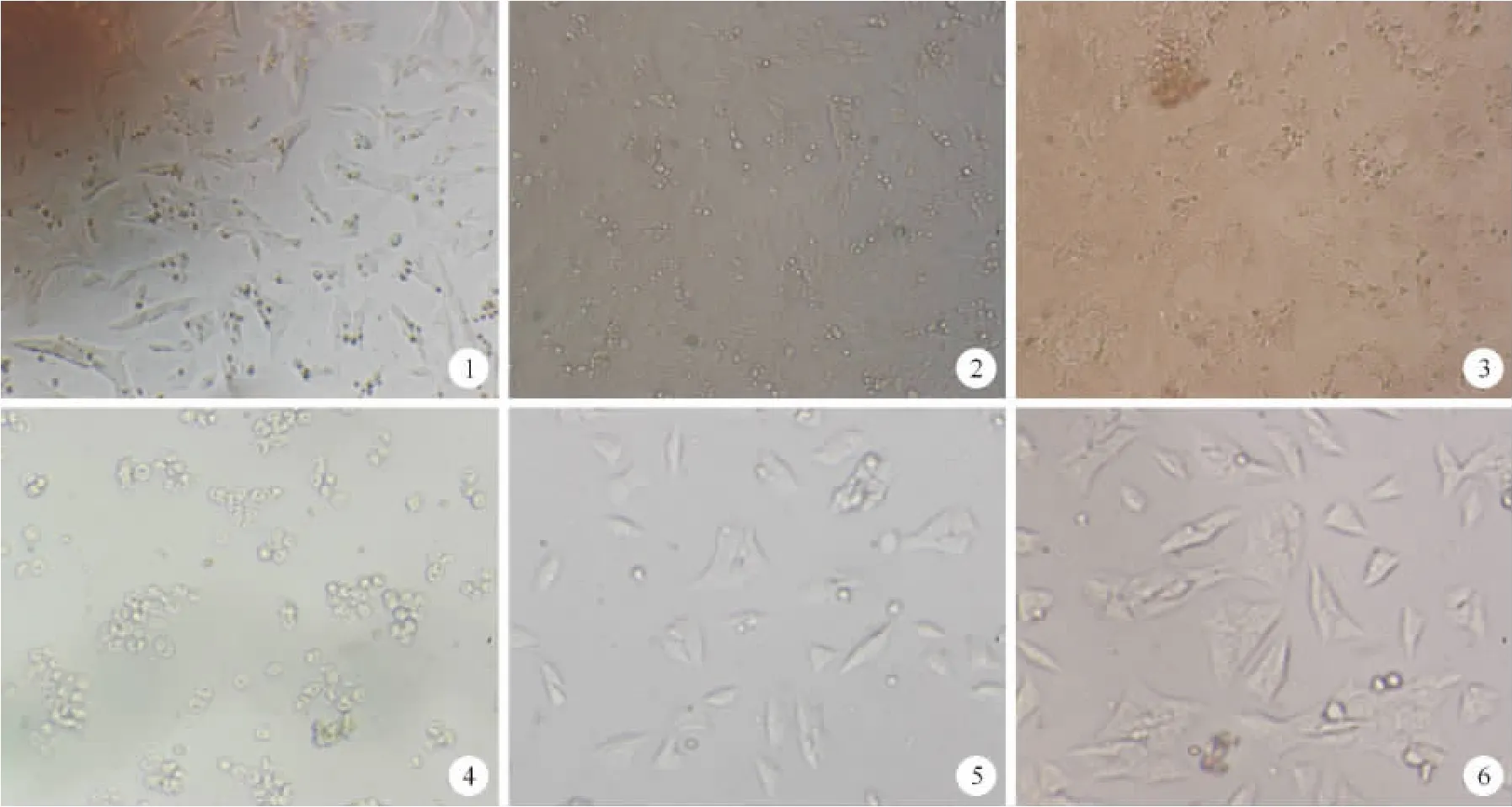
图1 对照组实验前 图2 TGF-β刺激后 图3 对照组实验后 图4 A1组(1∶1 200) 图5 A2组(1∶1 800) 图6A3组(1∶2 400)
本研究通过体外复苏、传代培养HSCs细胞株后,加入不同浓度的羊蹄根进行干预。与对照组相比,羊蹄根实验组能够有效抑制HSCs增殖,逆转肝细胞纤维化,具有一定的抗纤维化疗效。不同浓度梯度的羊蹄根对HSCs增殖抑制效果也有差异,高剂量组(A1)与中(A2)、低(A3)剂量组相比 OD值差异有统计学意义(P<0.01),而中剂量组A2与低剂量组A3之间的抑制率比较差异无统计学意义(P>0.05)。同时镜下观察A1组可见:细胞由之前的星形、梭形转变成了椭圆形,凋亡细胞增多,活细胞数目显著减少,有效抑制了HSCs增殖且抑制率高达69.36%。随着羊蹄根浓度的降低,A2、A3组相比对照组而言,HSCs增殖抑制率差异有统计学意义(P<0.05),抑制率分别为32.01%和29.14%,HSCs形态也发生了显著逆转,但干预效果不及高剂量A1组。总体说明肝细胞纤维化得到有效逆转,延缓了HSCs纤维化的进一步恶化。
本研究结果表明:羊蹄根对HSCs增殖具有显著的抑制作用,并且随着药物浓度的增加,其抑制作用也在增强,抑制率也相应升高,有效逆转了HSCs纤维化。本实验不足之处在于未能探讨出羊蹄根药物抑制HSCs增殖的具体作用机制,其药理治疗机制还有待于进一步探讨研究,以便为以后羊蹄根的临床治疗奠定基础。
[1]Reynaert H,Thompson MG,Thomas T,etal.Hepatic stellate cells:role in microcirculation and pathophysiology of portal hypertension[J].Gut,2002,50(4):571-581.
[2]张国民,王鑫,赵新辉.肝纤维化形成机制的研究进展[J].中国健康月刊:B,2011,30(8):56-58.
[3]马健康,刘哲,雷钧涛,等.中药羊蹄根的化学成分研究[J].吉林医药学院学报,2011,32(3):133-134.
[4]Chen DS.Toward elimination and eradication of hepatitis B[J].Journal of Gastroenterology and Hepatology,2010,25(1):19-25.
[5]Lee Y,Friedman SL.Fibrosis in the liver:acute protection and chronic disease[J].Progress in Molecular Biology and Translational Science,2009,97:151-200.
[6]Voiculescu M,Winkler RE,Moscovici M,etal.Chemotherapies and targeted therapies in advanced hepatocellular carcinoma:from laboratory to clinic[J].J Gastrointestin Liver Dis,2008,17(3):315-322.
[7]Povero D,Busletta C,Novo E,etal.Liver fibrosis:a dynamic and potentially reversible process[J].Histol Histopathol,2010,25(8):1075-1091.
[8]贾杰,梁永红.转化生长因子β与肝纤维化的研究进展[J].医学综述,2008,14(21):3225-3226.
