超临界水中醋酸锌水解反应的分子动力学模拟
2013-09-21王晓娟李志义刘志军
王晓娟 李志义 刘志军
(大连理工大学化工机械学院,流体与粉体工程设计研究所,辽宁大连116023)
1 引言
纳米氧化锌(ZnO)是一种重要的化工原料,是橡胶制品和涂料生产中重要的催化剂之一.纳米ZnO还可用作光化学反应的催化剂,制造光电以及热敏材料.添加了纳米ZnO的陶瓷制品,可降低陶制品的烧结温度,降低能耗,烧成品外观更好.1,2ZnO纳米线具有独特的传输和力学特性,近年来引起了研究者的极大兴趣.3
由于超临界水(SCW)具有特殊的溶解度、可变的密度、较低的粘度和表面张力以及较高的扩散特性,4,5利用超临界水热合成法制备纳米ZnO逐渐成为常用的方法之一.6-8在这种方法中,超临界水(SCW,温度Tc=647 K,压力pc=22 MPa,密度ρc=0.322 g·cm-3)同时作为反应介质和反应物,含Zn离子的盐如 Zn(NO3)2、ZnSO4、Zn(CH3COO)2的水溶液在超临界状态下与碱(如KOH)或纯水先发生水解反应生成Zn(OH)2,然后Zn(OH)2脱水得到纳米级的ZnO颗粒.1,2利用超临界水热合成还成功制备出不同种类和形貌的纳米颗粒,如MgO、TiO2、ZrO2、SnO2、ZnS和Fe3O4等.1,2
与此同时,研究者对超临界水7-9以及含盐水溶液的特性也开展了一系列分子动力学模拟,如研究NaCl、10-13FeCl2、14-16以及 NaCO317在 SCW 中的成核机制.本课题组利用Zn(CH3COO)2直接和SCW反应,制备得到最小平均粒径约为10 nm的ZnO球形颗粒,2反应如式(1)所示.

本文在已有实验结果2的基础上,利用分子动力学模拟Zn(CH3COO)2与SCW反应的能量变化,以及产物CH3COOH在SCW的分布特性,为实验上通过控制温度或压力生成纳米ZnO颗粒提供理论参考.
2 分子动力学模拟部分
2.1 非键相互作用参数
本文分子动力学模拟涉及到的物质有SCW、Zn(CH3COO)2、Zn(OH)2和CH3COOH.其中H2O采用TIP3P模型,18,19CH3COO-和CH3COOH分子中的键相互作用采用OPLS-AA力场中相应的力场参数.20非键相互作用包含静电和范德华作用(Lennard-Jones作用),形式如式(2)所示,其中q是原子的部分电荷,rij表示原子i和j之间的距离,σij和εij表示原子i和j相互作用的范德华参数,根据单个原子的σ和ε采用Lorentz-Berthelot混合法则得到,如式(3)所示.CH3COO-和CH3COOH中各个原子的部分电荷采用restrained electrostatic potential(RESP)方法计算得到.21OH-中O原子和H原子的部分电荷以及其它原子的范德华参数采用OPLS-AA力场中的参数,模拟使用的参数总结于表1.

2.2 分子动力学模拟体系
本文采用Gromacs 4.522作为分子动力学模拟软件.根据我们已有的实验结果采用等温等压系综(NPT),即模拟压力控制在25 MPa,模拟温度分别为650、750和850 K.初始一定量的Zn(CH3COO)2随机分布在长方体的水盒中,通过控制体系的体积,使得Zn(CH3COO)2在SCW水中的浓度达到0.05 mol·L-1.分子动力学模拟积分步长为2 fs,每500步(1 ps)存储一个轨迹.应用立方周期性边界条件,静电作用采用partical mesh Ewald(PME)方法23计算,范德华作用的计算半径为1.2 nm.每个模拟体系包含的水分子和Zn(CH3COO)2的个数列于表2,其中一个体系的初始结构如图1所示.由于本文侧重于Zn(CH3COO)2的水解反应,对Zn(CH3COO)2的成核过程不做详细分析,故对每个体系进行20 ns的模拟.分析结果发现经过10 ns的动力学模拟,Zn(CH3COO)2已经能够聚集形成无定形的团簇,没有游离状态的CH3COO-和Zn2+,因此只对每个模拟结果的后10 ns进行分析.

表1 分子动力学模拟使用的非键相互作用参数Table 1 Non-bonded parameters used in molecular dynamics simulations

表2 模拟体系以及相应的密度、势能和SCW中Zn(CH3COO)2水热反应的势能差Table 2 Systems under investigation,and their corresponding densities,potential energies,and the potential energy differences after hydrolysis of Zn(CH3COO)2in SCW
3 结果与讨论
3.1 Zn(CH3COO)2在SCW中的结构特征
为验证每个系统是否达到了预先设定的模拟条件,首先考察了压力和温度随时间的变化,其中一个系统(25 MPa,850 K)的情况如图2所示.结果表明每个系统的平均压力均为25 MPa,平均温度很好地维持在设定的650、750和850 K,对应每个系统的密度分别为0.18,0.10和0.08 g·cm-3(表2).上述结果表明每个模拟的系统均处于水的超临界点之上.8
径向分布函数g(r)反应了一个物质围绕另一个物质的平均分布情况,成核后的Zn(CH3COO)2在SCW中的径向分布函数计算如图3所示,对应第一极小值的半径以及径向分布函数在此半径内积分后得到的配位数CN总结于表3,其中配位数CN的计算公式如式(4).5,13

图1 Zn(CH3COO)2在SCW(25 MPa,650 K)中的初始结构Fig.1 Initial structure of Zn(CH3COO)2in SCW at 25 MPa and 650 K


图2 系统温度和压力在一个系统的分子动力学模拟过程中随时间的变化Fig.2 Changes of temperature and pressure during the course of one of molecular dynamics simulations
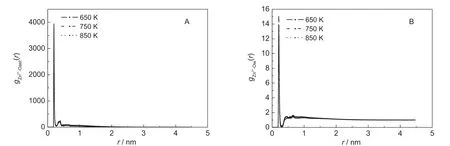
图3 不同温度下Zn离子周围CH3COO-(A)和H2O(B)中氧原子分布的径向分布函数Fig.3 Radial distribution functions of Zn2+with respect to oxygen atoms of CH3COO-(A)and H2O(B)at different temperatures
由图3可见,Zn2+周围CH3COO-和H2O的分布并不随温度的变化而发生明显的改变.由径向分布函数的第一峰值可见Zn2+周围CH3COO-的分布明显强于H2O.在不同温度下,Zn2+周围CH3COO-中氧原子的平均配位数约为4.8,表明一个Zn2+平均结合5个来自CH3COO-的氧原子.Zn2+与水的配位能力随温度的升高而降低,其配位数从650 K的1.19降低到850 K的0.586,说明一个Zn2+平均结合一个H2O,满足Zn2+配位数一般为6的要求,易于形成八面体的空间结构.进一步分析CH3COO-的两个氧原子与Zn2+的配位情况表明:Zn2+以很小的概率同时和一个CH3COO-的两个氧原子配位(图4).根据经典的静电场理论,这种配位方式是由于单纯的静电作用导致.另一方面,由于甲基的疏水作用,Zn(CH3COO)2成核时,内部容易形成疏水的空间,根据上述分析,这种疏水作用随温度的升高而增强,导致在850 K时,Zn2+与H2O的结合减弱.但在Zn(CH3COO)2和H2O的两相界面,仍然可以观察到一个Zn2+能够最多和3个H2O配位,图4A所示为在650 K模拟温度下,处于两相界面的Zn2+分别结合1至3个H2O的情况,在其它温度下也观察到类似的配位方式.以上分析表明在SCW中,静电作用和疏水作用达到动态平衡时,成核的Zn(CH3COO)2内部和表面能够结合一定量的H2O,这为Zn(CH3COO)2和H2O在超临界条件下的反应创造了条件.
3.2 Zn(CH3COO)2在SCW中的水解反应分析
由式(1),Zn(CH3COO)2和H2O在超临界条件下水解反应的第一步生成CH3COOH和Zn(OH)2.已知CH3COOH,Zn(OH)2和H2O的标准生成焓分别为:24,25H⊖f(CH3COOH)=-483.5 kJ·mol-1,H⊖f(Zn(OH)2)=-642.2 kJ·mol-1,H⊖f(H2O)=-285.8 kJ·mol-1,最近的文献24报道含有2个结晶水的Zn(CH3COO)2的标准生成焓为H⊖f(Zn(CH3COO)2·2H2O)=-1669.6 kJ·mol-1.根据上述热力学参数可知,在标准状态下(298 K,0.1 MPa),Zn(CH3COO)2水解反应的反应焓变ΔH⊖r=60.4 kJ·mol-1,表明上述反应热力学上是难以发生的.为探讨在超临界条件下反应的能量变化,将图4所示的与Zn2+配位的H2O和CH3COO-分别替换为OH-和CH3COOH,在设定条件下得到另外9个体系.对每个体系使用和未作基团替换时相同的模拟条件,分别进行了20 ns的分子动力学模拟,利用后10 ns的模拟结果,分别计算了每个体系的势能,结果列于表2.

表3 SCW中Zn(CH3COO)2水解反应前后的径向分布函数中第一极小值的位置(r)以及相应的配位数(CN)Table 3 Positions(r)of the first minimum in the radial distribution functions of Zn(CH3COO)2in SCW before and after hydrolysis,with the corresponding coordination number(CN)

图4 (A)Zn(CH3COO)2和H2O两相界面Zn2+分别结合1个(a),2个(b)和3个(c)H2O分子;(B)Zn2+和一个CH3COO-的两个O原子同时配位Fig.4 (A)Coordination sphere of Zn2+with 1(a),2(b)and 3(c)water molecules at the interface of Zn(CH3COO)2and H2O;(B)one zinc ions binding with the two oxygen atoms from one CH3COO-
根据表2,当H2O和CH3COO-分别变为OH-和CH3COOH后,整个系统的势能降低.虽然势能的标准差在650、750和850 K时分别为0.6%、0.4%和0.3%,均高于势能的变化ΔE,但由于在相同温度下计算得到的势能标准差非常接近,使得分析势能的差值具有统计意义.计算发现1个H2O和CH3COO-被OH-和CH3COOH取代后系统势能降低的程度并不恒定,例如在650 K,相对于没有发生基团取代的系统,当1至3个H2O和CH3COO-分别被相同数目的OH-和CH3COOH取代后,系统势能分别降低417、726和1072 kJ·mol-1,表明系统逐渐趋于更加稳定的状态,同时也说明Zn(CH3COO)2在SCW中的水解反应更容易进行.若定义上述差值为一次差分,类似的定义二次差分为3(或2)个H2O和CH3COO-分别被相同数目的OH-和CH3COOH取代后,系统势能相对于2(或1)个H2O和CH3COO-分别被取代后系统势能的降低值.二次差分反映了1个H2O和CH3COO-分别被OH-和CH3COOH取代后系统势能改变的相对大小.在650 K时二次差分的数值分别为-309和-346 kJ·mol-1,表明当1个H2O和CH3COO-分别被OH-和CH3COOH取代后系统势能改变的不是一个恒定的数值,暗示Zn(CH3COO)2在SCW中的水解反应同时伴随着结构的改变,是一个动态的过程.类似的,在750和850 K的模拟条件下也发现二次差分的数值并不一致.
模拟发现当1至3个H2O和CH3COO-分别被相同数目的OH-和CH3COOH替换后,Zn(CH3COO)2在SCW中依然处于聚集状态,OH-扩散进入Zn(CH3COO)2团簇内部,CH3COOH则扩散至水相,并有向水相-气相界面扩散的趋势,如图5和图6所示.研究者利用分子动力学模拟OH-和HCl在超临界NaCl水中的分布时发现类似的现象,即OH-扩散进入NaCl团簇,HCl则扩散进入水相.12根据径向分布函数计算OH-周围Zn2+的分布情况发现(表3)1个OH-同时和3个Zn2+配位(图6),并且这种配位方式不随体系中OH-数目以及温度而改变(表3),表明OH-有强烈的富集Zn2+的作用,这也为生成Zn(OH)2提供了结构上的便利.

图5 Zn(CH3COO)2在SCW中的水解产物CH3COOH的分布Fig.5 Distribution of CH3COOH as a product of hydrolysis of Zn(CH3COO)2in SCW

图6 Zn(CH3COO)2在SCW中的水解产物OH-的分布Fig.6 Distribution of OH-as a product of hydrolysis of Zn(CH3COO)2in SCW
超临界条件下水分子的氢键减弱,相应的水分子的介电屏蔽减弱,使得阴阳离子容易发生静电吸引而聚合.13同时,离子之间由于静电作用形成的电场也为超临界水解NaCl提供了能量来源.12由于本文的研究对象Zn(CH3COO)2比一般的盐如NaCl、FeCl2复杂,超临界条件下Zn(CH3COO)2的团聚是否有助于水解反应的发生值得研究.分析处于Zn(CH3COO)2团簇内部并且和Zn2+配位的水分子周围静电势的分布为理解Zn(CH3COO)2水解反应的能量变化提供了定性的图像.利用Discovery Studio 2.5软件包中的静电势计算模块,26使用和本文分子动力学模拟相同的原子电荷,计算得到一个H2O周围静电势的分布,如图7所示.由于被Zn(CH3COO)2包围的H2O周围分布着很强的负静电势,可能容易使H2O发生极化变形进而解离生成OH-和H+,促进Zn(CH3COO)2水解反应的进行.定量的分析需要借助于复杂的量子化学计算,有待于进一步深入研究.

图7 SCW中Zn(CH3COO)2团簇内部一个H2O周围静电势的分布Fig.7 Electrostatic potential distribution around a water molecule confined by Zn(CH3COO)2cluster in SCW
4 结论
利用分子动力学模拟研究了Zn(CH3COO)2在SCW中的平衡特征以及水解反应过程的能量变化,定性分析了水分子在Zn(CH3COO)2团簇内部由于静电场的影响而发生解离的可能性,得出以下结论.
(1)Zn(CH3COO)2在SCW中易于聚集成团,1个Zn2+周围平均结合5个CH3COO-和1个H2O,满足Zn2+形成6配位八面体的空间构型的需要.Zn2+在Zn(CH3COO)2团簇内部和表明的配位情况有所不同,更多的H2O在Zn(CH3COO)2团簇表面参与Zn2+配位.
(2)在标准状态,Zn(CH3COO)2水解生成Zn(OH)2和CH3COOH的反应焓变为60.4 kJ·mol-1,从热力学的角度看难以发生.但在超临界条件下,模拟发现上述水解反应使得体系势能降低,表明反应容易发生,并且水解反应发生的同时伴随Zn(CH3COO)2团簇结构的改变.水解产物OH-容易进入Zn(CH3COO)2团簇内部,富集Zn2+,而产物CH3COOH扩散进入水相,并倾向分布在水相-气相界面.
(3)定性分析处于Zn(CH3COO)2团簇内部的水分子周围静电势的分布发现,水分子周围分布有很强的负的静电势,容易使水分子极化变形进而解离,促进Zn(CH3COO)2在SCW中的水解反应.
(1)Wang,X.J.;Hu,S.J.;Liu,X.W.;Li,Z.Y.;Hu,D.P.Chem.Eng.Oil.Gas 2007,36,362.[王晓娟,胡施俊,刘学武,李志义,胡大鹏.石油与天然气化工,2007,36,362.]
(2)Wang,X.J.;Liu,X.W.;Xia,Y.J.;Li,Z.Y.J.Chem.Ind.Eng.2007,28,18.[王晓娟,刘学武,夏远景,李志义.化学工业与工程技术,2007,28,18.]
(3)Dai,L.;Cheong,W.C.;Sow,C.H.;Lim,C.T.;Tan,V.B.Langmuir 2010,26,1165.doi:10.1021/la9022739
(4) Matubayasi,N.;Wakai,C.;Nakahara,M.J.Chem.Phys.1999,110,8000.doi:10.1063/1.478728
(5) Zhou,J.;Lu,X.H.;Wang,Y.R.;Shi,J.Acta Phys.-Chim.Sin.1999,15,1017.[周 健,陆小华,王延儒,时 钧.物理化学学报,1999,15,1017.]doi:10.3866/PKU.WHXB19991112
(6)Sue,K.;Murata,K.;Kimura,K.;Arai,K.Green Chem.2003,5,659.doi:10.1039/b306544h
(7) Viswanathan,R.;Gupta,R.B.J.Supercrit.Fluids 2003,27,187.doi:10.1016/S0896-8446(02)00236-X
(8)Sue,K.;Kimura,K.;Yamamoto,M.;Arai,K.Mater.Lett.2004,58,3350.doi:10.1016/j.matlet.2004.06.036
(9) Ma,H.B.J.Chem.Phys.2012,136,214501.doi:10.1063/1.4720575
(10)Lümmen,N.;Kvamme,B.Phys.Chem.Chem.Phys.2007,9,3251.doi:10.1039/b703430j
(11) Nahtigal,I.G.;Zasetsky,A.Y.;Svishchev,I.M.J.Phys.Chem.B 2008,112,7537.doi:10.1021/jp709688g
(12) Nahtigal,I.G.;Svishchev,I.M.J.Phys.Chem.B 2009,113,14681.doi:10.1021/jp9039572
(13)Zhou,J.;Zhu,Y.;Wang,W.C.;Lu,X.H.;Wang,Y.R.;Shi,J.Acta Phys.-Chim.Sin.2002,18,207.[周 健,朱 宇,汪文川,陆小华,王延儒,时 钧.物理化学学报,2002,18,207.]doi:10.3866/PKU.WHXB20020304
(14)Lümmen,N.;Kvamme,B.J.Phys.Chem.B 2008,112,12374.doi:10.1021/jp710156b
(15)Lümmen,N.;Kvamme,B.J.Supercrit.Fluids 2008,47,270.doi:10.1016/j.supflu.2008.07.017
(16)Lümmen,N.;Kvamme,B.J.Chem.Phys.2010,132,014702.doi:10.1063/1.3270158
(17) Zhang,J.L.;He,Z.H.;Han,Y.;Li,W.;Wu,J.J.X.;Gan,Z.X.;Gu,J.J.Acta Phys.-Chim.Sin.2012,28,1691.[张金利,何正华,韩 优,李 韡,武江洁星,甘中学,谷俊杰.物理化学学报,2012,28,1691.]doi:10.3866/PKU.WHXB201205032
(18) Jorgensen,W.L.;Chandrasekhar,J.;Madura,J.D.;Impey,R.W.;Klein,M.L.J.Chem.Phys.1983,79,926.doi:10.1063/1.445869
(19) Mizan,T.I.;Savage,P.E.;Ziff,R.M.J.Phys.Chem.1994,98,13067.doi:10.1021/j100100a042
(20) Jorgensen,W.L.;Maxwell,D.S.;Tirado-Rives,J.J.Am.Chem.Soc.1996,118,11225.doi:10.1021/ja9621760
(21)Wang,J.;Cieplak,P.;Kollman,P.A.J.Comput.Chem.2000,21,1049.doi:10.1002/(ISSN)1096-987X
(22) Van Der Spoel,D.;Lindahl,E.;Hess,B.;Groenhof,G.;Mark,A.E.;Berendsen,H.J.J.Comput.Chem.2005,26,1701.doi:10.1002/jcc.20291
(23) Darden,T.;York,D.;Pedersen,L.J.Chem.Phys.1993,98,10089.doi:10.1063/1.464397
(24) Steven,S.Z.Chemical Principles,6th ed.;Houghton Mifflin Company:Boston,2009.
(25) Hughes,J.T.;Navrotsky,A.J.Chem.Thermodynamics 2011,43,980.doi:10.1016/j.jct.2011.02.004
(26) Discovery Studio 2.5;Accelrys Software Inc.:San Diego,CA,2008.
