外源纤维酶制剂对青贮玉米体外发酵特性以及甲烷生成的影响
2013-09-20茅慧玲王佳堃吴晨晖刘建新
陈 兴 茅慧玲 王佳堃 吴晨晖 刘建新
(浙江大学动物科学学院,杭州 310058)
粗纤维消化是一个涉及到多种酶参与的复杂水解过程[21-23],反刍动物因为日龄或者健康状况有时不能提供足够的酶。目前我国生产的酶制剂从纯度到活力都有很大的改进,木聚糖酶(xylanase,XYL)活力能达到40 000 U/g以上,内切纤维素酶(cellulase,CEL)活力也能达到1 000 U/g左右。全面调查中国主要的纤维酶制剂产品,并参考国外的酶制剂,对比体外(瘤胃)发酵作用显得非常必要。为此,本试验旨在通过对9种国产纤维酶制剂(5种木聚糖酶和4种纤维素酶)和2种美国公司提供的酶制剂(1种纤维素酶和1种木聚糖酶)进行酶活比较测定,并用青贮玉米作为底物,评价其对体外发酵的影响,以期为酶制剂在反刍动物上的应用提供参考依据。
1 材料与方法
1.1 纤维酶制剂以及蛋白质浓度、酶活测定
11种纤维酶制剂包括5种纤维素酶(CEL-1、CEL-2、CEL-3、CEL-4、CEL-5)和 6 种木聚糖酶(XYL-1、XYL-2、XYL-3、XYL-4、XYL-5、XYL-6)。使用Super-Bradford蛋白质定量试剂盒(Cat.No.CW-0013)测定酶制剂的蛋白质浓度,用多功能微孔板检测系统(酶标仪)(SpectraMax M-5,Molecular Devices),在595 nm处检测吸光度,绘制标准曲线,计算出样品的蛋白质浓度。在pH 6.6和温度39℃下测定所有酶制剂的木聚糖酶活、内切葡聚糖酶活和外切葡聚糖酶活[24-27]。
1.2 底物以及体外试验设计
采用压力读取式体外产气法(reading pressure technique,RPT)[28],单因素试验设计;底物为青贮玉米,春玉米(8月15日收获)带穗青贮,贮存时间在4个月左右,65℃烘干后粉碎,样品经过0.45 mm筛过滤。干物质(dry matter,DM)、粗蛋白质(crude protein,CP)、中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF)含量分别为 96.0%、8.13%、59.2%和41.2%。称取0.5 g(DM)的青贮玉米于120 mL的产气瓶中,将酶制剂溶解后,在4℃下20 000×g离心10 min,取上清液加入到底物中。纤维素酶的添加水平为30 U/g底物(DM),木聚糖酶的添加水平为40 U/g底物(DM)。酶和底物在室温下充分反应3 h[7]后,加入40 mL的厌氧人工瘤胃缓冲液,39℃的隔水式恒温培养箱放置21 h,每个处理6个重复。
晨饲前,抽取3头瘘管奶牛的瘤胃液,混合后4层纱布过滤,在每个产气瓶接种10 mL的瘤胃液,置于(39.0±0.5)℃的恒温箱中培养。
1.3 试验测定指标
产气量:在培养 3、6、9、12、24、48 h 时用压力传感器读取产气瓶的气体压力,将压力转换成产气量。利用各培养时间点(t,h)累计产气量(P,mL),按下式计算产气参数:P=a+b(1-e-ct)[式中:P为培养t h的累计产气量(mL),a为目标成分的快速降解部分的产气量(mL),b为目标成分的慢速降解部分的产气量(mL);c为b部分的降解速率(mL/h)]。
甲烷产量:在培养6、12、24 h时,吸取1 mL 气体样品,用气相色谱仪(GC-2010,Shimadzu)分析气体的甲烷含量。
挥发性脂肪酸(volatile fatty acid,VFA)产量:终止培养后,取上清液1 mL,混合 0.2 mL的8.2%偏磷酸,在4℃下20 000×g离心10 min,用气相色谱仪(GC-2010,Shimadzu)分析乙酸、丙酸、丁酸以及总VFA产量。
DM、NDF、ADF降解率:培养底物经称重后过300目尼龙袋,清水洗涤至无色,65℃烘干48 h,测定残渣的 DM、NDF、ADF 含量[29],计算目标降解率。
我早就估计到西山是要出事的,三十多辆蹦子三轮车成天在井下穿梭来往,车与车擦碰得火星四溅。不过西山是低硫矿,毒瓦斯的比例不到十万分之一。西山“固若金汤”。这是那个肥胖的煤老板早就向我们拍着胸脯子说的话。
1.4 试验数据统计分析及处理
试验数据采用SAS 9.2软件处理,采用单因素方差分析进行统计分析,各平均值之间用Duncan氏法进行多重比较,P<0.05为差异显著。
2 结果
2.1 蛋白质浓度和酶活测定
在pH 6.6和温度39℃下的试验所用酶的木聚糖酶活、内切葡聚糖酶活和外切葡聚糖酶活被重新测定,结果表明各厂家所提供的酶制剂酶活差异很大,酶的蛋白质浓度也有较大的差异(表 1)。

表1 试验所用11种外源纤维酶制剂的木聚糖酶活、内切葡聚糖酶活和外切葡聚糖酶活Table1 Activities of xylanase,endoglucanase and exoglucanase in 11 kinds of exogenous fibrolytic enzymes used in this study
2.2 产气量和产气参数
与对照组相比,纤维素酶组的48 h产气量有降低趋势(表2),其中 CEL-1、CEL-2、CEL-5组达到了显著水平(P<0.05);潜在产气量(a+b)均显著下降(P<0.05),其中CEL-1、CEL-2组下降程度最大,潜在产气量分别下降了25.3%和21.3%;但是,产气速率(c)均显著加快(P<0.05),添加CEL-1时可提高产气速率达82.5%。除XYL-3组潜在产气量显著低于对照组(P<0.05)外,木聚糖酶组其他产气参数均与对照组无显著差异(P>0.05)。
除XYL-4对ADF降解率效果不显著(P>0.05)外,其他酶制剂均显著提高了青贮玉米DM、NDF、ADF的降解率(P <0.05),其中 CEL-2组的DM、NDF和ADF降解率分别达到65.4%、60.4%和61.0%,分别比对照提高了17.6%、21.5%、19.8%。
2.3 VFA和甲烷产量
与对照组相比,XYL-1、XYL-4和CEL-5的添加显著提高了总VFA产量(P<0.05,表3),但其他酶制剂对总VFA产量均无显著影响(P>0.05)。添加XYL-3和XYL-4均显著降低了乙酸摩尔比和乙酸∶丙酸(P<0.05),显著提高了丙酸摩尔比(P<0.05),但仅XYL-4显著提高了丁酸摩尔比(P<0.05),其他酶制剂对各种脂肪酸比例的影响均不显著(P>0.05)。总体而言,酶制剂对各种脂肪酸的比例影响不大。
由表4可知,酶制剂对甲烷产量的影响呈现了较大的变化,在培养6 h时,添加XYL-5、XYL-6显著降低了甲烷产量(P<0.05),而添加CEL-1、CEL-2则显著增加了甲烷产量(P<0.05)。随着培养时间的延长,到12 h时,仅添加CEL-1显著影响了甲烷产量(P<0.05),而到24 h时,酶制剂对甲烷生成的影响变得不再显著(P>0.05)。
3 讨论
市面上的酶制剂除了用于饲料添加剂外,有些是设计用于果汁生产、造纸、染料和一些化学工业的[6],而应用在不同动物上的酶制剂的最适条件也有较大差异,如国外公司提供的纤维素酶活和木聚糖酶活是在pH 4.8、50℃下测得的,而反刍动物瘤胃环境是pH 6.6和39℃,所以我们测得的酶活比公司提供的酶活略低。在不同的温度和条件下,纤维素酶活和木聚糖酶活有很大的变化[23]。因此在利用酶制剂作为动物添加剂时,有 必要根据动物消化道的环境条件来测定酶活。

表2 添加11种外源纤维酶制剂对以青贮玉米为底物体外培养试验产气参数以及DM、NDF、ADF降解率的影响Table2 Effects of 11 kinds of exogenous fibrolytic enzymes on gas production parameters and the degradation rates of DM,NDF and ADF in the in vitro test of corn silage as a substrate(n=3)
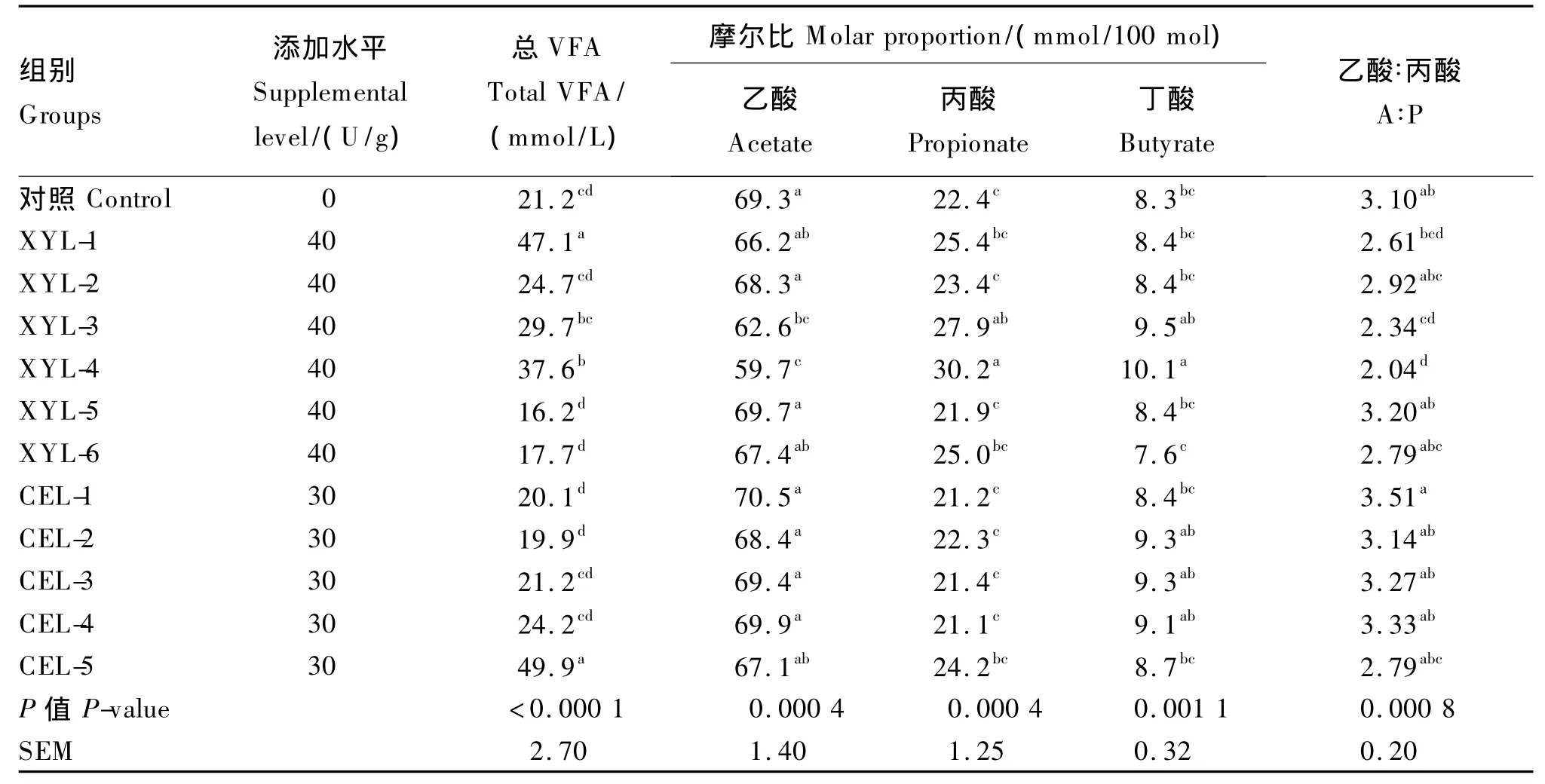
表3 添加11种外源外源纤维酶制剂对青贮玉米为底物体外培养试验48 h总VFA及单个VFA产量的影响Table3 Effects of 11 kinds of exogenous fibrolytic enzymes on total and individual VFA yields at 48 h in the in vitro test of corn silage as a substrate(n=3)

表4 添加11种外源纤维酶制剂对青贮玉米为底物体外培养试验在6、12、24 h时甲烷累计产量的影响Table4 Effects of 11 kinds of exogenous fibrolytic enzymes on cumulative methane production at 6,12 and 24 h in the in vitro test of corn silage as a substrate(n=3) mL/g
有试验表明,外源酶制剂添加水平在0.5~1.5 mg/g底物(DM)的时候,添加效果最好[7,9-11,24,30]。根据我们所测得的木聚糖酶活折算,1.5 mg/g的添加水平酶活大约在40 U/g,纤维素酶则根据国外酶制剂公司的推荐值以及之前的试验所报道的用量[31],即30 U/g的水平添加。
之前的体外试验证明,纤维酶制剂可以提高苜蓿干草以及青贮玉米的产气量以及DM、NDF降解率[7,10-11,32],但也有试验表明添加酶制剂没有作用,产气量变化也不大[33],Giraldo 等[13]利用热带地区干草为底物开展产气试验,结果表明木聚糖酶对产气参数没有任何作用。Beauchemin等[6]曾讨论过试验结果缺乏一致性的原因,指出要获得较好的效果,酶与底物的匹配是一个重要的前提,而不仅仅只考虑到酶活大小。Colombatto等[24]在2003年测量了23种酶制剂的蛋白质浓度和17种酶活指标,以及酶对青贮玉米和苜蓿干草降解的还原糖产量,对还原糖产量和和酶活指标的回归分析显示,酶的蛋白质浓度能解释60%左右的还原糖变化,但是酶活只能解释1/3的体外DM降解率。Eun等[10]用2种不同的手段证明了影响苜蓿干草和青贮玉米这2种底物的体外产气参数的主要酶是外切葡聚糖酶和内切葡聚糖酶。因为青贮玉米中半纤维素含量较少,所以木聚糖酶对青贮玉米的作用较小不难理解,在本试验中,木聚糖酶一方面对产气量和产气速率没有显著影响,另一方面却提高了DM、NDF以及ADF降解率,可能的原因是木聚糖酶降解了部分DM生成五碳糖,但是五碳糖在微生物体内利用率要显著低于六碳糖[34],这一推测有待进一步试验验证。
近期的体内试验结果表明,添加酶制剂可降低乙 酸 ∶丙 酸[10,32-33,35]。Tirado-Estrada 等[36]在2011年给以玉米干草为基础饲粮的40只羊羔[(20±1.6)kg]的饲粮中添加酶制剂,持续饲喂55 d后,2种酶均显著提高了总VFA产量,其中纤维素酶显著提高了丙酸百分比,显著降低了丁酸百分比,而且使得乙酸∶丙酸显著下降。酶制剂提高发酵VFA的产量的原因可能在于改变了瘤胃微生物数量和区系,Chung等[14]利用9头安装瘤胃瘘管的荷斯坦奶牛,根据3×3拉丁方试验设计,添加低水平和高水平的酶制剂,在第15天和第19天采集瘤胃内容物后,利用特异性16S-rRNA分析显示,高水平的酶制剂处理中嗜淀粉瘤胃杆菌数量显著上升,产琥珀酸丝状杆菌数量有上升趋势,反刍月形单胞菌的数量随着酶制剂添加水平的增加呈线性递增,低水平的酶处理中牛链球菌数量趋于降低[14]。产琥珀酸丝状杆菌是瘤胃内主要的纤维素降解菌,反刍月形单胞菌具有琥珀酸脱羧基作用,而反刍动物主要靠微生物的琥珀酸脱羧作用获得丙酸。因此,丙酸比例上升有可能是因为反刍月形单孢菌数量的上升所导致。此外,考虑到瘤胃原虫也是影响纤维降解的重要因素,所以需要进一步研究酶制剂对原虫的影响。
本试验中,在培养6和12 h时,酶制剂对甲烷生成呈现不同的变异性,在24 h时的甲烷生成似乎不再受到酶制剂的影响(表4)。Beauchemin等[19-20]提到添加酶制剂一方面会增加甲烷的绝对产量,另一方面有可能会降低每千克DM或者生产每千克牛奶所生成的甲烷量。但是Chung等[14]的动物试验表明,按全混合日粮DM 的0.5或1.0 mL/kg添加酶制剂,无论是每千克饲料DM的甲烷排放量还是每千克牛奶所排放的甲烷量都有显著上升;Zhou等[37]利用实时定量PCR技术分析产奶牛瘤胃内甲烷菌区系发现,加入酶制剂可改变甲烷菌区系,同时增加甲烷产量。本试验中,XYL-5、XYL-6在培养6 h时降低了甲烷生成;但是随着发酵时间延长,甲烷生成逐渐升高的原因还并不很清楚,可能是酶制剂通过改变瘤胃内部微生物数量和比例来提高瘤胃内饲料的利用率,同时也增加甲烷产量。酶制剂的效果还需要通过更为长期的动物试验来验证。
4 结论
①体外试验表明,添加外源酶制剂可提高青贮玉米的DM、NDF、ADF的降解率,其中添加纤维素酶显著提高了青贮玉米的产气速率,显著降低了潜在产气量,但是木聚糖酶对产气参数影响不显著。
②在培养前期,添加不同的酶制剂对甲烷生成的影响存在差异性,培养后期无显著影响。
致谢:
本试验在浙江大学奶业科学研究所完成,感谢浙江大学奶业科学研究所的全体师生对此试验的支持以及提出的宝贵意见。试验所用的酶制剂由4家酶制剂生产企业提供,在此一并向他们致谢。
[1]VAN SOEST P J.Nutritional ecology of the ruminant[M].Ithaca:Cornell University Press,1994.
[2]IPCC.Summary for policymakers[M]//METZ B,DAVIDSON O R,BOSCH P R,et al.Climate change 2007:Mitigation.Contribution of Working GroupⅢto the Fourth Assessment Report of the Intergovernmental Panel on Climate Change.Cambridge:Cambridge University Press,2007:3-23.
[3]BRUINSMA J.Worldagriculture:towards 2015/2030:an FAO perspective[M].London:Earthscan/James & James,2003.
[4]BEAUCHEMIN K A,COLOMBATTO D,MORGAVI D P,et al.Mode of action of exogenous cell wall degrading enzymes for ruminants[J].Canadian Journal of Animal Science,2004,84(1):13-22.
[5]BEAUCHEMIN K A,COLOMBATTO D,MORGAVI D P.A rationale for the development of feed enzyme products for ruminants[J].Canadian Journal of Animal Science,2004,84(1):23-36.
[6]BEAUCHEMIN K A,COLOMBATTO D,MORGAVI D P,et al.Use of exogenous fibrolytic enzymes to improve feed utilization by ruminants[J].Journal of Animal Science,2003,81:E37-E47.
[7]YANG H E,SON Y S,BEAUCHEMIN K A.Effects of exogenous enzymes on ruminal fermentation and degradability of alfalfa hay and rice straw[J].Asian-Australasian Journal of Animal Sciences,2011,24(1):56-64.
[8]HOLTSHAUSEN L,CHUNG Y H,GERARDO-CUERVO H,et al.Improved milk production efficiency in early lactation dairy cattle with dietary addition of a developmental fibrolytic enzyme additive[J].Journal of Dairy Science,2011,94(2):899-907.
[9]COLOMBATTO D,BEAUCHEMIN K A.A protease additive increases fermentation of alfalfa diets by mixed ruminal microorganisms in vitro[J].Journal of Animal Science,2009,87(3):1097-1105.
[10]EUN J S,BEAUCHEMIN K A,SCHULZE H.Use of exogenous fibrolytic enzymes to enhance in vitro fermentation of alfalfa hay and corn silage[J].Journal of Dairy Science,2007,90(3):1440-1451.
[11]EUN J S,BEAUCHEMIN K A,SCHULZE H.Use of an in vitro fermentation bioassay to evaluate improvements in degradation of alfalfa hay due to exogenous feed enzymes[J].Animal Feed Science and Technology,2007,135(3/4):315-328.
[12]NSEREKO V L,MORGAVI D P,RODE L L M,et al.Effects of fungal enzyme preparations on hydrolysis and subsequent degradation of alfalfa hay fiber by mixed rumen microorganisms in vitro[J].Animal Feed Science and Technology,2000,88(3/4):153-170.
[13]GIRALDO L A,RANILLA M J,TEJIDO M L,et al.Effect of exogenous fibrolytic enzymes on in vitro rumen fermentation of tropical forages[J].Journal of Animal and Feed Sciences,2004,13:67-70.
[14]CHUNG Y H,ZHOU M,HOLTSHAUSEN L,et al.A fibrolytic enzyme additive for lactating Holstein cow diets:ruminal fermentation,rumen microbial populations,and enteric methane emissions[J].Journal of Dairy Science,2012,95(3):1419-1427.
[15]GRAINGER C,BEAUCHEMIN K A.Can enteric methane emissions from ruminants be lowered without lowering their production?[J].Animal Feed Science and Technology,2011,166/167:308-320.
[16]BUDDLE B M,DENIS M,ATTWOOD G T,et al.Strategies to reduce methane emissions from farmed ruminants grazing on pasture[J].The Veterinary Journal,2011,188(1):11-17.
[17]MARTIN C,MORGAVI D,DOREAU M.Methane mitigation in ruminants:from microbe to the farm scale[J].Animal,2010,4(3):351-365.
[18]ECKARD R J,GRAINGER C,DE KLEIN C A M.Options for the abatement of methane and nitrous oxide from ruminant production:a review[J].Livestock Science,2010,130(1/2/3):47-56.
[19]BEAUCHEMIN K,MCALLISTER T,MCGINN S.Dietary mitigation of enteric methane from cattle[J].CAB Reviews:Perspectives in Agriculture,Veterinary Science,Nutrition and Natural Resources,2009,4(9):1-18.
[20]BEAUCHEMIN K A,KREUZER M,O’MARA F,et al.Nutritional management for enteric methane abatement:a review[J].Australian Journal of Experimental Agriculture,2008,48(2):21-27.
[21]GUIN B P,AUBERT J P.The biological degradation of cellulose[J].Fems Microbiology Reviews,1994,13(1):25-58.
[22]BIDLACK J,MALONE M,BENSON R.Molecular structure and component integration of secondary cell walls in plants[J].Proceedings of the National Academy of Sciences,1992,72:51-56.
[23]BHAT M,HAZLEWOOD G.Enzymology and other characteristics of cellulases and xylanases[C]//BEDFORD M R,PARTRIDGE G G.Enzymes in farm animal nutrition.Wallingford:CABI,2001:11-60.
[24]COLOMBATTO D,MORGAVI D P,FURTADO A F,et al.Screening of exogenous enzymes for ruminant diets:relationship between biochemical characteristics and in vitro ruminal degradation[J].Journal of Animal Science,2003,81(10):2628-2638.
[25]MILLER G L.Use of dinitrosalicylic acid reagent for determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[26]WOOD T M,BHAT K M.Methods for measuring cellulase activities[M]//WILLIS A,WOOD S T K,ed.Methods in enzymology.New York:Academic Press,1988:87-112.
[27]BAILEY M J,BIELY P,POUTANEN K.Interlaboratory testing of methods for assay of xylanase activity[J].Journal of Biotechnology,1992,23(3):257-270.
[28]MAURICIO R M,MOULD F L,DHANOA M S,et al.A semi-automated in vitro gas production technique for ruminant feedstuff evaluation[J].Animal Feed Science and Technology,1999,79(4):321-330.
[29]GOERING H K,VAN SOEST P J.Forage fiber analyses(apparatus,reagent,procedure,and some application)[M].Washington,D.C.:United States Department of Agriculture,1970:1-20.
[30]EUN J S,BEAUCHEMIN K A,HONG S H,et al.Exogenous enzymes added to untreated or ammoniated rice straw:effects on in vitro fermentation characteristics and degradability[J].Animal Feed Science and Technology,2006,131(1/2):86-101.
[31]GIRALDO L A,TEJIDO M L,RANILLA M J,et al.Effects of exogenous cellulase supplementation on microbial growth and ruminal fermentation of a high-forage diet in Rusitec fermenters[J].Journal of Animal Science,2007,85(8):1962-1970.
[32]EUN J S,BEAUCHEMIN K A.Assessment of the potential of feed enzyme additives to enhance utilization of corn silage fibre by ruminants[J].Canadian Journal of Animal Science,2008,88(1):97-106.
[33]EUN J S,BEAUCHEMIN K A.Enhancing in vitro degradation of alfalfa hay and corn silage using feed enzymes[J].Journal of Dairy Science,2007,90(6):2839-2851.
[34]STROBEL H J,DAWSON K A.Xylose and arabinose utilization by the rumen bacterium butyrivibrio-fibrisolvens[J].FEMS Microbiology Letters,1993,113(3):291-296.
[35]EUN J S,BEAUCHEMIN K A.Assessment of the efficacy of varying experimental exogenous fibrolytic enzymes using in vitro fermentation characteristics[J].Animal Feed Science and Technology,2007,132(3/4):298-315.
[36]TIRADO-ESTRADA G,MENDOZA-MARTINEZ G D,PINOS-RODRIGUEZ J M,et al.Effects of two fibrolytic enzyme mixtures on growth performance,digestion and ruminal fermentation in lambs fed corn stover based diets[J].Journal of Applied Animal Research,2011,39(2):158-160.
[37]ZHOU M,CHUNG Y H,BEAUCHEMIN K A,et al.Relationship between rumen methanogens and methane production in dairy cows fed diets supplemented with a feed enzyme additive[J].Journal of Applied Microbiology,2011,111(5):1148-1158.
