不同代次小鼠脂肪干细胞增殖能力及体外成脂能力的实验研究
2013-09-20蒋婷杨泽龙白倩周广东刘伟
蒋婷 杨泽龙 白倩 周广东 刘伟
成体干细胞可来源于骨髓、脂肪、皮肤、肌肉、角膜等各类组织[1-5],脂肪干细胞(Adipose-derived stem cells,ASCs)因其在体内分布广、取材创伤小、细胞获得量大等优点,成为间充质干细胞新的研究热点。大量的研究已经证实,ASCs有向多个谱系分化的潜能(骨、软骨、脂肪、神经、肌、内皮等)[6-12],目前已被广泛应用于多种组织工程化组织构建的研究中。组织工程化组织构建需要大量优质的种子细胞,一般而言,较早代次的种子细胞活力好、干细胞特性强,但细胞数量有限,很难达到组织构建对细胞量的需求,需要在体外多次传代扩增,细胞代次扩增一次,数量可增加3倍左右。但也不能无限制地扩增,成体干细胞在体外培养扩增过程中易于老化,多次传代后细胞增殖减慢,分化潜能降低[13-15]。因此,需要观察不同代次细胞的增殖能力及分化能力。众所周知,间充质干细胞具有向脂肪诱导分化的潜能,脂肪干细胞因其来源的特殊性,其成脂分化能力与其他组织来源的间充质干细胞有所不同。在我们研究ASCs成脂分化能力时,并未考虑脂肪前体细胞的作用。因此,有必要对ASCs自发成脂能力及诱导成脂分化潜能进行探讨。本实验通过对不同代次mASCs增殖能力、体外自发成脂能力及诱导成脂分化潜能的观察分析,为优化组织工程种子细胞提供更多参数,为组织工程化组织构建种子细胞的合理选用提供实验依据。
1 材料与方法
1.1 实验动物、试剂及仪器
6~8周龄C57BL/6小鼠(野生型小鼠,wild type)购自上海斯莱克实验动物有限责任公司。胶原酶NB4(包含Ⅰ型胶原酶,Ⅱ型胶原酶和中性蛋白酶)购于Serva公司,DMEM购于HyClone公司,胎牛血清购于SAFC Bioscience公司,Mx3000P荧光定量PCR仪购于美国Stratagene公司,逆转录试剂购于Promega公司,定量PCR试剂POWER SYBY Green PCR Master Mix购于美国Applied Biosystems公司,定量PCR引物由上海生工生物公司合成,其余试剂均购于Sigma公司。
1.2 mASCs体外分离与培养
取6~8周龄雌性C57BL/6小鼠,断颈处死,75%乙醇浸泡15 min,超净工作台内无菌条件下暴露腹股沟脂肪,切取并剪碎,放于50 mL离心管中。氯霉素浸泡冲洗15 min后,PBS冲洗3遍,加5倍体积的0.1%胶原酶NB4于37℃恒温摇床内消化1.5 h,150目无菌尼龙网筛过滤,1 500 r/min离心5 min。弃上清,细胞沉淀用PBS洗涤2次,以含10%FBS、100 U/mL青霉素和100 mg/mL链霉素的低糖DMEM培养液制成细胞悬液培养。将分离收获在离心管中的细胞悬液以1×105cells/cm2密度接种于培养皿内,置于37℃、5%CO2、100%饱和湿度的培养箱中培养,3 d后换液,去除未贴壁及悬浮死细胞并加入新鲜培养液。继续在相同条件下培养,待细胞生长达到90%汇合时即可消化传代。用0.25%胰蛋白酶消化传代,以0.5×104~1×104cells/cm2细胞密度接种于新的培养皿内。再次达到90%融合时,继续传代培养。
1.3 生长曲线
分别取原代(P0)、第 2 代(P2)及第 5 代(P5)细胞,消化,制备成单细胞悬液。调整细胞悬液浓度为1×104cells/mL,接种 24孔板,每孔接种 1 mL,分 8组,每组3孔。接种第1天用0.25%胰蛋白酶消化第1组,制成细胞悬液1 mL,加入电解液19 mL,对总体积20 mL的细胞悬液,进行计数,取平均值,作为细胞计数的基数(起始数)。第2天开始计数,每天计数1组,取3个孔的均值,至第8天结束。绘制生长曲线,并计算群体倍增时间。
1.4 体外自发成脂能力检测
分别收集原代(P0)、第二代(P2)及第五代(P5)细胞,将细胞制成5×107cells/mL的细胞悬液,每滴10 μL,接种于六孔板内,每孔接种5滴,于37℃、5%CO2、100%饱和湿度的培养箱中放置15 min,加入含10%血清的高糖DMEM培养液,继续培养。3 d更换培养液,不传代,培养1个月后进行油红染色、RT-PCR检测PPARγ及LPL表达水平。
油红染色:细胞经4%甲醛4℃固定1 h,蒸馏水冲洗,加入60%异丙醇,室温放置1 min,吸尽后加入2%油红试剂,室温放置5~10 min,60%异丙醇洗去多余染液,蒸馏水冲洗后观察。
1.5 成脂分化潜能检测
分别收集原代(P0)、第 2 代(P2)及第 5 代(P5)细胞,按1×105个/孔的密度分别接种于6孔板中,进行成脂诱导,诱导液为基础培养液(高糖DMEM加 入 10%FBS) 加 入 0.5 mmol/L IBMX、1 μmol/L DEX、10 μmol/L insulin、200 μmol/L indomethacin,诱导2周后,进行油红染色、RT-PCR检测PPARγ及LPL表达水平。
1.6 RNA抽提,反转录及定量PCR
常规抽提细胞RNA,反应液:MgCl2(25 mM)4 μL;10×反应缓冲液 2 μL;无 RNA 酶 H2O 8.5 μL;dNTP混合物 10 mM 2 μL;RNA 酶抑制剂 40 U/μL 0.5 μL;逆转录酶5 U/μL 1 μL;随机引物或寡聚核苷酸引物2.5 pmol/μL或特异的下游引物1 μL;实验样品RNA 1 μL(≤1 μg total RNA)。按以下条件进行反转录反应:30 ℃,10 min;42 ℃,60 min;99 ℃,5 min;5 ℃,5 min。
定量PCR试剂POWER SYBY Green PCR Master Mix,应用Mx3000P荧光定量PCR仪,反应条件为:95 ℃,30 sec;57 ℃,30 sec;72 ℃,45 sec,40个循环。Mx3000P分析软件进行分析。引物设计序列如下。
LPL:产物片段长度219 bp;退火温度60℃。上游引物5'-AAGCCCTGCTCCTGGTGGTC-3',下游引物5'-CGAAGGTCTTGCTGCTGTGG-3'。
PPARγ:产物片段长度268 bp;退火温度58℃。上游引物5'-AGACCACTCGCATTCCTTT-3',下游引物5'-CCCACAGACTCGGCACTCA-3'。
1.7 统计学分析
各项定量指标均以x±s表示,应用SPSS 11.5软件包对各定量指标进行统计学分析,两组间比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同代次细胞的形态学特点
原代分离的小鼠脂肪干细胞呈体积较小的圆球形,1~2 h开始贴壁生长,6 h左右细胞伸展开来,呈短梭形,随着传代,细胞体积增大,传代后迅速贴壁,贴壁后的细胞逐渐伸展,外观主要呈长梭型及不规则型,到第5代仍有很强的增殖能力(图1)。
2.2 生长曲线
生长曲线显示,培养的P0、P2、P5细胞均具有较强的分裂增殖能力,均出现24 h停滞生长期,第3~4天进入快速增殖期,体外扩增速度相似,均在第6天进入生长停止状态。P0、P2、P5细胞传代接种后的潜伏期、对数生长期、平台期无明显差异(图2),群体倍增时间大约为48 h。
2.3 自发成脂能力检测
小鼠脂肪干细胞局部高密度接种后培养,高密度区域形成密集的圆形、三角形或多角形细胞团,周边未接种区域细胞亦很快爬满培养皿,细胞体积较大,呈长梭形或不规则形。培养1个月时,油红染色发现,P0细胞高密度接种区域有大量的阳性染色(图3A);P2细胞高密度接种中心区域亦有阳性染色,但明显弱于P0细胞(图3B);P5细胞高密度接种区域有极少微弱的阳性染色(图3C)。细胞低密度或爬行生长区域均无阳性染色。
PT-PCR检测发现,自发分化1个月后,P0细胞PPARγ表达强于P2细胞,P2细胞表达强于P5细胞;LPL表达亦有同样的趋势,P<0.05(图3)。说明随着培养代次的增加,脂肪干细胞中脂肪前体细胞的数量明显减少,到第5代时脂肪前体细胞的数量已降至很低。
2.4 诱导成脂分化潜能检测
成脂诱导7 d左右,P0、P2、P5细胞镜下观察均有脂滴出现,随着诱导时间的延长,脂滴逐渐增多,变大,2周时停止诱导,油红染色显示脂滴呈橘红色,3组细胞无明显差异。PT-PCR检测,P0细胞PPARγ及LPL表达略强于P2及P5细胞,但3组PPARγ及 LPL表达均无统计学差异,P>0.05(图 4)。说明随着培养代次的增加,脂肪干细胞中间充质干细胞的含量并未减少,到第5代时仍维持了较好的干细胞特性。
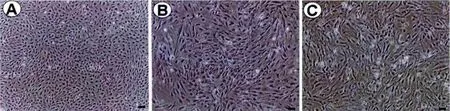
图1 不同代次 mASCs的细胞形态。 A:P0;B:P2;C:P5。 (标尺:100μm)Fig.1 Morphological observation of different passages of mASCs.A:P0;B:P2;C:P5.(Scale:100 μm)

图2 不同代次mASCs的生长曲线Fig.2 Growth curve of different passages of mASCs

图3 不同代次mASCs自发成脂RT-PCR 检测(A:P0;B:P2;C:P5。 标尺:100 μm)Fig.3 The spontaneous adipogenic ability of different passages of mASCs observed by RT-PCR(A:P0;B:P2;C:P5.Scale:100 μm)

图4 不同代次mASCs诱导成脂RTPCR 检测(A:P0;B:P2;C:P5。 标尺:100 μm)Fig.4 The adipogenic potential of different passages of mASCs observed by RT-PCR(A:P0;B:P2;C:P5.Scale:100 μm)
3 讨论
通常所说的脂肪干细胞,确切地应该叫脂肪来源细胞,基本参考文献[2]的方法从脂肪组织中分离培养而获得,是一个混杂的细胞群,除含有间充质干细胞外,还含有诸如脂肪前体细胞、成纤维细胞、内皮细胞、平滑肌细胞、血管周皮细胞等混杂细胞[16]。脂肪前体细胞是向脂肪细胞分化的特异化的前体细胞,是成熟脂肪细胞的前体,通常不经诱导亦能向脂肪细胞转化。本实验观察了各代小鼠脂肪干细胞的增殖能力、自发成脂能力及诱导成脂潜能,发现随着培养代次的增加,其增殖能力没有明显变化,自发成脂能力明显降低,而诱导成脂能力基本不变。自发成脂能力与脂肪前体细胞含量有关,而诱导成脂潜能与间充质干细胞含量有关,说明原代细胞中含有更多的脂肪前体细胞,随着培养代次的增加,含量不断减少,而间充质干细胞经多次传代仍能很好地维持干细胞特性。常规的培养体系不利于成熟脂肪细胞及脂肪前体细胞生长,多次传代培养可能使间充质干细胞优势生长,降低了脂肪前体细胞及其他混杂细胞的含量,使脂肪干细胞得到一定程度的纯化。
应用小鼠脂肪干细胞作为种子细胞时,需要根据构建组织的不同而选择不同代次的细胞。我们在应用小鼠脂肪干细胞构建组织工程化肌腱的研究中发现,应用较早代次细胞构建的组织工程化肌腱中有脂肪组织形成,而应用较晚代次(5~7代)细胞则不会有脂肪组织形成,能构建出较均质的肌腱样组织。脂肪干细胞成骨及成软骨能力均低于骨髓基质干细胞[17-18],尤其是成软骨能力,Afizah等[19]认为,脂肪干细胞仅有很弱的成软骨能力,不适合作为软骨构建的种子细胞。利用脂肪干细胞构建组织工程化软骨需要进行分选纯化,人脂肪干细胞可利用CD105分选富集软骨潜能干细胞[20],目前尚未见应用小鼠脂肪细胞在体外构建出均质组织工程化软骨的报道,需要进一步研究纯化小鼠脂肪干细胞及优化诱导方案。构建脂肪组织时,在保证细胞量足够的前提下应选择尽可能早的代次。脂肪干细胞虽具有向骨、软骨、神经、肌等多个谱系分化的潜能,但其来源于脂肪组织,具有自发成脂分化潜能,是脂肪组织工程理想的种子细胞,有望解决目前临床应用自体脂肪充填时出现的高吸收率、易液化坏死等问题。
[1] Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[2] Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[3] Chen FG,Zhang WJ,Bi D,et al.Clonal analysis of nestin(-)vi mentin(+)multipotent fibroblasts isolated from human dermis[J].J Cell Sci,2007,120(Pt 16):2875-2883.
[4] Collins CA,Olsen I,Zammit PS,et al.Stem cell function,selfrenewal,and behavioral heterogeneity of cells from the adult muscle satellite cell niche[J].Cell,2005,122(2):289-301.
[5] Du Y,Funderburgh ML,Mann MM,et al.Multipotent stem cells in human corneal stroma[J].Stem Cells,2005,23(9):1266-1275.
[6] Cowan CM,Shi YY,Aalami OO,et al.Adipose-derived adult stromal cells heal critical-size mouse calvarial defects[J].Nat Biotechnol,2004,22(5):560-567.
[7] Erickson GR,Gimble JM,Franklin DM,et al.Chondrogenic potential of adipose tissue-derived stromal cells in vitro and in vivo[J].Biochem Biophys Res Commun,2002,290(2):763-769.
[8] 李战梅,刘康,冯刚,等.生长分化因子5促进脂肪干细胞成软骨分化的实验研究[J].西部医学,2010,22(8):1380-1384.
[9] Zuk PA,Zhu M,Ashjian P,et al.Human adipose tissue is a source of multipotent stem cells[J].Mol Biol Cell,2002,13(12):4279-4295.
[10] Safford KM,Safford SD,Gimble JM,et al.Characterization of neuronal/glial differentiation of murine adipose-derived adult stromal cells[J].Exp Neurol,2004,187(2):319-328.
[11] Bacou F,el Andalousi RB,Daussin PA,et al.Transplantation of adipose tissue-derived stromal cells increases mass and functional capacity of damaged skeletal muscle[J].Cell Transplant,2004,13(2):103-111.
[12] Fischer LJ,McIlhenny S,Tulenko T,et al.Endothelial differentiation of adipose-derived stem cells:effects of endothelial cell growth supplement and shear force[J].J Surg Res,2009,152(1):157-166.
[13] Fehrer C,Lepperdinger G.Mesenchymal stem cell aging[J].Exp Gerontol,2005,40(12):926-930.
[14] Baxter MA,Wynn RF,Jowitt SN,et al.Study of telomere length reveals rapid aging of human marrow stromal cells following in vitro expansion[J].Stem Cells,2004,22(5):675-682.
[15] Bonab MM,Alimoghaddam K,Talebian F,et al.Aging of mesenchymal stem cell in vitro[J].BMC Cell Biol,2006,7:14.
[16] Yoshimura K,Shigeura T,Matsumoto D,et al.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1):64-76.
[17] Huang JI,Kazmi N,Durbhakula MM,et al.Chondrogenic potential of progenitor cells derived from human bone marrow and adipose tissue:a patient-matched comparison[J].J Orthop Res,2005,23(6):1383-1389.
[18] Im GI,Shin YW,Lee KB.Do adipose tissue-derived mesenchymal stem cells have the same osteogenic and chondrogenic potential as bone marrow-derived cells[J]?Osteoarthritis Cartilage,2005,13(10):845-853.
[19] Afizah H,Yang Z,Hui JH,et al.A comparison between the chondrogenic potential of human bone marrow stem cells(BMSCs)and adipose-derived stem cells(ADSCs)taken from the same donors[J].Tissue Eng,2007,13(4):659-666.
[20] Jiang T,Liu W,Lv X,et al.Potent in vitro chondrogenesis of CD105 enriched human adipose-derived stem cells[J].Biomaterials,2010,31(13):3564-3571.
