反义内皮素转换酶核酸表达质粒纳米粒所致内皮素的减少对哮喘小鼠气道高反应性的影响
2013-09-19周雨田
周雨田,徐 军
(1.四川省医学科学院·四川省人民医院干部科老年疾病研究所呼吸病房,四川 成都 610072;2.广州医学院广州呼吸疾病研究所国家重点试验室,广东 广州510120)
支气管哮喘(简称哮喘)是由多种细胞和细胞组分参与的气道慢性变态反应性疾病,以气道高反应性(airway hyperresponsivenes,AHR)为特点。过量表达的炎症因子内皮素(endothelin-1,ET-1)在引起哮喘变应性气道炎症及气道高反应性的过程中起着重要的作用[1],最终导致肺功能的损害。我们既往的研究提示12-烷基化壳聚糖纳米粒(12-ACSs)包裹的反义ECE核酸纳米载体能够成功地在体外气道上皮细胞表达目标核酸,发挥RNA干扰效应,减少变应原诱导的ET-1的过度生成[2]。本实验进一步探讨经过12-烷基化壳聚糖纳米粒(12-ACSs)包裹的反义内皮素转换酶(ECE)核酸表达质粒治疗后,在炎症因子内皮素减少的情况下,能否对哮喘模型小鼠肺功能构成影响。
1 材料与方法
1.1 实验动物 健康雌性Balb/c小鼠数量40只,6~8周龄,体重18~22 g,SPF级,购自中山医科大学动物房。
1.2 主要试剂和仪器 12-ACSs由天津大学材料学院刘文广教授惠赠。小鼠 IL-13和IFN-γELISA试剂盒(比利时 Biosource公司),小鼠 Endothelin(ET)ELISA试剂盒(美国Cayman公司),小鼠IL-4 ELISA试剂盒(比利时Biosource公司),酶标仪(芬兰Labsystem公司)。pEGFPN2-反义ECE表达质粒(本研究所构建),OVA购自美国Sigma公司,辣根过氧化物酶(HRP)藕联的羊抗鼠抗体(二抗IgG)、HRP藕联的抗生物素抗体购自美国Oncogene公司,乙酰甲胆碱(methacholine,Mch)购自Sigma公司,美国Buxco小鼠肺功能仪。
1.3 12-ACSs的制备 将烷基化壳聚糖与pEGFPN2-反义ECE表达质粒按质量比2∶1制备包裹反义ECE核酸的12-ACSs纳米粒。0.4μm孔径滤器过滤除菌。
1.4 变应性气道炎症模型的建立和处理 将40只小鼠按完全随机设计分为4组,每组10只。N组仅给予生理盐水致敏、激发并治疗;NM组予OVA致敏、激发并给予包裹反义ECE核酸的12-ACSs治疗;AS组为OVA致敏、激发后给予生理盐水治疗的气道炎症模型组;DNA组为OVA致敏、激发并给予裸反义ECE核酸治疗组。NM组、As组、DNA组于于第0天与第14天每只小鼠分别腹腔注射OVA致敏液0.2 m1,于第 24、25、26 天,以 1%OVA 溶液 8 m l雾化吸入,35 min/(次·天)。N组分别给予相同体积的生理盐水腹腔注射及雾化吸入。NM组、As组和DNA组于首次激发前24小时分别通过气道灌注包裹反义ECE核酸的12-ACSs(含反义ECE核酸5 μg)100 μl、0.9%生理盐水 100 μl和反义ECE 核酸5μg加 0.9%生理盐水(总量 100μl),N组用等体积0.9%生理盐水处理。
1.5 支气管肺泡灌洗 小鼠分组及处理同前,小鼠摘眼球放血后处死,气管插管,肺泡灌洗PBS 0.8ml×3次。灌洗液离心1500 r/min×10min,细胞沉淀制备细胞涂片。光学显微镜下进行细胞分类计数。
1.6 肺组织病理检查 小鼠分组及处理同前,小鼠摘眼球放血后颈椎脱臼处死,开胸取右肺组织,常规取材、脱水、石蜡包埋、制备石蜡切片、HE染色。
1.7 ELISA法检测脾细胞培养上清液细胞因子小鼠分组及处理同前,无菌分离脾细胞,以MEM完全培养基调整脾细胞浓度至2×106/ml,以1 ml/孔体积接种于24孔板,加OVA(终浓度500 mg/L)刺激的条件下,于37℃、5%CO2环境培养72 h,离心收取培养液上清液,-20℃保存待测。
1.8 增强呼气间歇(enhanced pause,Penh)的检测末次激发后48 h,用Buxco小鼠无创肺功能仪检测小鼠的Penh的变化,设定Mch激发浓度依次为0、3.12、6.25、12.5、25 和 50 g/L,记录 Penh 平均值。以生理盐水刺激时的Penh为基值,将各Penh的与生理盐水激发时的Penh值的百分比(Penh/NS%)作为气道反应性统计指标,以Penh%表示,作为小鼠气道反应性的评价指标。
1.9 统计学方法 采用SPSS 15.0软件。对各组数据(以均数±标准差表示)先进行正态检验和单因素方差齐性检验,符合正态分布的数据组间比较采用单因素方差分析,有统计学意义时采用LSD法行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 支气管肺泡灌洗液细胞学检查 与N组相比,As组、DNA组和NM组细胞总数、嗜酸性粒细胞百分比与绝对计数均增高。而治疗后NM组上述三种指标均显著低于As组和DNA组小鼠,见表1。

表1 各组支气管肺泡灌洗液细胞计数及所占比例
2.2 小鼠肺病理改变 As和DNA组小鼠支气管、细支气管上皮下和小血管可见嗜酸性粒细胞等炎性细胞浸润,气道上皮结构紊乱,部分脱落,管腔内渗出增加,上皮下充血水肿明显,亦可见炎性细胞浸润。N组小鼠与其他3组比较,肺泡结构清晰,纤毛上皮整齐,无炎性细胞的浸润及充血水肿。NM组肺部炎症改变较As组和DNA组有所减轻(图1)。
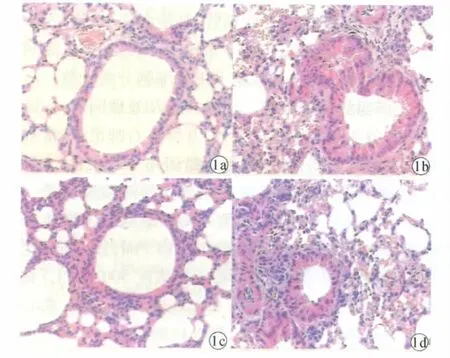
图1 肺病理改变(HE染色,400×)a.N 组,b.As组,c.NM 组,d.DNA 组
2.3 脾细胞培养上清液细胞因子检测结果 脾细胞培养上清液N组ET水平均明显低于NM组、As组和DNA组(均P<0.001),而NM组ET水平则明显低于As组和DNA组(均P<0.001),As组和DNA组差异无统计学意义(P=0.051),IL-4结果与ET相似,见表2。

表2 各组小鼠脾细胞OVA刺激培养上清液细胞因子的含量 (ng/L)
2.4 各组小鼠气道反应性 在各浓度MCh激发下,As、NM、DNA组较N组小鼠气道气道反应性明显增高,而NM组气道阻力较As及DNA组明显降低(图2)。

图2 各组小鼠气道功能
3 讨论
在既往的研究中,我们制备的12-ACSs包裹的pEGFPN2-反义ECE表达质粒纳米粒通过活体动物气道滴注,显示其可以成功地在活体动物表达,减少ET的生成[3]。我们的实验结果显示:与对照组比较,其余各组小鼠脾细胞培养上清液中ET水平均显著升高,而NM组小鼠肺匀浆上清中,ET水平明显低于 As和DNA组,表明12-ACSs包裹的反义ECE质粒能够成功在小鼠气道表达,减少了内皮素的生成,国外有研究发现ET有促进IL-4,IL-5和IL-13分泌的作用,使用ET受体拮抗剂可以阻断该作用[4],我们的结果发现炎症细胞因子IL-4的水平亦相应明显下降。作为Th2亚群的代表性细胞因子,IL-4能刺激B细胞的增殖和分化以及合成和分泌IgE,促进肥大细胞的生长,诱导淋巴细胞的粘附和嗜酸粒细胞的趋化。它还能促进粘蛋白的基因表达和杯状细胞化生。此外,IL-4还是T细胞自身分泌的生长因子,能够诱导T细胞向Th2型分化,诱导哮喘的发生[5]。从上述研究结果可以看出:通过12-ACSs包裹的pEGFPN2-反义ECE表达质粒纳米粒的治疗,减少了ET及IL-4这些炎症细胞因子的生成,从而达到减轻哮喘气道炎症的目的。
在上述结果基础上,我们进一步研究该纳米粒是否能对减轻哮喘的气道高反应性。支气管哮喘作为一种慢性气道炎症性疾病,气道高反应性是哮喘患者产生症状的主要原因。本实验12-ACSs包裹的pEGFPN2-反义ECE表达质粒纳米粒治疗后发现其对小鼠支气管哮喘的发生具有明显的保护作用。内皮素减少后可明显降低支气管灌洗液中细胞数,降低脾细胞培养液中内皮素、IL-4水平,病理切片也说明12-ACSs包裹的pEGFPN2-反义ECE表达质粒纳米粒可以减少炎症细胞的浸润,减少气道分泌物的渗出,从而降低气道炎症,由此我们推测气道炎症降低后可缓解气道高反应性,我们的实验结果证实了这一点:NM组的气道高反应性明显低于As组和DNA组。气道高反应性是哮喘的特征性表现,其具体调节机制尚不完全清楚,但已有的研究表明气道高反应性和气道炎症密切相关[6]。本研究的结果提示由于反义ECE质粒纳米粒导致的ET的生成减少,可以减轻哮喘气道炎症及相关的气道高反应性。
综上所述,给予哮喘模型小鼠气道内添加12-ACSs包裹的反义ECE质粒纳米粒治疗,可以减少ET、IL-4等炎症介质的生成,抑制炎症细胞在气道的聚集,继而达到减轻气道高反应性的目的,因此,12-ACSs包裹的反义ECE质粒治疗方法有可能发展成为支气管哮喘新的治疗策略。
[1]Murali S.Pulmonary arterial hypertension[J].Curr Opin Crit Care,2006,12:228-234.
[2]周雨田,徐军.12-烷基化壳聚糖纳米粒-反义内皮素转换酶核酸表达质粒的制备及其性质的研究[J].中国生物工程杂志,2007,27(11):20-26.
[3]周雨田,徐军.12-烷基化壳聚糖纳米粒包裹反义内皮素转换酶核酸表达质粒在哮喘基因治疗中的特征[J].中国组织工程研究与临床康复,2007,11(5):830-833.
[4]Ping C,Saimoon S,Yuushi O,etal.Endothelin-1 peptides and IL-5 synergistically increasethe expression of IL-13 in eosinophils[J].Biochemical and Biophysical Research Communications,2004,315:782-787.
[5]Ying S,Durham SR,Corrigan CJ,etal.Phenotype of cells expressing mRNA for Th2 type(interleukin 4 and interleukin 5)and Thl-type(interleukin 2 and interferon gamma)cytokines in bronchoalveolar lavage and bronchial Siopsics from atopic asthmatic and normal control subject[J].Am JRespor cellmol Biol,1998,12:477-487.
[6]张珍祥.慢性阻塞性肺疾病与哮喘气道炎症的差异[J].实用医院临床杂志,2009,6(5):5-8.
