海参溶菌酶C端多肽在毕赤酵母中的重组表达
2013-09-19姜启晨,丛丽娜,宋明徽,谭广毅,卢冬
姜 启 晨,丛 丽 娜,宋 明 徽,谭 广 毅,卢 冬
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
溶菌酶(Lysozyme,EC3.2.1.17),是一种碱性蛋白酶,专门作用于细菌的细胞壁,使细菌细胞壁中的N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4糖苷键断裂,导致细菌细胞发生裂解,产生溶菌现象,从而起到杀死细菌的作用。它广泛存在于动植物和微生物的组织、体液及分泌物中,在生物机体的免疫防御系统中发挥重要作用[1],是天然的抗菌剂、免疫增强剂和防腐剂[2]。研究表明,溶菌酶可以与带负电荷的病毒蛋白直接结合,还可以同DNA、RNA和脱辅基蛋白形成复盐,从而使病毒失活[3]。
海参溶菌酶属于i-型溶菌酶[4],与蛋清c-型溶菌酶不同,i-型溶菌酶不但可以对革兰阳性菌有抑菌作用,对于能引起水产生物病害的革兰阴性菌同样具有抑菌效果[5]。海参溶菌酶具有异构肽活性,也称为它的非酶活性,这与该溶菌酶基因的C端区域的DNA结构有关[6]。常艺海等[7]已将海参溶菌酶C端多肽基因在大肠杆菌原核细胞中得到高效表达。本研究采用具有易操作、高级的蛋白质翻译后加工修饰功能和高稳定性等特点[8]的真核毕赤酵母表达系统,将海参溶菌酶C端多肽基因连接到表达载体pPIC9K上进行分泌表达,以期为进一步研究和生产海参溶菌酶C端多肽高活性产品奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒
毕赤酵母 GS115、表达载体pPIC9K,Invitrogen公司;大肠杆菌DH5α和克隆载体pMD18-T,TaKaRa 公 司;pMD18-T-SjLys-C/DH5α,本实验室构建并保藏。
1.1.2 试剂与工具酶
限制性核酸内切酶(EcoRⅠ、NotⅠ、BglⅡ)、Taq DNA聚合酶、T4DNA连接酶、即用型蛋白质分子质量标准、DNA Ladder Marker,TaKaRa公司。质粒提取试剂盒和琼脂糖凝胶电泳DNA回收试剂盒,TIANGEN生化科技(北京)有限公司;Geneticin(G418),索莱宝科技(北京)有限公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 特异性引物设计
以海参溶菌酶C端多肽基因[6]为模版,利用Primer Premier 5.0软件,设计用于真核细胞表达系统的特异性引物 HS-C-1,HS-C-2,并分别添加EcoRⅠ和NotⅠ限制性酶切位点(下划线表示):
HS-C-1:GCGTGAATTCGTGATGGGAGGTAGTCTGG;
HS-C-2:TGCGGCCGCCTACTCAGTTGTTGCTC。
1.2.2 SjLys-C基因的扩增
以本 实 验 室 构 建 好 的 pMD18-T-SjLys-C/DH5α菌株提取的质粒为模板,PCR反应循环参数为94℃5min;94℃30s,62℃30s,72℃50s,30个循环;72℃延伸10min。产物用1.5%琼脂糖凝胶电泳检测。将PCR产物与pMD18-T Vector在T4DNA连接酶作用下进行连接,构建重组质粒pMD18-T-SjLys-C并转化至大肠杆菌(DH5α)感受态细胞中,取200μL涂布于含适量Amp、X-Gal、IPTG的LB平板培养基上,37℃过夜培养。挑选出经菌落PCR和双酶切验证正确的阳性菌株,送北京华大基因测序公司测序验证。
1.2.3 构建重组表达质粒pPIC9K-SjLys-C
将测序验证的正确的克隆质粒pMD18-TSjLys-C和表达载体pPIC9K分别用EcoRⅠ和NotⅠ双酶切,回收SjLys-C目的基因和带有黏性末端的pPIC9K载体,在T4DNA连接酶作用下16℃连接过夜,转化至DH5α菌株中。将经菌落PCR和双酶切验证及测序验证正确后的重组表达质粒命名为pPIC9K-SjLys-C。
1.2.4 pPIC9K-SjLys-C 转化毕赤酵母 GS115及筛选
将GS115感受态细胞和经BglⅡ线性化的pPIC9K-SjLys-C相混合,将其放入预冷的2mm的电转杯中,置于冰上10min,在1.5kV、200Ω的条件下电击,反应完成后立即加入1mL预冷的1mol/L的山梨醇,取350μL涂布于 MD平板,30℃培养至转化子出现,再将转化子经96孔细胞培养板培养,最后将转化子点种到不同浓度抗生素G418(0.5~4.0mg/mL)的YPD平板培养基上,30℃培养,直至长出单菌落。
1.2.5 SjLys-C基因的诱导表达
将在含G418 4.0mg/mL的YPD平板上生长的重组毕赤酵母菌株接种到10mL的BMGY液体培养基中发酵,30℃、220r/min摇床培养18h,再按1%的接种量将其转接到25mL的BMGY培养基中扩大培养,30℃、230r/min扩大培养20~24h,当菌液OD600达到4.0~5.0时,4 000r/min、4 ℃ 离心10min,弃上清,用25mL BMMY培养基重悬菌体,30℃、250r/min振荡培养,每隔24h取样1mL同时加入纯甲醇至培养液中甲醇为1.0%进行诱导表达,培养至96h。将诱导表达液在15 000r/min离心5min,上清液经TCA浓缩,沉淀其蛋白,进行SDSPAGE电泳检测。
1.2.6 重组海参溶菌酶C端多肽的抑菌活性分析
采用管碟法[9]对重组海参溶菌酶C端多肽进行抑菌活性分析。选取革兰阳性菌溶壁微球菌(Micrococcuslysodeikticus)和金黄色葡萄球菌(Staphyloccocusaureus)、革兰阴性菌副溶血弧菌(Vibrioparahaemolyticus)和铜绿假单胞菌(Pseudomonasaeruginosa)作为指示菌,分别取上述指示菌培养液200μL(浓度2.9×109CFU/mL,稀释倍数10-4)均匀涂布于LB固体平板培养基上,放入无菌牛津杯,向其加入200μL重组毕赤酵母基因工程菌的发酵液,30℃培养18h,测定抑菌圈直径。重复3次,取实验结果平均值。
2 结果与讨论
2.1 SjLys-C基因的扩增与重组克隆质粒的鉴定
以海参溶菌酶C端多肽基因为模版,设计特异性引物 HS-C-1和 HS-C-2,分别带有EcoRⅠ和NotⅠ限制性酶切位点,经PCR反应得到长度约为260bp扩增产物(图1),与预期大小一致。将构 建 好 的 pMD18-T-SjLys-C 用EcoRⅠ 和NotⅠ进行双酶切鉴定,结果显示目的带大小与预计一致。再将提取的重组质粒进行测序验证,结果表明它与SjLys-C基因序列[10]完全一致,这表明重组克隆质粒构建成功。

图1 PCR扩增目的基因Fig.1 Amplification of the target DNA by PCR
2.2 重组表达质粒的构建及验证
将测序验证正确的pMD18-T-SjLys-C 和pPIC9K分别用EcoRⅠ和NotⅠ双酶切,二者过夜连接并转化至大肠杆菌DH5α中,提取质粒并进行双酶切和菌落PCR验证。结果表明在260bp出现目的条带(图2),将该重组质粒进行测序,它与SjLys-C基因序列[10]完全一致,这表明重组表达质粒pPIC9K-SjLys-C构建成功。
2.3 重组海参溶菌酶C端多肽的诱导表达
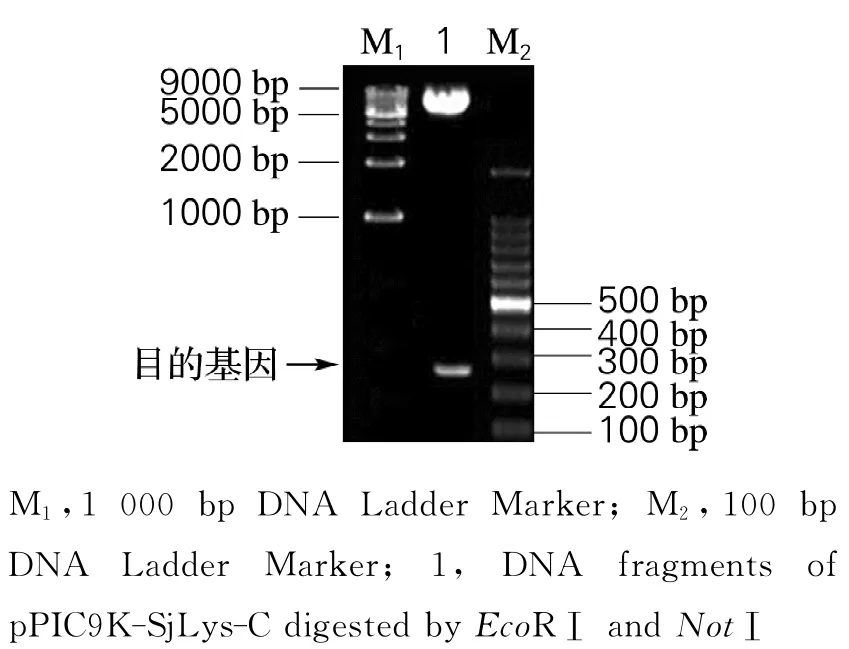
图2 重组表达质粒pPIC9K-SjLys-C的双酶切鉴定Fig.2 Identification of the recombinant plasmid pPIC9K-SjLys-C digested by EcoRⅠand NotⅠ
将线性化的重组质粒pPIC9K-SjLys-C电转化至毕赤酵母中,筛选高拷贝的工程菌株,其培养液加1%甲醇诱导表达96h,分别收集不同时间发酵液的上清液,采用12%的SDS-PAGE电泳进行目的蛋白表达分析。海参溶菌酶C端多肽基因经生物学软件分析,它编码77个氨基酸,预测分子质量为8.72ku。由图3可见,泳道2~5在分子质量为8.8ku附近出现明显的目的条带,而作为阴性对照的第一泳道在8.8ku处无条带出现,证明海参溶菌酶C端多肽在毕赤酵母GS115中得到成功表达且72h目的蛋白表达量最高。
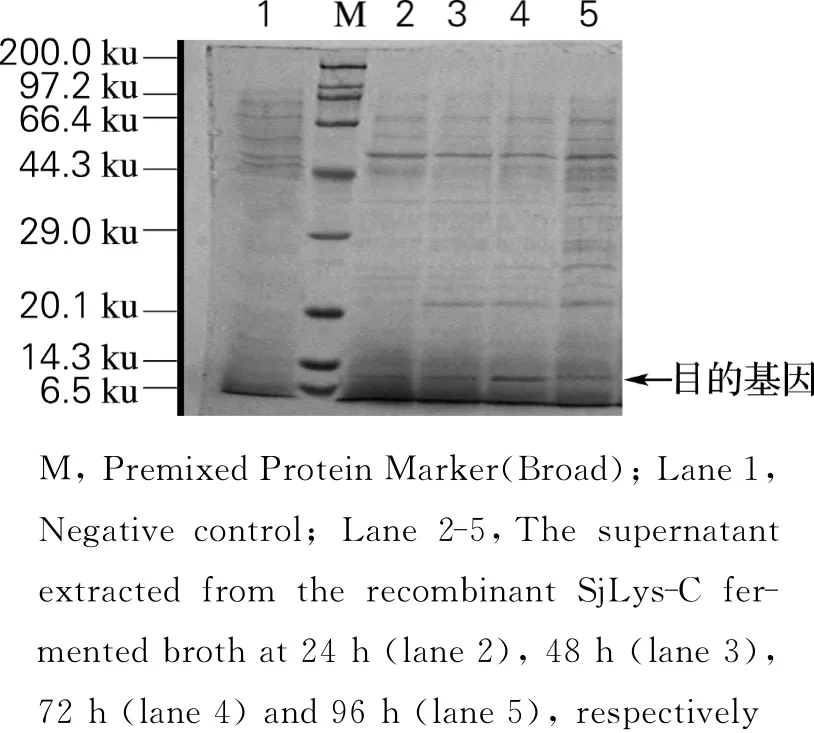
图3 重组海参溶菌酶C端多肽的SDSPAGE分析Fig.3 Expression of the recombinant SjLys-C by SDS-PAGE analysis
2.4 重组海参溶菌酶C端多肽的抑菌实验
采用管碟法测定重组海参溶菌酶C端多肽的抑菌活性。结果显示,该重组海参溶菌酶C端多肽对实验选用的4种指示菌均有不同程度的抑菌效果,其中对革兰阳性菌M.lysodeikticus和S.aureus的抑菌直径分别为10和9mm,对革兰阴性菌V.parahaemolyticus和P.aeruginosa的抑菌直径分别为17和16mm(标准差为0.45~0.61mm)。这表明重组海参溶菌酶C端多肽对革兰阳性菌和革兰阴性菌具有广谱抗菌作用(图4),尤其对引起海洋生物病害的主要致病菌副溶血弧菌和铜绿假单胞菌有更强的抑菌作用。

图4 重组海参溶菌酶C端多肽的抑菌活性Fig.4 The antibacterial activity of the recombinant SjLys-C
3 结 论
通过PCR的方法成功扩增出海参溶菌酶C端多肽基因,构建成表达质粒pPIC9K-SjLys-C,将其线性化后经电转化导入GS115中,构建并筛选出高拷贝的基因工程菌pPIC9K-SjLys-C/GS115。该工程菌的甲醇诱导发酵液经SDSPAGE电泳检测,结果成功得到重组海参溶菌酶C端多肽目的蛋白。对重组海参溶菌酶C端多肽进行抑菌活性分析,重组海参溶菌酶C端多肽对革兰阳性菌溶壁微球菌、金黄色葡萄球菌、革兰阴性菌副溶血弧菌和铜绿假单胞菌均有不同程度的抑菌效果,其中副溶血弧菌和铜绿假单胞菌是水产生物的主要致病菌,对于海水鱼类、甲壳类等多种水产动物具有严重危害,而海参溶菌酶C端多肽对这两种致病菌均显示出了较强的抑菌效果。
毕赤酵母表达系统是当前世界应用最为广泛的酵母表达系统,它不仅具有高表达、高分泌和高稳定的特点,而且可以进行翻译后的加工处理将目的蛋白分泌到细胞外,美国FDA已经评定毕赤酵母表达系统产生的基因工程产品是安全的。因此将具有抗菌活性的海参溶菌酶C端片段置于毕赤酵母表达系统中,利用工程菌高密度发酵生产大量的抗菌多肽产品,这对水产养殖业病害的预防具有非常重大的意义。本研究为进一步研究海参溶菌酶结构与功能及其C端多肽在真核系统中的表达奠定了基础,也为大规模工业化生产提供了依据。
[1]BECK G,HABICHT G S.Immunity and the invertebrates[J].Scientific American,1996,275(5):60-66.
[2]PROCTOR V A,CUNNINGHAM F E.The chemis-try of lysozyme and its use as a food preservative and apharmaceutical[J].Critical Reviews in Food Science and Nutrition,1988,26(4):359-395.
[3]JOLLÈS P,JOLLÈS J.What’s new in lysozyme research always a model system,today as yesterday[J].Molecular and Cellular Biochemistry,1984,63(2):165-189.
[4]杨西建,丛丽娜,路美玲,等.海参i-型溶菌酶基因及其编码产物的结构特点[J].中国生物化学与分子生物学报,2007,23(7):542-547.
[5]王秀霞,丛丽娜,王丹,等.海刺参i-型溶菌酶基因的重组表达及抑菌谱分析[J].生物工程学报,2009,25(2):189-194.
[6]CONG Lina,YANG Xijian,WANG Xiuxia,et al.Characterization of an i-type lysozyme gene from the sea cucumberStichopusjaponicus,and enzymatic and nonenzymatic antimicrobial activities of its recombinant protein[J].Journal of Bioscience and Bioengineering,2009,107(6):583-588.
[7]常艺海,丛丽娜,卢冬.重组海参溶菌酶基因工程菌的构建及原核表达[J].大连工业大学学报,2012,31(6):392-394.(CHANG Yihai,CONG Lina,LU Dong.Construction of recombinant bacteria for sea cucumber lysozyme and its prokaryotic expression[J].Journal of Dalian Polytechnic University,2012,31(6):392-394.)
[8]隋少飞,陈松林.巴氏毕赤酵母表达系统的特点及其研究进展[J].生物技术通报,2004(3):1-4.
[9]BU Xingjiang,DU Xinjun,ZHOU Wenjie,et al.Molecular cloning,recombinant expression,and characterization of lysozyme from Chinese shrimpFenneropenaeuschinensis[J].Chinese Journal of Biotechnology,2008,24(5):723-732.
[10]常艺海,丛丽娜,卢冬,等.重组海参溶菌酶C端基因(SjLys-C)的可溶性表达和抑菌活性分析[J].农业生物技术学报,2012,20(4):443-450.
