大肠杆菌O157∶H7异硫氰酸荧光素标记抗体的制备及评价
2013-09-19秦亚楠孟日增潘风光
方 珍,鞠 文,秦亚楠,孟日增,3,潘风光
(1.吉林大学军需科技学院食品质量与安全教研室,吉林 长春 130062;2.吉林大学公共卫生学院卫生检验教研室,吉林 长春 130021;3.吉林出入境检验检疫局检验检疫技术中心,吉林 长春 130062)
O
157∶H7是大肠杆菌中重要血清型,其感染剂量极低,一次摄入10个活菌就可致病[1]。因此,做好食品中E.coliO157∶H7的检测具有重要的意义。微生物检测方法很多,包括细菌培养法、聚合酶链式反应(PCR)法及酶联免疫吸附法等,但均 有 不 足 之 处[2-5]。 免 疫 荧 光 技 术(immunof1uorescence technique)是用荧光素标记的抗体检测抗原或抗体的免疫学标记技术,又称荧光抗体技术。所用的荧光素标记抗体通称为荧光抗体,系由荧光素 (常用异硫氰基荧光素,fluorecein isothiocyante,FITC),以化学方法与效价较高、活性较强的抗体共价结合后制备而成[6]。国内外关于FITC标记蛋白应用于免疫荧光检测早有报道,但对于E.coliO157∶H7免疫荧光检测的研究尚未见报道。进行免疫荧光检测的关键在于制备纯度高、效价高、特异性好、稳定性好的荧光素标记抗体,完成抗体的前期准备,对于E.coliO157∶H7免疫荧光检测方法的建立具有重要作用。本实验旨在制备高效价高纯度的E.coliO157∶H7多克隆抗体,通过优化FITC标记抗体的条件,制得能广泛适用于E.coliO157∶H7免疫荧光检测的FITC标记多克隆抗体。
1 材料与方法
1.1 实验动物、菌株及试剂 新西兰大耳兔7只,体质量约2.5kg,购自长春市生物制品所。大肠杆菌O157∶H7标准菌株由吉林出入境检验检疫技术中心微生物实验室保存。FITC(美国Sigma公司),SDS-PAGE试剂盒、BCA蛋白含量测定试剂盒(康为世纪公司),HiTrap Protein G纯化柱(美国GE公司)。
1.2E.coli多克隆抗体的制备 ①抗原的制备:标准大肠杆菌O157∶H7菌株于LB培养基增菌培养8h,离心弃培养基,生理盐水洗3次,计数。甲醛灭活后超声破碎1h。② 抗血清制备:按传统方法制备疫苗,取菌量为2×108cfu的疫苗对家兔进行背部多点免疫4次。颈动脉无菌采血,分离免疫血清,间接ELISA法测定效价[7-8]。
1.3 抗体的纯化 采用辛酸-饱和硫酸铵法粗提抗体IgG[9-10],所 得 蛋 白 经 0.22μm 过 滤,采 用HiTrap Protein G蛋白纯化系统进行进一步纯化,通过按5%梯度增加蛋白洗脱液的方法确定最佳洗脱方法。纯化效果通过聚丙烯酰胺凝胶蛋白电泳法(SDS-PAGE)进行验证。采用BCA蛋白测定试剂盒测定抗体蛋白浓度。
1.4 FITC标记多克隆抗体的制备 取抗体蛋白总量为1mg适量体积溶液,用pH 9.0的碳酸盐缓冲液对抗体溶液进行透析,使蛋白处于碱性环境。根据文献报道选择标记条件[11-12]。①确定最佳反应比值:按照FITC与蛋白含量比值分别为1∶20、1∶10、3∶20计算FITC用量,逐滴加入溶于二甲基亚砜的FITC,室温避光反应4h,进行FITC标记。②确定最佳标记抗体反应条件:由所得到的最佳比值计算FITC用量,按照反应条件为4℃、2h,20℃、4h,37℃、30min,进行FITC标记。反应后液体用超滤离心管6 000r·min-1离心20min,反复多次,收集每次离出液,测定荧光值(F485/535),直至离出液无荧光值。测定标记后F485/535值,结合显著性差异分析及实际情况,得到最佳FITC与抗体含量比值和反应条件。
1.5 荧光标记抗体与混合菌液反应 取E.coliO157∶H7活菌液100μL与S.aureus混匀,滴至载玻片上,火焰固定30s自然风干后分别滴加10倍比稀释的FITC标记多克隆抗体50μL,滴加伊文氏兰染液覆盖染色15min,蒸馏水洗涤干净后于荧光显微镜下观察荧光抗体与菌液反应的结果。
1.6 统计学分析 采用SPSS 10.0软件进行统计学处理,F485/535以±s表示,组间比较采用单因素方差分析。
2 结 果
2.1 血清效价测定结果 4次免疫后效价见图1。第2、3、4号兔血清1∶25 600稀释时,A450≥2.1倍阴性对照值,故选择2、3、4号兔进行纯化制备多克隆抗体。

图1 每次免疫后兔血清效价结果Fig.1 The antibody titers of rabbit serum after every immunization
2.2 多克隆抗体的纯化结果 经辛酸-饱和硫酸铵法粗提的血清由5%梯度洗脱,结果见图2。收集100%洗脱液洗脱蛋白,即第3峰值所得蛋白由超滤离心管浓缩,SDS-PAGE结果见图3,经35%、100%梯度洗脱所得抗体蛋白条带出现在55 000与20 000处,与文献[13]相符,说明所得为多克隆抗体IgG。浓缩后抗体蛋白含量由BCA试剂盒测定结果为23.6g·L-1。
2.3 多克隆抗体特异性检测 应用间接ELISA法测定多克隆抗体特异性,以未免疫健康兔血清为阴性对照。所制多克隆抗体与9种肠杆菌反应测得A450(测定值-PBS对照孔值)分别为:沙门氏菌0.095,阴沟肠杆菌0.084,克雷伯杆菌0.091,粪肠球菌0.084,坂崎肠杆菌0.103,黏质沙雷杆菌0.071,奇异变形杆菌 0.079,单增李斯特菌0.104,E.coliO157∶H7 1.2,阴性 血清对照0.069。所制得多克隆抗体与大肠杆菌O157∶H7外其他8种肠杆菌无交叉反应,特异性良好。

图2 不同浓度洗脱液进行HiTrap Protein G纯化多克隆抗体结果Fig.2 The results of purified polyclonal antibody under the different doses of elution conditions
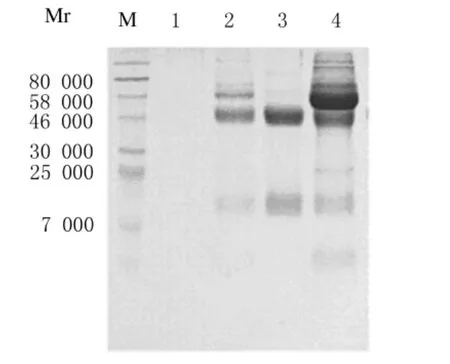
图3 不同条件纯化蛋白SDS-PAGE结果Fig.3 The SDS-PAGE results of purified protein under different conditions
2.4 多克隆抗体FITC标记结果 应用不同FITC∶抗体蛋白含量对抗体进行标记,测定5次所得标记抗体的 F485/535分别是:1∶20为58 207.00±8.27,1∶10 为 71 368.00±2.38,3∶20为78 231.00±8.63。在不同反应时间与反应温度条件下测定5次所得标记抗体的F485/535值分别是:4℃、2h为70 912.00±6. 41;20℃、4h为70 781.00±8. 30;37℃、30min为71 094.00±3.65。对3组不同FITC∶抗体蛋白含量比值条件进行标记所得F485/535进行两两比较,FITC∶蛋白含量为1∶10与1∶20所得标记产物F485/535值比较差异有统计学意义(P<0.05),FITC∶蛋白含量为1∶10与3∶20所得标记产物F485/535值比较差异无统计学意义(P>0.05)。
2.5 荧光标记抗体反应观察结果 荧光显微镜下观察荧光标记抗体与混合菌液反应的结果见图4。无荧光照射下混合菌液,菌体由于伊文氏兰染色显示红色(图4A,封三)。1∶1 000倍稀释荧光抗体与菌液反应,在中度荧光强度照射下15min时,由于S.aureus无荧光标记,无法在视野下观察到(图4B,见封三)。
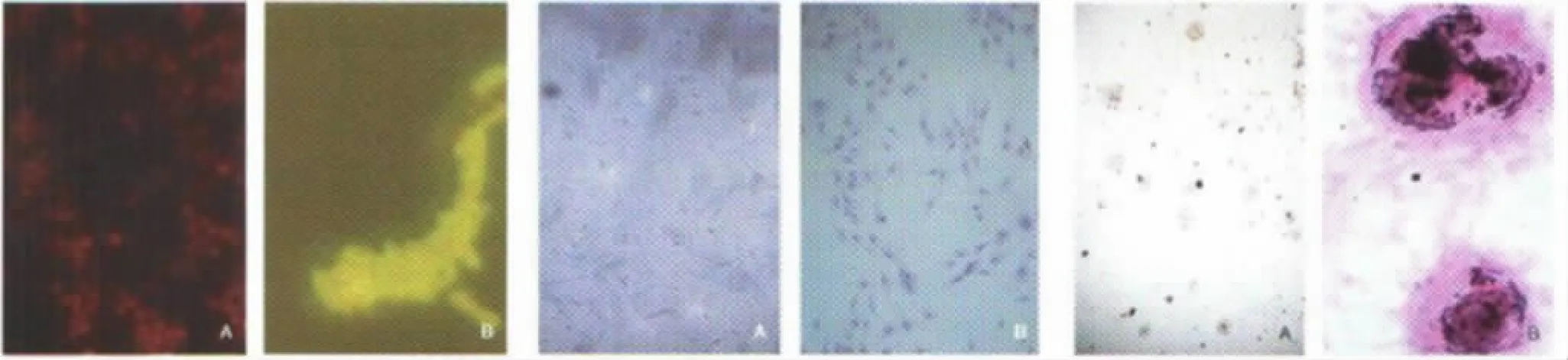
图4 显微镜下抗体与E.coli O157∶H7和S.aureus混合液反应观察结果Fig.4 The observation results of the reaction of antibody with mixed liquid of E.coli O157∶H7and S.aureus under microscope
3 讨 论
本实验在应用HiTrap Protein G进行抗体纯化过程中创新性地采用了梯度增加洗脱液的方法,血清在由35%洗脱液冲洗条件下即可出现峰值,且由间接ELISA验证与抗原无阳性反应;将35%、100%洗脱液洗脱蛋白与100%洗脱液直接洗脱蛋白行SDS-PAGE对比纯化效果,经改进后即35%、100%洗脱的HiTrap Protein G蛋白纯化方法所得多克隆抗体条带数目更少、目的条带更清晰,说明改进后得到抗体比直接洗脱效果更好,其原因可能为少量与IgG蛋白性质相近的蛋白可被纯化柱所吸附,在35%洗脱液条件下(pH约为4.3)即被洗脱,但具体机制还需进一步探究。与已有文献报道的其他抗体纯化效果比较,应用此法纯化抗体所得纯度明显高于辛酸-饱和硫酸铵提取法[14]、抗原吸附法[14]及 DEAE-Sephadex A50亲和层析法[15],且Protien G柱可重复利用,不同种类抗体可共用一个纯化柱,降低了纯化成本;纯化系统自动进液与收集,电脑操作降低了人力消耗,操作简便。因此,此改进纯化方法即HiTrap Protein G 35%、100%二梯度洗脱效果较好,可推广应用于抗体纯化。
本研究结果显示:考虑到节约标记成本及后期FITC更易去除完全的原因,选择标记时FITC与蛋白量最佳比值为1∶10;在3种反应条件下,反应得到的荧光值比较差异无统计学意义;不同标记时间与标记温度下所得标记抗体的F485/535值接近,无需做差异性分析,即3种不同反应条件均对FITC标记无影响。考虑到抗体在低温下最易保持其与抗原反应的能力,本文作者将标记后抗体稀释1 000倍与抗原反应,结果发现:37℃条件下标记的抗体与抗原结合相对较少,菌体荧光不及其他条件下明亮,故不选择37℃、30min作为最佳反应条件;同时,由于4℃条件下进行搅拌反应需要具备的实验环境较难达到,且反应时间较长,故选择20℃、2h作为最佳FITC标记反应条件。
本实验中可见抗体不与S.aureus发生抗原抗体反应,也无明显荧光素吸附杂蛋白及目标菌之外其他菌体的情况发生,说明所制备的FITC标记多抗抗性良好、抗体纯度高、荧光强度高、持续时间长、特异性好,可应用于免疫荧光法检测E.coliO157∶H7。
综上所述,免疫荧光检测因其操作简便、检测时间短、灵敏性良好及特异性强等优点成为致病菌定性检测的一种重要方法。本实验改进了抗体纯化技术,优化了FITC标记抗体的条件,制备出的FITC标记抗体荧光强度高,持续时间长,特异性良好,为建立E.coliO157∶H7免疫荧光检测方法完成了关键步骤。
[1]杨小鹃,吴清平,张菊梅,等.动物性食品中大肠杆菌O157∶H7多重PCR检测方法的建立 [J].中国卫生检验杂志,2007,17(11):1951-1953.
[2]宋宏新,李 宏,邢 佩.食品中大肠杆菌O157∶H7的选择性培养与检测方法研究 [J].陕西科技大学学报,2008,26(1):64-67.
[3]Ghinwa NJ,Pierre B,Julie C,et al. Activation of nanoparticles by biosorption forE.colidetection in milk and apple juice [J].Appl Biochem Biotechnol,2010,162(2):460-475.
[6]赵志晶,刘秀梅.出血性大肠杆菌单克隆抗体的制备与鉴定 [J].卫生研究,2002,31(2):108-111.
[4]余 抒,罗 萍,陈洪章,等.抗肠出血性大肠杆菌O157∶H7EspA单克隆抗体的制备及其特性鉴定 [J].细胞与分子免疫学杂志,2007,23(7):657-659.
[5]陈庆森,冯永强,黄宝华,等.食品中致病菌的快速检测技术的研究现状与进展 [J].食品科学,2003,24(11):148-152.
[6]Huang B,Yin Y,Lu L,et al.Preparation of high-affinity rabbit monoclonal antibodies for ciprofloxacin and development of an indirect competitive ELISA for residues in milk [J].Zhejiang Univers Sci B,2011,11(10):812-818.
[7]Balvinder KM,Minakshi P,Baldev RG,et al.Comparative efficacy of immunological,molecular and culture assays for detection of group A rotavirus from faecal samples of buffalo(Bubalus bubalis)calves [J].Trop Anim Health Prod,2010,42(8):1817-1820.
[8]闫东明,于师宇,任洪林,等.石房蛤毒素单克隆抗体的制备及其特性研究 [J].中国畜牧兽医,2011,38(3):73-76.
[9]王志祥,王静梅,王耀峰.单核增多性李氏杆菌多克隆抗体的制备及纯化 [J].石河子大学学报,2003,7(1):4-6.
[10]武 薇,韩克光.两种方法纯化兔抗绵羊肺炎支原体IgG的比较 [J].中国动物检疫,2010,27(2):31-32.
[11]李 铮,褚丽芸,郑爱萍.FITC标记胰岛素的合成、纯化及表征 [J].中国医药指南,2011,16(9):8-10.
[12]唐惠玲,陈 涛,王 莹,等.虫草多糖荧光标记的方法学研究 [J].药学与临床研究,2010,18(3):279-281.
[13]刘生杰,余为一.免疫球蛋白IgG和IgM分离纯化技术现状与展望 [J].阜阳师范学院学报:自然科学版,2006,23(3):27-31.
[14]郎 婧,金 敏,王新为,等.大肠杆菌O157∶H7多克隆抗体纯化 [J].解放军预防医学杂志,2008,26(4):238-241.
[15]吴晓萍,廖爱琳,章超桦,等.企鹅珍珠贝镉金属硫蛋白的分离纯化及其多克隆抗体的制备 [J].水产学报,2011,35(6):816-823.
