5-ALA治疗和hTERT mRNA的反义寡核苷酸联合应用对人卵巢癌细胞的杀伤作用及其机制
2013-09-19魏晓强杨绍文张友忠
魏晓强,唐 猛,杨绍文,张友忠
(1.山东大学齐鲁医院妇科,山东 济南 250012;2.青岛大学医学院第二附属医院胸外科,山东 青岛 266042)
卵巢癌是女性生殖器系统常见的恶性肿瘤,发病率位于女性生殖系统恶性肿瘤第三位[1]。由于卵巢癌发病隐匿,大多数患者首次确诊时已到中晚期,临床上对于卵巢癌的治疗主要是采用手术和以铂类为主的联合化疗,然而肿瘤细胞对化疗药物极易产生耐药,影响其疗效,导致晚期卵巢癌5年生存率仍在30%左右[2]。因此探究新的有效的综合治疗方法尤为必要。光动力治疗(photodynamic therapy,PDT)是一种新型的医疗技术,其基本原理是机体接受光敏剂后一定时间内,光敏剂可特异地存留在肿瘤组织中,此时以特定波长的光照射肿瘤,可产生活性氧,破坏肿瘤细胞和组织,最终达到治疗肿瘤的目的[3]。反义寡核苷酸(antisense oligodeoxynucleotides,ASODN)是指能够特异性抑制一个基因转录或翻译的短小RNA片段。ASODN利用反义技术设计与异常激活或有害基因及其mRNA互补的反义寡核苷酸,特异性地封闭那些基因使其不表达或低表达,从而达到减少基因产物,抑制细胞异常增生的作用。端粒酶是一种特殊的核糖核蛋白聚合酶,在大多数的癌细胞中证实端粒酶能以自身的RNA作为模板在染色体末端逆转录合成端粒DNA,与细胞的永生化过程、肿瘤的发生发展有密切关联[4]。端粒酶由3个主要部分组成:端粒酶 RNA(human telomerase RNA,hTR)、端粒酶相关蛋白(telomerase assoscciated protein,TP)、端粒酶逆转录酶又称人端粒酶催化亚基(human telomerase reverse transcriptase,hTERT)。在端粒酶活化过程中,hTERT是负责调节端粒酶活性和延长细胞生命周期的重要元素,是决定端粒酶活性的重要限速因子[5]。近年来的研究[6]结果显示:hTERT的反义寡核苷酸(hTERT ASODN)能明显抑制端粒酶活性和癌细胞生长,hTERT已经成为抑制恶性肿瘤细胞增殖的重要靶点。目前的研究[7-9]显示:化疗药物与 hTERT ASODN联合应用可增强肿瘤细胞对化疗药物的敏感性,而关于PDT与hTERT ASODN联合应用的疗效尚无相关研究。本实验观察光敏剂5-氨基乙酰丙酸(5-aminolevulinic acid,5-ALA)PDT联合hTERT mRNA的ASODN对卵巢癌细胞的杀伤作用,并探讨其与PDT诱导细胞凋亡作用的关系。
1 材料与方法
1.1 细胞、主要试剂和仪器 人卵巢癌3AO细胞由山东大学齐鲁医院生物工程中心提供;RPMI 1640培养液和胎牛血清购自美国Hyclone公司,5-ALA购自上海红绿光敏剂研究所,胰蛋白酶、二甲亚砜(DMSO)和四甲基偶氮唑蓝(MTT)购于美国Sigma公司,RT-PCR试剂盒、脂质体2000购于美国Invitrogen公司,膜联蛋白(Annexin)-Ⅴ-异硫氰酸荧光素(FITC)凋亡检测试剂盒购于北京贝博公司;FACScalibur流式细胞仪为美国Becton Dickinson公司产品,ASODN和端粒酶正义寡核苷酸 (sense oligodeoxynucleotides,SODN)由上海生工生物工程有限公司合成(根据hTERT mRNA翻译起始区的序列,选择设计并合成互补于起始密码子的ASODN 片 段, 序 列 为 5′-GAGCGCGCGGCATCGCGG-3′,同时合成一段SODN序列作为对照,为 5′-CCGCGATGCCGCGCGCTC-3′,序列均经计算机网上检索证实与hTERT基因以外的已知人类基因无同源性,每条寡核苷酸链的碱基均进行全硫代磷酸化修饰,无菌水溶解,-20℃ 保存)。
1.2 细胞培养 人卵巢癌3AO细胞接种在含10%新鲜胎牛血清、100U·mL-1青霉素、100U·mL-1链霉素的RPMI 1 640培养液中,置于37℃、5%CO2孵箱中培养,隔天换液1次,取对数生长期细胞用于实验。
1.3 细胞分组 将细胞分为hTERT ASODN转染组、hTERT SODN 转染组、5-ALA PDT组、hTERT ASODN转染+5-ALA PDT组、hTERT SODN转染+5-ALA PDT组和空白对照组。
1.4 MTT法测定细胞增殖抑制率 取处于对数生长期的人卵巢癌3AO细胞,调节细胞密度为1×105mL-1,接种于96孔培养板中,培养24h后加入不含血清的RPMI 1640培养液稀释的5-ALA(浓 度 分 别 为 0、0.10、0.25、0.50、1.00、2.00和4.00mmol·L-1),每组3个复孔。在孵箱内避光培养4h,将含药液的培养基弃去,以波长630nm的激光照射各孔细胞,照射的激光能 量 密 度 分 别 为 0、1.25、2.50、5.00 和10.00J·cm-2,照光时遮蔽非照光孔以避免光的散射影响实验结果。照光后弃去含光敏剂的培养液,每孔加入200μL RPMI 1640完全培养基,置于37℃、5%CO2孵箱,分别继续培养24h,弃去培养液,每孔加入180μL新鲜无血清RPMI 1640培养液和20μL质量浓度为5g·L-1MTT溶液,37℃避光孵育4h。小心吸弃孔内培养液上清,每孔加入150μL DMSO,避光振荡10min后,以490nm为测量波长在全自动酶标仪上测定各孔的吸光度(A)值,各平行孔的A值取平均数。细胞增殖抑制率(%)= [(对照组A值-空白组A值)-(实验组A值-空白组A值)]/(对照组A值-空白组A值)×100% 。实验重复3次以上,计算均值。
1.5 寡核苷酸转染 人卵巢癌3AO细胞以3×105mL-1接种于6孔板中,按照OligofectamineTMReagent说明书步骤转染寡核苷酸,转染前细胞达到50%~70%融合度后,用含有0、0.1、0.5和1.0μmol·L-1hTERT ASODN及SODN的无血清培养基转染细胞。转染4~6h,弃去含寡核苷酸-脂质体复合物的培养基,更换成含新生牛血清的全培养基,在孵箱内培养24h。
1.6 RT-PCR法检测hTERT基因的表达 取1×106个细胞,按Tripure试剂盒说明书提取细胞总RNA,逆转录成cDNA,然后以cDNA为模板,以GAPDH作为内对照进行PCR扩增。PCR反应条件为:在50μL的反应体系中,加入3μL cDNA、5μL 10×Ex Taq 缓冲液、1.25UEx Taq、4μL 2.5mmoL·L-1的dNTPs、上下游引物各lμL,以ddH2O补充至50μL,94℃预变性5min;然 后 94℃、30s,63℃、30s,72℃、30s,共30个循环。扩增产物进行2%琼脂糖凝胶电泳,电泳后紫外线下观察结果,采用凝胶成像系统摄取图像,分析、计算hTERT/GAPDH灰度比值,以灰度比值作为相对含量指标。实验重复3次。
1.7 MTT法测定各组细胞增殖抑制率 取对数生长期肿瘤细胞,常规消化后制成单细胞悬液,调整细胞浓度为每孔1×104个接种于96孔板,每孔200μL,于37℃、5%CO2饱和湿度的培养箱孵育24h,待细胞贴壁后,分别加入RPMI 1640培养基稀释的 0.5μmol·L-1hTERT ASODN 和SODN转染细胞,空白对照组加入等量无血清培养基,24h后hTERT SODN 转染组、hTERT ASODN转染组及空白对照组更换新鲜完全培养基,5-ALA PDT 组、hTERT ASODN 转染 +5-ALA PDT 组和 hTERT SODN 转染 +5-ALA PDT组更换为含0.5mmol·L-15-ALA的培养基避光培养4h,以波长630nm的激光照射各孔细胞,照射的激光能量密度为2.50J·cm-2,照光时遮蔽非照光孔以避免光的散射影响实验结果。照光后弃去含光敏剂的培养基,每孔加入200μL RPMI 1640完全培养基,置入37℃、5%CO2孵箱,分别继续培养。分别于寡核苷酸转染后12、24和48h(联合5-ALA治疗组为5-ALA PDT治疗后12、24和48h)收集细胞,采用MTT法检测细胞增殖抑制率,计算方法同1.4。
1.8 流式细胞术检测各组细胞凋亡率 按照膜联蛋白(Annexin)-V-异硫氰酸荧光素(FITC)凋亡检测试剂盒(北京贝博公司)提供的说明书进行操作。常规消化细胞,冰PBS液洗涤2次后悬浮于400μL结合缓冲液中,加入5μL Annexin-VFITC 15min,10μL碘化丙啶(PI)5min,采用流式细胞术检测并分析细胞凋亡率。细胞凋亡率=[Annexin V(+)/PI(-)细胞数+Annexin V(+)/PI(+)细胞数]/检测细胞数×100%。
1.9 统计学分析 应用SPSS 13.0统计软件进行统计学处理。各组细胞不同干预措施后的增殖抑制率、寡聚核苷酸转染后hTERT/GAPDH灰度比值以±s表示,组间比较采用单因素方差分析,多个样本均数间的两两比较采用SNK-q检验。
2 结 果
2.1 各组人卵巢癌3AO细胞增殖抑制率 在相同的激光能量密度的照射下,当5-ALA摩尔浓度在0.10~2.00mmol·L-1时,人卵巢癌3AO细胞的增殖抑制率随着5-ALA摩尔浓度的增加而显著增高(P<0.05)。但5-ALA 的摩 尔浓度 升 高 至2.00~4.00mmol·L-1时,不 同 激 光 能 量 组 中2组细胞的增殖抑制率比较差异无统计学意义(0J·cm-2,2.59%±0.50%vs4.90%±1.08%;1.25J·cm-2,55.54% ±4.72%vs57.67% ±5.87%;2.50J·cm-2,68.88% ±6.06%vs70.89% ±5.38%;5.00J·cm-2,75.76% ±6.02%vs78.14% ±7.34%;10.00J·cm-2,78.35%±6.85%vs82.65% ±6.94%) (P>0.05)。当5-ALA浓度相同时,随着激光能量密度的增强,其对人卵巢癌3AO细胞的增殖抑制率显著升高。根据实验结果选择0.5mmol·L-15-ALA+激光能量2.50J·cm-2组用于后续联合治疗。见图1。
2.2 各组人卵巢癌3AO细胞中hTERT mRNA表达水平 与空白对照组比较,不同浓度hTERT ASODN转染人卵巢癌3AO细胞后,hTERT mRNA表达水平呈浓度依赖性下调。0、0.1、0.5和1.0μmol·L-1ASODN转染组hTERT mRNA与内参吸光度之比(hTERT/GAPDH)分别为1.49±0.17、1.32±0.18、0.22±0.05和0.11±0.04。其中0.5和1.0μmol·L-1ASODN转染组hTERT/GAPDH与空白对照组比较差异有统计学意义(P<0.05);当 浓 度 继 续 降 低 至0.1μmol·L-1时,hTERT/GAPDH 与空白对照组比较差异无统计学意义(P>0.05)。选择0.5μmol·L-1ASODN 用 于 后 续 联 合 治 疗。SODN对人卵巢癌3AO细胞hTERT mRNA表达无显著影响。见图2。

图1 5-ALA PDT作用后各组人卵巢癌3AO细胞的增殖抑制率Fig.1 Inhibitory rates of proliferation of human ovarian carcinoma 3AO cells after treated with different concentrations of 5-ALA PDT

图2 各组人卵巢癌3AO细胞中hTERT mRNA水平电泳图Fig.2 Electrophoregram of hTERT mRNA levels of human ovarian carcinoma 3AO cells in various groups
2.3 各组细胞的增殖抑制率 5-ALA PDT(5-ALA浓度为0.50mmol·L-1,激光能量密度为2.50J·cm-2)与0.5μmol·L-1hTERT ASODN及SODN分别及联合作用于人卵巢癌3AO细胞的MTT 结果显示:5-ALA PDT 组和 hTERT ASODN转染组均能明显抑制人卵巢癌3AO细胞的增生,与空白对照组比较差异有统计学意义(P<0.05);而hTERT SODN转染组对人卵巢癌3AO细胞的抑制作用与空白对照组比较差异无统计学意义(P>0.05)。hTERT ASODN 转染+5-ALA PDT组细胞生长抑制率高于5-ALA PDT组和hTERT ASODN组(P<0.05)。且细胞生长抑制率具有时间依赖性,随着作用时间的延长,hTERT SON转染+5-ALA PDT组对细胞生长的抑制作用越明显,48h达到高峰。hTERT SODN转染+5-ALA PDT组人卵巢癌3AO细胞的增殖抑制率与5-ALA PDT组比较差异无统计学意义(P>0.05)。见表1。
表1 各组人卵巢癌3AO细胞的增殖抑制率Tab.1 Inhibitory rates of proliferation of human ovarian carcinoma 3AO cells in various groups [η/(±s)%]
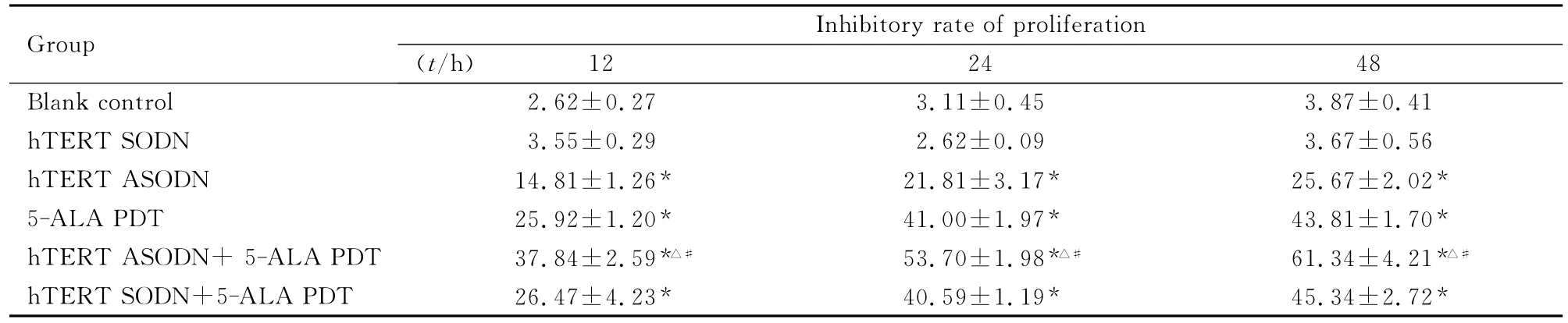
表1 各组人卵巢癌3AO细胞的增殖抑制率Tab.1 Inhibitory rates of proliferation of human ovarian carcinoma 3AO cells in various groups [η/(±s)%]
* P<0.05 vs blank control group;△P<0.05 vs 5-ALA PDT group;#P<0.05 vs hTERT ASODN group.
Group Inhibitory rate of proliferation(t/h)12 24 48 Blank control 2.62±0.27 3.11±0.45 3.87±0.41 hTERT SODN 3.55±0.29 2.62±0.09 3.67±0.56 hTERT ASODN 14.81±1.26* 21.81±3.17* 25.67±2.02*5-ALA PDT 25.92±1.20* 41.00±1.97* 43.81±1.70*hTERT ASODN+5-ALA PDT 37.84±2.59*△# 53.70±1.98*△# 61.34±4.21*△#hTERT SODN+5-ALA PDT 26.47±4.23* 40.59±1.19* 45.34±2.72*
2.4 各组卵巢癌细胞的凋亡率 Annexin V/PI双染色,hTERT ASODN可进一步提高5-ALA PDT诱导的细胞凋亡率。采用5-ALA PDT(5-ALA浓度为 0.50mmol· L-1,激 光 能 量 密 度 为2.50J·cm-2)作用于人卵巢癌3AO细胞,5-ALA PDT 组细胞凋亡率仅为21.19%,hTERT ASODN转染组细胞凋亡率为12.79%,hTERT ASODN转染+5-ALA PDT组细胞凋亡率增至29.28%。见图3(插页二)。
3 讨 论
PDT是近年来随着光纤技术、激光医学和内镜技术发展而兴起的一种治疗恶性肿瘤的新方法。与常规的手术、放化疗等疗法比较,PDT具有创伤小、毒性小,选择性、适用性、重复性好,可姑息治疗,保持器官的完整性等优点,目前已开始应用于多种恶性肿瘤的治疗,并日渐成为肿瘤治疗的新手段。由于目前使用的激光及其他照射光在组织中的穿透度有限,因此单纯PDT有一定的局限性。近年来,与其他方法结合已成为PDT治疗肿瘤的一个发展方向,这些方法包括通过加入与纳米粒子结合增加肿瘤组织中的光敏剂含量[10]、光敏剂与抗肿瘤单克隆抗体结合增强其对肿瘤细胞杀伤作用[11]及与免疫疗法相结合[12]等。随着基因技术的发展,与基因技术结合也成为PDT研究的一个新的方向[13]。
2000年以来,5-ALA作为一种内源性光敏剂被美国FDA被批准应用于临床研究,其本身不具有光敏活性,外源性5-ALA进入体内,能够被增生活跃的肿瘤细胞特异性吸收并沉积,并在细胞内转化成光敏物质原卟啉IX(PpIX)[14],在特定波长的光辐射下产生大量单态氧及其他活性氧成分,从而导致该部位的肿瘤细胞及组织发生光损伤。本研究结果显示:5-ALA PDT对人卵巢癌3AO细胞的增生抑制作用随着光敏剂浓度的增加和激光能量的增大而增加。当光敏剂摩尔浓度>2.0mmol·L-1时,在相同激光能量密度照射下,PDT效应达平台期,此时再增加光敏剂摩尔浓度其细胞毒性作用并未显著提高。PpIX是体内血红素生物合成的前体物质,正常情况下这种合成途径受体内机体负反馈机制调节,体内无过剩的PpIX。因此当细胞内的PpIX浓度达到一定程度(饱和)时,细胞可通过负反馈调节机制来控制PpIX的合成,使细胞内PpIX的浓度不会随着5-ALA浓度的增加而无限增加[15-16]。因此,本文作者也推测:当5-ALA摩尔浓度>2.00mmol·L-1,人卵巢癌3AO细胞内的PpIX浓度已达到了饱和,因此其介导的光动力作用也未继续增强。
端粒酶是一种以自身RNA为模板,将端粒DNA合成至染色体末端的核糖核蛋白复合物,端粒酶不断修复由细胞分裂引起的端粒缩短,维持端粒长度,使细胞发生永生化或癌变[4]。hTERT是决定端粒酶活性的限速因子,主要表达于肿瘤细胞[17]。本实验设计并合成了特异性的hTERT ASDON,并转染人卵巢癌3AO细胞发现:hTERT ASDON以浓度依赖方式抑制hTERT mRNA的表达,而hTERT SDON对hTERT mRNA的表达无明显影响,提示hTERT ASDON是较为理想的端粒酶活性抑制剂。
本研究对转染了hTERT ASDON和hTERT SDON的人卵巢癌3AO细胞进行PDT处理,并与仅用hTERT ASDON、hTERT SDON转染或仅用PDT法进行比较,5-ALA PDT 组及 hTERT ASODN转染组均能明显抑制人卵巢癌3AO细胞的增殖,其对细胞的杀伤作用在24h达到高峰,hTERT SODN转染组对人卵巢癌3AO细胞无明显增殖抑制作用。hTERT ASDON转染+5-ALA PDT组的细胞增殖抑制率明显增高,对细胞的抑制作用可持续至48h,可能与转染hTERT ASODN后,PDT对细胞的杀伤作用形成了一种持续作用。进一步的凋亡分析结果显示:5-ALA PDT与hTERT ASDON的联合作用可增强其对人卵巢癌3AO细胞的促凋亡作用,提示联合治疗所致的增殖抑制机制可能与其促进细胞凋亡有关。
[1]Jemal A,Siegel R, Ward E,et al.Cancer statistics 2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2]Clarke-Pearson DL.Clinical practice.Screening for ovarian cancer[J].N Engl J Med,2009,361(2):170-177.
[3]Oleinick NL,Morris RL,Belichenko I.The role of apoptosis in response to photodynamic therapy:What,where,why,and how [J].Photochem Photobiol Sci,2002,1(1):1-21.
[4]Sarkar G, Bolander ME. Telomeres, telomerase, and cancer [J].Science,1995,268(5214):1115-1117.
[5]Daniel M,Peek GW,Tollefsbol TO.Regulation of the human catalytic subunit of telomerase(hTERT)[J].Gene,2012,498(2):135-146.
[6]Ruden M,Puri N.Novel anticancer therapeutics targeting telomerase[J].Cancer Treat Rev,2013,39(5):444-456.
[7]徐秀莲,陈 浩,刘 毅,等.hTERT反义寡核苷酸促进紫杉醇诱导 Hut78细胞凋亡 [J].中国病理生理杂志,2008,24(1):192-194,197.
[8]孙 玲,巩宏涛,任小晶,等.人端粒酶逆转录酶反义寡核苷酸联合顺铂对HL-60细胞增殖及凋亡的影响 [J].郑州大学学报:医学版,2008,43(3):494-497.
[9]刘永萍,胡岳棣,王 峰,等.人端粒酶反转录酶反义寡核苷酸对胰腺癌细胞吉西他滨敏感性的影响 [J].中华医学杂志,2009,89(34):2391-2394.
[10]Chung CW,Chung KD,Jeong YI,et al.5-aminolevulinic acid-incorporated nanoparticles of methoxy poly(ethylene glycol)-chitosan copolymer for photodynamic therapy [J].Int J Nanomed,2013,8(1):809-819.
[11]Sato T,Kishi S,Matsumoto H,et al.Comparisons of outcomes with different intervals between adjunctive ranibizumab and photodynamic therapy for polypoidal choroidal vasculopathy [J]. Am J Ophthalmol, 2013,156(1):95-105.
[12]Usuda J,Okunaka T, Furukawa K,et al.Increased cytotoxic effects of photodynamic therapy in IL-6gene transfected cells via enhanced apoptosis [J].Int J Cancer,2001,93(4):475-480.
[13]Chakrabarti M,Banik NL,Ray SK.Photofrin based photodynamic therapy and miR-99atransfection inhibited FGFR3and PI3K/Akt signaling mechanisms to control growth of human glioblastomainvitroandinvivo[J].PLoS One,2013,8(2):e55652.
[14]Peng Q,Warloe T,Berg K,et al.5-Aminolevulinic acidbased photodynamic therapy.Clinical research and future challenges [J].Cancer,1997,79(12):2282-2308.
[15]Chen X,Zhao P,Chen F,et al.Effect and mechanism of 5-aminolevulinic acid-mediated photodynamic therapy in esophageal cancer[J].Lasers Med Sci,2011,26(1):69-78.
[16]He GF,Bian ML,Zhao YW,et al.A study on the mechanism of 5-aminolevulinic acid photodynamic therapyinvitroandinvivoin cervical cancer[J].Oncol Rep,2009,21(4):861-868.
[17]Kyo S,Kanaya T,Takakura M,et al.Human telomerase reverse transcriptase as a critical determinant of telomerase activity in normal and malignant endometrial tissues [J].Int J Cancer,1999,80(1):60-63.
