RUNX3全长和不同结构域原核表达载体的构建及其重组蛋白表达
2013-09-19宋艳艳王桂玲
宋艳艳,王桂玲
(中国医科大学细胞生物学教研室 卫生部细胞生物学重点实验室,辽宁 沈阳 110001)
Runx3(Runt-related gene 3)是一种新型肿瘤抑制基因,最初是在1994年由Levanon等发现,先后被命名为急性髓性白血病2基因(AML2)、多瘤病毒强化因子结合蛋白2基因(PEBP2aC)和核心结合因子3基因(CBFA3)[1]。人类的RUNX3蛋白是RUNX家族长度最小的成员,其cDNA全长1 784bp,开放阅读框(ORF)为1 245bp,编码415个氨基酸。RUNX家族,除包含RUNX3/PEBP2αC外,还包括急性髓性白血病1(RUNX1/AML1)和核心结合因子 1(RUNX2/CBFA1),经鉴定该家族蛋白结构中均含有128个氨基酸组成的RD保守的序列,该区域被称为 Runt结构域[2-5]。该 Runt结构域位于RUNX蛋白的氨基末端,是多细胞家族中序列特异的DNA结合结构域[6],该结构域与果蝇的成对控制(pair rule)基因Runt序列同源,在模式生物(如果蝇、线虫等)的研究[7]中发现:Runt结构域具有肿瘤抑制功能,所以与正常的机体发育和人类成因性的多种类癌症有关联。在RUNX家族蛋白中,RUNX3对肿瘤的的抑制作用最为显著,已经有相关实验[7]证实:其蛋白表达水平的变化与胃癌、结肠癌和膀胱癌等多种癌症有关联。而且RUNX3可通过Runt结构域激活或抑制转录过程。Goh等[3]从RUNX3的Runt结构域出发,研究RUNX3蛋白与Src激酶的相互作用,且取得一定进展。最新研究表明:RUNX3在胃癌中呈低表达,与淋巴结转移和不良预后有关联。但目前有关RUNX3的Runt结构域的功能研究还比较局限,相关的作用机制尚不十分明确,因此构建RUNX3全长和不同结构域的原核表达载体具有重要意义。
1 材料与方法
1.1 菌株和主要试剂 大肠杆菌DH5α和BL21感 受 态 为 本 实 验 室 制 备;pcDNA3.1A-myc-RUNX3质粒为本实验室前期构建,质粒纯化试剂盒购自美国Qiagen公司,引物合成和DNA测序由金斯瑞公司完成,PyrobestTM DNA polymerase、dNTP、DNA电泳凝胶回收试剂盒和各种限制性核酸内切酶购自大连TaKaRa公司,DNA Marker、Protein Marker购自美国GenScript公司,T4DNA连接酶购自美国NEB公司。
1.2 引 物 设 计 与 合 成 以 pcDNA3.1-myc-RUNX3质粒为模板,设计RUNX3全长及不同截短区段引物,5′端引入BamHⅠ酶切位点,3′端引入EcoRⅠ酶切位点并插入终止子,采用PCR法扩增相应功能域片段。其中,Nter、Runt和Cter可利用常规PCR法合成,ΔRunt利用重叠PCR方法合成,先分别以Nter的上游引物和RUNX3-ΔRunt-R 合成特定的 Nter,以 RUNX3-ΔRunt-F和Cter的下游引物合成特定的Cter,再以该特定的Nter和Cter按1∶1混合为模板,由Nter的上游引物和Cter的下游引物合成ΔRunt。
1.3 RUNX3全长及不同结构域截短的原核表达载体的构建 采用BamHⅠ和EcoRⅠ双酶切pGEX-4T-2空载体及经同样酶切处理的PCR产物,试剂盒回收酶切后的pGEX-4T-2空载体和PCR产物,用T4DNA连接酶连接16℃ 过夜,得到连接产物。取5μL上述连接反应液转化感受态细菌E.coliDH5α中,涂布于含氨苄西林的LB琼脂平板,37℃ 培养过夜。各挑取3~6个白色菌落,接种于氨苄西林3mL的LB培养液中,37℃震荡过夜。碱裂解法制备质粒DNA,采用BamHⅠ和EcoRⅠ双酶切鉴定重组质粒,并送金斯瑞公司测序,测序正确后,分别将构建的质粒命名 为 pEGX-4T-2-FL、pGEX-4T-2-Nter、pGEX-4T-2-Runt和pGEX-4T-2-Cter。
1.4 RUNX3全长及不同结构域的原核表达载体表 达 蛋 白 的 诱 导 将 质 粒 pEGX-4T-2-FL、pGEX-4T-2-Nter、pGEX-4T-2-Runt和 pGEX-4T-2-Cter导入大肠埃希菌BL21感受态中,涂布于含氨苄西林的LB琼脂平板,37℃ 培养过夜。各挑取白色菌落3~5个,碱裂解法制备质粒DNA,经BamHⅠ和EcoRⅠ 双酶切后鉴定阳性克隆。挑取转化后的单个菌落接种至含氨苄西林的LB培养基中 ,37℃ 培养过夜后,按菌液∶培养基=1∶100稀释,37℃ 培养至 吸光度(A600)值为0.6左右时,加入摩尔浓度1.0mmol·L-1IPTG,分别诱导培养3、4和5h时,收集菌体,加入100μL 2×SDS Loading buffer中 ,100℃ 加热5min,12 000r·min-1离心5min,冰上放置,取上清行8%SDS-PAGE电泳。电泳结束后行考马斯亮蓝染色,脱色后观察电泳结果。根据电泳结果,选定最适合的诱导时间和IPTG浓度,再在该条件下,利用GST-Beads大量纯化以上蛋白,最后各取10μL样品,经10%SDS-PAGE电泳后行考马斯亮蓝染色,脱色后观察电泳结果。
2 结 果
2.1 RUNX3全长及不同结构域截短的结构特点
根据对RUNX3(NM_004350.2)开放阅读框和前 期 实 验 结 果 确 定 RUNX3-FL,RUNX3-ΔRunt、RUNX3-Nter、RUNX3-Runt和 RUNX3-Cter的结构(图1),并根据该结构设计引物,经PCR获得各片段(图2),各片段长度分别为RUNX3-FL 1 245bp、RUNX3-ΔRunt 843bp、RUNX3-Nter 159bp、RUNX3-Runt 402bp 和RUNX3-Cter 684bp,与预期相符。

图1 RUNX3全长及不同结构域截短的结构模式图Fig.1 Schematic diagrams of overall length and different domain truncations of RUNX3
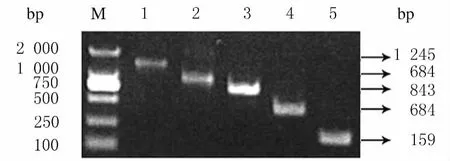
图2 RUNX3全长和不同结构域截短片段PCR电泳图Fig.2 PCR electrophoregram of overall length and different domain truncations of RUNX3
2.2 RUNX3全长和不同结构域片段重组质粒酶切鉴 定 将 构 建 好 的 质 粒 pEGX-4T-2-FL、pGEX-4T-2-Nter、pGEX-4T-2-Runt和 pGEX-4T-2-Cter,经BamHⅠ和EcoRⅠ双酶切后,得到与PCR结果相同长度的片段,与预期结果相符,并经测序鉴定正确。见图3。
2.3 SDS-PAGE电泳分析纯化后的 GST-RUNX3融合蛋白 将测序正确的质粒 pEGX-4T-2-FL、pGEX-4T-2-Nter、pGEX-4T-2-Runt和 pGEX-4T-2-Cter导入大肠杆菌BL21中,挑取单菌落诱导表达蛋白,利用 GST-Beads大量纯化以上蛋白,10%SDS-PAGE电泳后,可在相应的预期位置得到特异性的蛋白带,谷胱甘肽转移酶(GST)相对分子质量为26 000,可见RUNX3不同结构域(FL、Runt、Nter和Cter)的融合蛋白相对分子质量分别约为72 000、40 000、32 000和51 000。见图4。
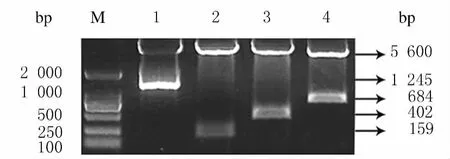
图3 BamHⅠ/EcoRⅠ双酶切RUNX3全长和不同结构域片段的电泳图Fig.3 Electrophoregram of overall length and different domain fragments of RUNX3digested by BamHⅠ/EcoRⅠ

图4 RUNX3全长和不同结构域片段的重组质粒融合蛋白SDS-PAGE电泳图Fig.4 SDS-PAGE electrophoregram of recombinant plasmid fusion protein of overall length and different domain fragments of RUNX3
3 讨 论
Runx3基因位于人类染色体1p36.1,全长约67 000,由P1和P2这2个启动子和6个外显子及1个1 245bp的DRF组成[9]。通过对胃癌临床病例的研究发现:RUNX3在这些胃癌组织中规律地表现杂合性缺失和启动子区域的高甲基化,表明其在胃癌发生发展中发挥重要作用,而且Runx3基因的灭活机制不同于其他肿瘤抑制基因(如P53)[4],不是依赖突变,所以Runx3将是很好的药物作用的靶点,也许为未来胃癌的临床治疗提供一种思路。不仅如此,Runx3基因在其他肿瘤中均出现特异性的低表达,与多种肿瘤的标记分子存在一定联系,如在乳腺癌中与雌激素依赖受体(estrogen receptor,ER)α存在负相关关系,从而抑制乳腺癌细胞或乳腺癌组织的生长[10]。RUNX3作为肿瘤抑制因子,其失活机制常与启动子区的高甲基化有关联,在乳腺癌细胞中,双甲基化RUNX3的启动子区,可以促进细胞增殖和凋亡[11]。Runx基因参与正常组织的造血、骨形成和神经发育过程,在胃肠道和表皮发育过程中也起决定性作用。所以Runx基因结构及相关功能研究具有临床意义。
蛋白的功能研究需要高丰度的蛋白表达量,内源性的蛋白一方面在体内表达量低,另一方面不宜直接从其蛋白本身出发研究其功能,而基因工程的分子克隆过程解决了这一问题,通过人工构建的载体,实现蛋白的特异性高表达。本实验不仅实现了RUNX3的高表达,而且还将RUNX3蛋白的几个特征性的结构域构建为稳定表达的载体,从而为研究RUNX3在肿瘤形成中所扮演的角色奠定前期实验基础。现已有报道[12-13]证实:RUNX3的 Cter区域是RUNX3在核定位时所必须的,而RUNX3只有在细胞核定位时才会发挥肿瘤抑制功能,可见Cter对于研究RUNX3肿瘤抑制机制具有重要意义。而RUNX3的Runt区域是RUNX3与蛋白相互作用的主要结构域,可以通过体外GST Pull Down等方法验证RUNX3可以与哪些相关蛋白相互作用,从而进一步探究相互作用后会有哪些相关功能的改变。
本实验从RUNX3不同结构域出发,构建了不同结构域的原核表达载体,并在IPTG诱导下,利用GST-beads大量纯化各区域蛋白,经电泳证实了各重组蛋白的表达。本课题组借助原核表达载体实现融合蛋白表达的方法,既利于纯化,又利于保护蛋白的活性,从而为RUNX3蛋白的相关研究奠定了实验基础。
[1]Levanon D,Negreanu V,Bernstein Y,et al.AML1,AML2and AML3,the human members of the runt domain gene-family:cDNA structure,expression and chromosomal localization [J].Genomics,1994,23(2):425-432.
[2]Bae SC, Lee YH. Phosphorylation, acetylation and ubiquitination:The molecular basis of RUNX regulation [J].Gene,2006,366(1):58-66.
[3]Goh YM,Cinghu S, Hong ET, et al. Src kinase phosphorylates RUNX3at tyrosine residues and localizes the protein in the cytoplasm [J].J Biol Chem,2010,285(13):10122-10129.
[4]Chi XZ,Kim J,Lee YH,et al.Runt-related transcription factor RUNX3is a target of MDM2-mediated ubiquitination [J].Cancer Res,2009,69(20):8111-8119.
[5]Coffman JA.Is runx a linchpin for developmental signaling in metazoans?[J].J Cell Biochem,2009,107(2):194-202.
[6]Walrad PB, Hang S, Joseph GS, et al. Distinct contributions of conserved modules to runt transcription factor activity [J].Mol Biol Cell,2010,21(13):2315-2326.
[7]Alarcón-Riquelme ME. Role of RUNX in autoimmune diseases linking rheumatoidarthritis,psoriasis and lupus [J].Arthritis Res Ther,2004,6(4):169-173.
[8]Cheng HC,Liu YP,Shan YS,et al.Loss of RUNX3 increases osteopontes expression and promotes cell migration in gastric cancer[J].Carcinogesis,2013,Jun 17 [Epub ahead of print].
[9]Bangsow C,Rubins N,Glusman G,et al.The RUNX3 gene-sequence,structure and regulated expression [J].Gene,2001,279(2):221-232.
[10]Huang B,Qu Z,Ong CW,et al.RUNX3acts as a tumor suppressor in breast cancer by targeting estrogen receptorα [J].Oncogene,2012,31(4):527-534.
[11]Kang HF,Dai ZJ,Bai HP,et al.RUNX3gene promoter demethylation by 5-Aza-CdR induces apoptosis in breast cancer MCF-7cell line [J].Onco Targets Ther,2013,6:411-417.
[12]Chuang LSH,Ito Y. RUNX3is multifunctional in carcinogenesis of multiple solid tumors [J].Oncogene,2010,29(18):2605-2615.
[13]Voon DC,Wang H,Koo JK,et al.Runx3protects gastric epithelial cells against epithelial-mesenchymal transitioninduced cellular plasticity and tumorigenicity [J].Stem Cells,2012,30(10):2088-2099.
