泡沫分离法分离纯化无患子皂苷的研究
2013-09-18林清霞郑德勇
林清霞,郑德勇,2*
(1.福建农林大学材料工程学院,福建 福州 350002;2.福建农林大学茶叶科技与经济研究所,福建 福州 350002)
植物中皂苷类物质常具有独特的生物活性,近年来对人参[1]、绞股蓝、百合[2-3]和文冠果[4]等原料中皂苷类物质进行了较深入的研究,开发出许多皂苷类药物;从资源丰富的油茶籽[5]提取分离的皂苷已开始用于配制洗发香波等洗涤类产品[6]。无患子在我国淮河流域以南和广东、福建、台湾、广西、云南等地[7]有广泛分布,无患子假种皮中含有丰富的无患子皂苷,主要包括以常春藤皂苷元(hederagenin)为基本骨架的三萜类皂苷及一些倍半萜皂苷[8-9],它们均具有很强的表面活性作用,是一类天然的非离子型表面活性剂[10],Huang等[11]还发现从无患子果肉中分离的三萜皂苷具有抗癌等多种功效,近年研究还表明无患子皂苷对重金属具有广谱的洗脱作用[12]。
无患子皂苷的分离与纯化是无患子皂苷资源的开发利用基础,目前一般采用萃取法、膜分离法、大孔树脂法等[13]。饶厚曾等[14]分别用正丁醇和乙醚萃取提纯皂苷和皂苷元,但这一工艺溶剂量耗费较大,并且所得皂苷产率及纯度不高;魏凤玉等[15-16]采用水提-大孔树脂吸附分离法及超滤法对无患子皂苷进行分离纯化,总皂苷纯度可分别达85%、67%,但仍存在着成本高、周期长等问题。泡沫分离法与上述分离方法相比无需使用大量有机溶剂,运行成本较低,在蛋白质分离[17]上的应用比较成熟,近年来在分离人参皂苷[18]、三七皂苷[19]等天然皂苷类中也取得了较好的成效。本研究尝试将泡沫分离法应用于无患子皂苷的分离。
1 实验
1.1 原料、试剂和仪器
无患子假种皮由福建省大青实业有限公司提供,经日晒、风干备用。试验中除高效液相色谱分析所用甲醇为HPLC级之外,其余试剂均为分析纯。
UV-2800AH紫外分光光度计,尤尼柯(上海)仪器有限公司;高效液相色谱(1200 series),美国安捷伦公司。自制泡沫分离装置:由泡沫分离柱、空气泵、气体分布器、转子流量计(LZB-4,燕山仪表总厂)、恒温循环器(HX-1050,北京博医康实验仪器有限公司)等组装。其中泡沫分离柱为玻璃管制成,高600 mm,直径40 mm。由分离柱底部通入空气,分离柱外部有直径60 mm夹套,可通入循环水,以控制分离温度。
1.2 试验原料液制备
无患子浓缩液:2 000 g无患子假种皮经清水洗涤、沥干后,每次加入10 L 60% 乙醇,浸提3次,合并滤液,浓缩至3 L。加入9 L 95% 乙醇溶液进行醇沉,于阴凉处静置过夜,滤去多糖等沉淀物。滤液于旋转蒸发器上蒸发,回收乙醇,即得无患子浓缩液。经检测,其含固形物为45.30%。
1.3 无患子总皂苷含量的测定
1.3.1 无患子总皂苷测定条件的优化 称取自制的无患子皂苷标准品10 mg,用甲醇定容于10 mL容量瓶中,取100 μL该溶液于试管中,并置于水浴中挥干溶剂。分别加入显色剂与氧化剂,待显色完全后用紫外分光光度测定其吸光度。参照魏凤玉等[20]选取显色剂为香草醛、氧化剂为高氯酸。改变所加入的5%香草醛与高氯酸的比例及反应时间,将显色样品于400~800 nm范围内进行紫外扫描,对比不同紫外光图谱,获得测定无患子皂苷的最佳条件为:分别加入0.4 mL 5% 的香草醛和1.2 mL高氯酸试剂,摇匀后置于70℃ 的水浴中加热20 min,再冰浴3 min,最后加入5 mL冰醋酸摇匀,采用紫外分光光度计在481 nm波长下测定皂苷含量。
1.3.2 无患子总皂苷标准曲线的绘制 取12.4 mg无患子皂苷纯品于10mL容量瓶中用甲醇定容。分别吸取该标准溶液50、100、200、300、400和500 μL于试管中,并置于水浴中挥干溶剂,采用上述优化方法测定紫外吸光度。
1.4 泡沫分离法纯化无患子皂苷试验
在一定的进料浓度、进料量、pH值和分离气速、温度的情况下,采用自制的泡沫分离装置进行泡沫分离操作,收集塔顶溢出的泡沫,采用搅拌法消泡,用量筒测量泡沫液的体积,并测定其固形物、总皂苷。分离效果通过收率、富集比以及纯度进行表征。计算公式如下:

式中:Y—总皂苷收率,%;Cf—泡沫液中总皂苷质量浓度,g/L;Vf—泡沫液体积,mL;Ci—进料液总皂苷质量浓度,g/L;Vi—进料量,mL。

式中:E—总皂苷富集比;Cf—泡沫液总皂苷质量浓度,g/L;Ci—进料液皂苷质量浓度,g/L。

式中:P—总皂苷纯度,%;Cf—泡沫液总皂苷质量浓度,g/L;Vf—泡沫液体积,mL;Wf—收集液烘干后所得固体的质量,mg。
2 结果与分析
2.1 无患子总皂苷标准曲线
采用1.3节方法测定无患子总皂苷系列标准溶液的吸光度,以溶液中无患子总皂苷质量为自变量(X,mg),以测试液吸光度(Y)为因变量,可得到无患子总皂苷含量与吸光度的标准曲线为Y=3.577X+0.01(R2=0.999 4)。
2.2 泡沫分离纯化条件对分离效果的影响
2.2.1 进料量的影响 在进料浓度2.0 g/L、料液pH值4.3、气速32 L/h、温度40℃ 条件下,改变进料量(50、100、150、200和250 mL)进行泡沫分离操作,结果如图1。
由图1可知,收率随着进料量的增加呈现上升趋势,富集比随着进料量的增加呈下降趋势,而泡沫中皂苷的纯度在这过程中变化不大。这是因为随着进料量的增大,鼓泡区变大,相应的泡沫分离区就小了,泡沫中更多的夹带液在回流前被收集,因此收率增大。另外,由于进料量的增加,液体回流时间减少,使得更多的泡沫夹带液被收集,则富集比呈现下降的趋势。综合以上3个指标可见,当进料量在150 mL左右时,泡沫分离效果较好。
2.2.2 初始进料浓度的影响 在进料量150 mL、料液pH值4.3、气速32 L/h、温度40℃ 条件下,改变进料浓度(1.0、2.0、3.0、4.0 和5.0 g/L)进行泡沫分离操作,结果如图2。
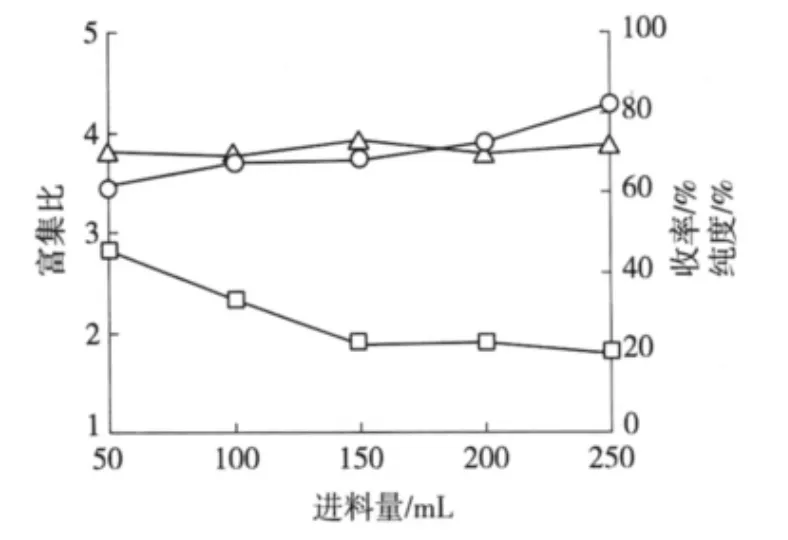
图1 进料量对泡沫分离效果的影响Fig.1 The effect of the initial solution volume on foam separation
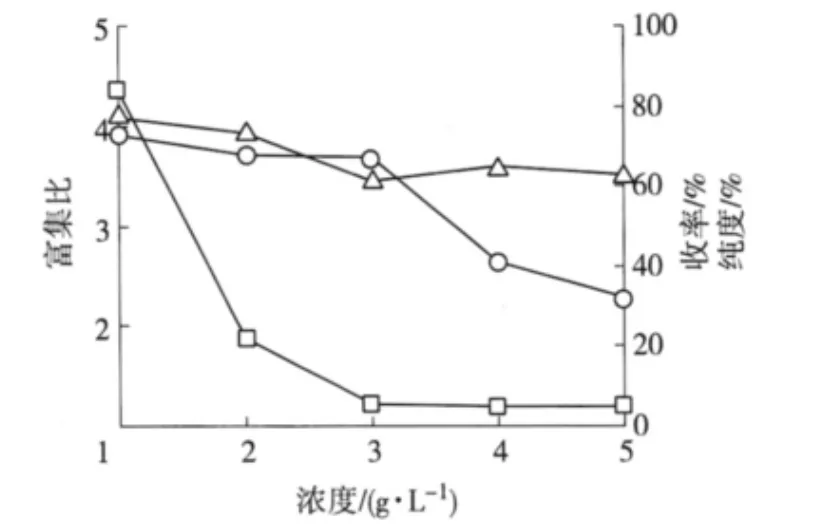
图2 进料浓度对泡沫分离效果的影响Fig.2 The effect of the initial concentration of saponin on foam separation

由图2可知,无患子总皂苷收率及富集比随着进料浓度的增加都呈现下降趋势,收率在初始浓度为3.0 g/L之前下降得比较缓慢,之后急速下降。而富集比在初始浓度为3.0 g/L之前下降得较快,之后趋于平衡。泡沫中皂苷的纯度则随进料浓度的增大呈缓慢下降趋势。这是由于在进料浓度低时,泡沫较不稳定、易破裂,泡沫中夹带液的量相对较少,因此富集比与纯度都较高。收率随着进料浓度的增大也是整体呈下降变化,可能是实验中所用的鼓泡器的孔径比较大,不利于高浓度溶液的分离并且由于实验中的皂苷浓度超过临界胶束浓度[10](无患子皂苷在25℃ 时的临界胶束浓度cmc为33 mg/L),皂苷分子在气液界面处无法通过吸附原理富集,使得夹带液在泡沫液中增加的速度大于皂苷增加的速度,因此收率减小。综合可知当进料量浓度在2.0 g/L左右时,泡沫分离效果较好。
2.2.3 气速的影响 在进料量150 mL、浓度2.0 g/L、料液 pH 值4.3、温度40℃ 条件下,改变分离气速(16、24、32、40和48 L/h)进行泡沫分离操作,结果如图3。
由图3可知,皂苷收率随着气速的增大呈现上升趋势,富集比和纯度随气速增大呈下降趋势。这是由于气速较低时泡沫到达管顶端的时间延长、回流时间增加,即分离区变大了,使得泡沫液中的夹带液减少,导致收率较低、富集比较高、纯度较高。当气速介于24~32 L/h时,收率增加得相对较快,此时富集比与纯度都稍微增大。这可能是由于该过程泡沫夹带液增加的速率小于皂苷增加的速率,因此富集比与纯度反而增加了。综合以上指标可得,当气速介于24~32 L/h范围内,有较好的分离效果。
2.2.4 温度的影响 在进料量150 mL、浓度2.0 g/L、料液pH值4.3、气速32 L/h条件下,改变分离温度(5、10、20、30、40、50和60℃)进行泡沫分离操作,结果如图4。
由图4可知,无患子皂苷的富集比、收率以及纯度都在30℃ 时达到最大。在30℃ 之前,三者都呈上升变化。在30℃ 之后,都大体呈下降变化。而在20~40℃ 范围内变化得最为明显。这是由于无患子皂苷在25~40℃[8]附近时表面活性稳定,过高或过低的温度都不利于泡沫的稳定性,因此分离效果也会受影响。可见,维持温度为30~40℃ 左右时,泡沫分离效果较好。
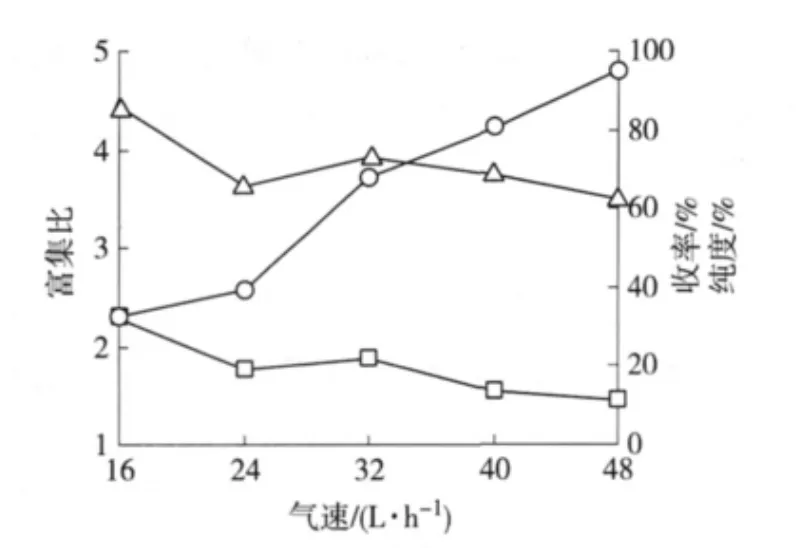
图3 气速对泡沫分离效果的影响Fig.3 The effect of the gas flow rate on foam separation

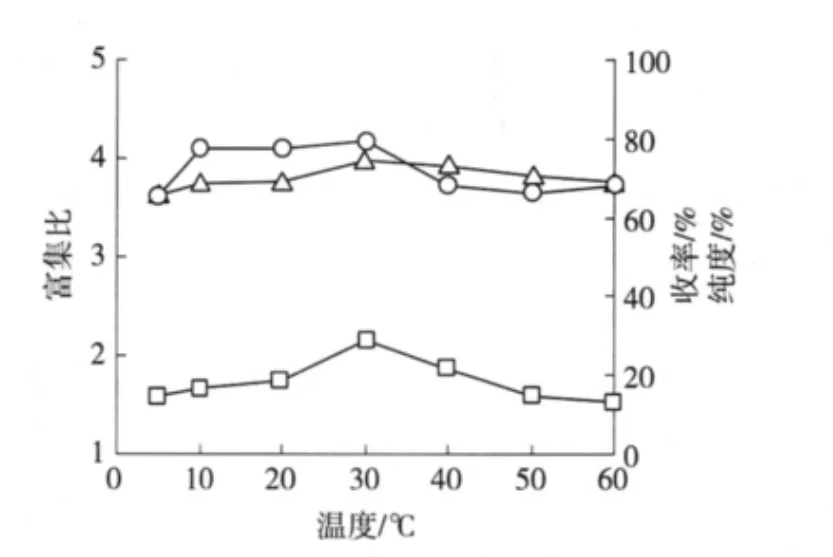
图4 温度对泡沫分离效果的影响Fig.4 The effect of the solution temperature on foam separation
2.2.5 pH 值的影响 在进料量150 mL、浓度 2.0 g/L、气速 32 L/h、温度 40 ℃ 条件下,改变 pH 值(3.5、4.3、6、7、8、9)进行泡沫分离操作,结果如图5。
由图5可知,在酸性条件下皂苷收率随着pH值上升呈上升趋势,当pH值超过6以后收率呈下降变化,即在酸性条件下皂苷的收率高于碱性条件。这是由于无患子是一种天然弱酸性表面活性剂,在酸性条件下所形成的泡沫更加稳定。皂苷的富集比在pH值为8以前整体变化不大,在pH值为8~9时富集出现大幅度变化,可能是碱性太强,泡沫破碎得比较快,因此夹带液很少,加之分离管的管径相对较小,破碎的泡沫更容易分出,使得富集比较高。但pH值对富集比和纯度的影响均较小。综合以上变化趋势,考虑到无患子皂苷是一种弱酸性表面活性剂,因此pH值为4~6范围内分离效果较好。
综上所述,当进料浓度为2.0 g/L左右、进料量为150 mL左右、气速在24~32 L/h之间、温度范围30~40℃、pH值为4~6时,无患子皂苷的泡沫分离效果较好。
2.3 重复性验证试验
在进料浓度2.0 g/L、进料量150 mL、气速32 L/h、温度30℃、pH值为4.3条件下,进行重复性验证试验,结果见表1。
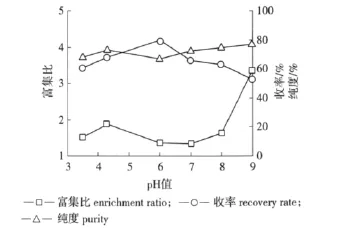
图5 pH值对泡沫分离效果的影响Fig.5 The effect of solution pH values on foam separation

表1 重复性验证试验的结果Table 1 The results of verification test
由表1可知,富集比、收率、纯度的RSD分别为1.29%、1.36% 和2.24%,表明以上试验的重现性良好。当进料浓度2.0 g/L、进料量150 mL、气速32 L/h、温度30℃、pH值4.3条件下,富集比可达到2.153,收率与纯度分别达到79.19% 和74.68%。
3 结论
3.1 进料浓度、进料量、气速、pH值和温度等工艺因子对泡沫分离效果均有显著影响。无患子皂苷的收率随进料浓度的增大而降低,而随气速、进料量的增大而提高,且在酸性条件以及温度为30~40℃范围内收率较高。无患子皂苷的富集比随进料浓度、气速、进料量的增大而降低,且在温度为30~40℃范围内富集比较高,受pH值的影响相对较小。无患子皂苷的纯度随进料浓度、气速的增大而降低,且在温度为30~40℃ 范围内纯度较高,随进料量及pH值的影响较小。
3.2 泡沫分离法可以较好地解决皂苷提取过程中纯度低等问题,分离过程工艺稳定、分离效果好。在进料浓度2.0 g/L、进料量150 mL、气速32 L/h、温度30℃、pH 值4.3条件下,富集比可达到2.153,收率与纯度分别达到79.19% 和74.68%。
[1]高彩霞,王成章.人参皂苷的提取和精制工艺研究[J].林产化工通讯,2005,39(5):5-8.
[2]吉宏武,丁霄霖.百合皂苷的提取分离与结构初步鉴定[J].林产化学与工业,2001,21(3):47-51.
[3]吉宏武,丁霄霖.百合总皂苷定量测定方法的研究[J].林产化学与工业,2003,23(4):54-58.
[4]吴伟杰,李博生.泡沫分离法提取文冠果果皮皂苷的工艺条件[J].浙江农业科学,2010(4):816-819.
[5]曾韬,毕梦宇,李尤山,等.茶皂素的提取研究[J].林产化工通讯,2000,34(6):16-18.
[6]陈 钦,郑清芳.油茶饼综合利用的研究[J].福建林学院学报,2000,20(2):140-143.
[7]中国植物志编辑委员会.中国植物志四十七卷(第1分册)[M].北京:科学出版社,1998.
[8]KIMATA H,NAKASHIMA T,KOKUBUN S,et al.Saponins of pericarps of Sapindus mukorossi Gaertn and solubilization of monodesmosides by bisdesmosides[J].Chem Pharm Bull,1983,31(6):1998-2005.
[9]HUANG H C,TSAI W J,MORRIS-NATSCHKE S L,et al.Sapinmusaponins F-J bioactive tirucallane—type saponins from the galls of Sapindus mukorossi[J].J Nat Prod,2006,69(5):763-767.
[10]孙洁如,陈孔常,周鸣方.无患子表面活性物及其复配体系的性质研究[J].日用化学工业,2002,32(4):16-18.
[11]HUANG H C,WU M D,TSAI W J,et a1.Triterpenoid saponins from the fruits and galls of Sapindus mukorossi[J].Phytochemistry,2008,69(7):1609-1616.
[12]周仁,甘荔,陈福明,等.无患子洗涤剂清除体表金属毒物效果的研究[J].职业医学,1991,18(6):330-331.
[13]黄素梅,王敬文,杜孟浩,等.无患子的研究现状及其开发利用[J].林业科技开发,2009,23(6):1-4.
[14]饶厚曾,郭隆华.无患子皂苷提取工艺研究[J].江西科学,2002,20(3):55-58.
[15]魏凤玉,余锦城,解辉.天然无患子皂苷的提取分离[J].安徽化工,2007,33(3):15-17.
[16]魏凤玉,解辉,余锦城,等.超滤法分离提纯无患子皂苷[J].膜科学与技术,2008,28(2):85-88.
[17]BHATTACHARJEE S,KUMAR R,GANDHI K S.Prediction of separation factor in foam separation of proteins[J].Chemical Engineering Science,1997,52(24):4625-4636.
[18]修志龙,张代佳,贾凌云,等.泡沫分离法分离人参皂苷[J].过程工程学报,2001,1(3):289-292.
[19]张雁,宋建国,鱼红闪,等.三七皂苷 R1 的分离提纯[J].大连工业大学学报,2011,30(3):161-164.
[20]魏风玉,张静,解辉.无患子总皂苷含量的测定[J].天然产物研究与开发,2008,20:81-83,102.
