不同贮藏条件对紫玉兰花粉保护酶活性及萌发率的影响1)
2013-09-18刘艳萍朱延林马永涛张江涛翟晓巧罗晓雅
刘艳萍 朱延林 马永涛 张江涛 翟晓巧 罗晓雅
(河南省林业科学研究院,郑州,450008)
紫玉兰(Magnolia liliflora Desr.)属木兰科(Magnoliaceae)木兰属(Magnolia L.),花色呈紫色或紫红色,十分娇艳;无论花蕾或盛开的花朵,其形状优美;3—4月开花,先花后叶,点缀了残冬的景象。广玉兰(Magnolia grandiflora L.)属木兰科(Magnoliaceae)木兰属(Magnolia L.),5—6月开花,花大如荷花,是优良的城市绿化及园林观赏树种,但其花色为白色,较为单调。将广玉兰花粉与紫玉兰花粉进行杂交,以期获得彩色的广玉兰花朵。二者花期不遇是杂交授粉工作的制约因素,希望通过有效地花粉贮藏解决这一问题。因此,如何对花粉进行有效贮藏成为杂交育种和人工辅助授粉中亟待解决的关键问题。前人关于花粉的研究多集中在不同贮藏条件与萌发率的关系[1-3]。有研究表明:花粉进入成熟期,内部发生一系列的生理生化代谢反应,活力逐渐下降,而花粉中的保护酶类能够清除氧自由基,延缓衰老,因此,保护酶活性的高低能够直接反映花粉的活力[4-5]。笔者研究了不同贮藏温度和贮藏时间对紫玉兰花粉保护酶活性和花粉生活力的影响,旨在花粉的酶活性方面对花粉贮藏期间生理生化反应进行探索,为紫玉兰花粉的有效贮藏提供科学依据。
1 材料与方法
花粉采自河南鄢陵县某苗木基地内的10年生紫玉兰植株。于2012年4月6日采集树冠外围中部含苞待放的花蕾,带回后及时在室内摘下花药放于硫酸纸上,置于室内干燥2~3 d,待花粉散出后收集于2.5或5 mL离心管里备用。
花粉的贮藏:本试验分室温(变色硅胶内)、4、-20和 -70℃ 4种贮藏温度;0、10、20、30和40 d 5种贮藏时间。将处理好的花粉分成4份,每份7瓶,共28瓶,分别放在室内盛有变色硅胶的干燥器(室温)、冰箱冷藏室(4℃)、冰箱冷冻室(-20℃)和超低温冰箱(-70℃)内。达到设定贮藏时间时从4种温度下各取出1瓶花粉,取出少量用于花粉生活力测定,余下花粉取一定量测定酶活性。
花粉萌发率测定:采用液体培养基法,培养基为100 g·L-1蔗糖 +150 mg·L-1H3BO3+200 mg·L-1CaCl2·2H2O,pH 值5.8。培养条件为室温培养5 h。利用XSP-BM-2CA型生物显微镜进行观察,每个样品取5个视野,每视野约100粒花粉,花粉管伸长的长度大于花粉粒直径时为具生活力花粉,计算萌发率,萌发率=(具生活力的花粉数/总花粉数)×100%。
花粉酶活性测定:(1)酶液的提取。称取花粉约 0.5000 g 于预冷的研钵中,加入2 mL 0.05 mol·L-1磷酸缓冲液(pH值7.0)、适量的PVP和石英砂研磨30 s,于10000 r冷冻离心机里离心20 min,上清液即为酶液[6]。(2)过氧化物酶(POD)活性测定。反应液为4 mL 0.3%愈创木酚 +50 μL 0.3%H2O2,酶液 50 μL,以 0.3% 愈创木酚 +0.3%H2O2作为空白,混合后摇匀静置1 min,在TU-1810型紫外可见分光光度计下测定OD470值,每1 min读数1次,共读数5次。POD酶活性单位为 mg·g-1·min-1[7]。(3)过氧化氢酶(CAT) 活性测定。反应液为3 mL 0.05 mol·L-1磷酸缓冲液(pH 值7.0)+200 μL 0.3%H2O2,酶液 50 μL,以 3 mL 0.05 mol·L-1磷酸缓冲液(pH 值 7.0)+200 μL 0.3%H2O2作为空白,混合液充分摇匀后静置1 min,在TU-1810型紫外可见分光光度计下测定OD240值,每1 min读数1次,共读数5次。CAT酶活性单位为mg·g-1·min-1[7]。(4)超氧化物歧化酶(SOD)活性测定。取0.1 mL酶液加入试管中,再取2支对照管,分别加入0.05 mol·L-1磷酸缓冲液(pH 值 7.8)3.1 mL、130 mmol·L-1甲硫氨酸 0.2 mL、750 μmol·L-1氮蓝四唑溶液 0.2 mL、100 μmol·L-1乙二胺四乙酸二钠溶液 0.2 mL 和 20 μmol·L-1核黄素溶液0.2 mL,混匀后将1支对照管置于暗处,其他各试管于4000 lx日光灯下反应20 min,以不照光的对照管作为空白,分别测定560 nm波长下的吸光值,SOD 酶活性单位 U·g-1[7]。以上指标的测定均重复3次。
2 结果与分析
2.1 贮藏条件对花粉萌发率的影响
不同贮藏时间和贮藏温度条件下,紫玉兰花粉萌发率及方差分析结果如表1所示。方差分析结果表明,贮藏时间和贮藏温度对花粉萌发率影响极显著(P<0.01)。由表1可以看出,花粉萌发率下降最快的时期分别为室温10~30 d、室温条件下贮藏至40 d时花粉几乎无生活力,4℃的20~40 d,-20℃的30~40 d,-70℃的40 d。-20和-70℃条件下贮藏40 d的紫玉兰花粉萌发率仍有19%和38%,此时正值广玉兰的盛花期,为杂交育种的较佳时期。

表1 不同贮藏条件下花粉萌发率多重比较 %
2.2 贮藏条件对花粉保护酶活性的影响
2.2.1 对花粉过氧化物酶活性的影响
不同贮藏条件下,紫玉兰花粉的过氧化物酶活性变化情况见表2,方差分析结果表明贮藏时间和贮藏温度对过氧化物酶活性有显著影响(P<0.05)。由表2可知,室温条件下,随着贮藏时间的延长,紫玉兰花粉的过氧化物酶活性呈下降趋势,尤其是保存至20 d时,过氧化物酶活性急剧降低,降至原来的38.5%,继续延长保存时间,过氧化物酶活性继续降低,但其下降速度较慢,30和40 d时分别为原来的25.2%和14.4%;4℃条件下,紫玉兰花粉的过氧化物酶活性呈升高—下降的变化趋势,最高峰出现在10 d时,之后POD活性开始降低,但降低的幅度较小,到40 d时,POD活性急剧下降,降至0.13 mg·g-1·min-1,为原来的 23.9%; -20 ℃贮藏条件下,过氧化物酶活性呈升高—下降的趋势,最高峰出现在20 d,此时过氧化物酶活性为原来的1.29倍,之后过氧化物酶活性缓慢下降,40 d时过氧化物酶活性为原来的73.5%;-70℃贮藏条件下,过氧化物酶活性呈升高—下降的变化趋势,但其变化曲线起伏较小,保存至40 d时过氧化物酶活性仍为原来的96.1%,保持较高的活性。
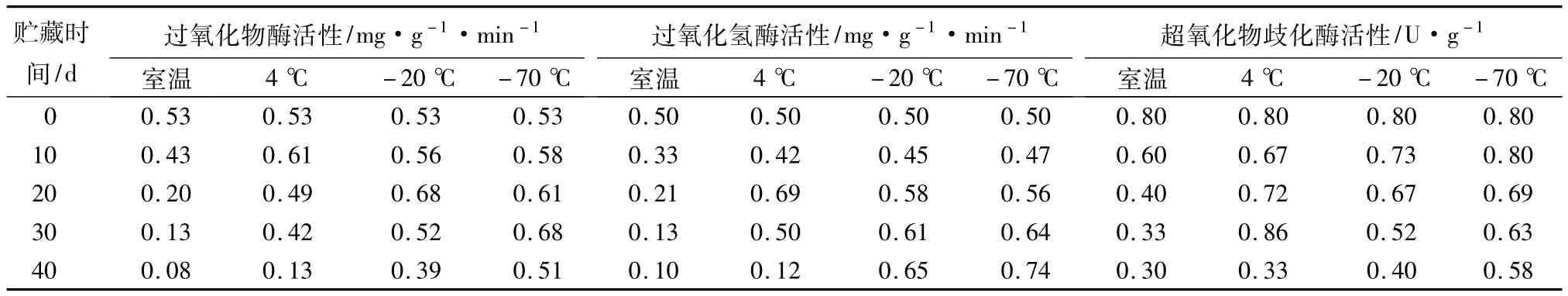
表2 贮藏条件对紫玉兰花粉保护酶活性的影响
2.2.2 对花粉过氧化氢酶活性的影响
不同贮藏条件下,紫玉兰花粉的过氧化氢酶活性变化情况如表2所示,方差分析结果表明贮藏温度对过氧化氢酶活性有显著影响(P<0.05),而贮藏时间的影响不显著。表2表明,室温条件下,在整个贮藏期间内紫玉兰花粉的过氧化氢酶活性呈下降趋势,保存至40 d时,过氧化氢酶活性下降至原来的19.7%;4℃条件下,紫玉兰花粉的CAT活性呈下降—升高—下降的变化趋势,高低起伏较大,最高峰出现在20 d时,为原来的1.38倍,之后过氧化氢酶活性快速下降,到40 d时,降至12.4%,为原来的24.8%;-20和-70℃贮藏条件下,过氧化氢酶活性的变化规律一致,均呈下降—升高的趋势,且其变化幅度也较小,最高峰均出现在40 d时,分别达到 0.65 和 0.74 mg·g-1·min-1,为原来 CAT 活性的 1.30 倍和1.48 倍。
2.2.3 对花粉超氧化物歧化酶活性的影响
不同贮藏条件下,紫玉兰花粉的超氧化物歧化酶活性变化情况见表2,方差分析结果表明贮藏时间和贮藏温度对超氧化物歧化酶活性有显著影响(P<0.05)。室温条件下,随着贮藏时间的延长,紫玉兰花粉的超氧化物歧化酶活性呈下降趋势,保存至40d时,超氧化物歧化酶活性仅为原来的37.5%;4℃条件下,紫玉兰花粉的超氧化物歧化酶活性呈下降—升高—下降的变化趋势,高低起伏变化较大,最高峰出现在30 d,最低峰出现在40 d,且最高峰为最低峰的2.60倍;-20℃贮藏条件下,超氧化物歧化酶活性呈下降的变化趋势,但下降的幅度较室温条件下的小很多,40 d时SOD活性为原来的50.6%;-70℃条件下,随着贮藏时间的延长,超氧化物歧化酶活性的变化曲线较平缓,保存至40 d时超氧化物歧化酶活性仍为原来的72.7%。
2.3 花粉萌发率与过氧化物酶、过氧化氢酶、超氧化物歧化酶活性的关系
紫玉兰花粉萌发率与花粉的过氧化物酶、过氧化氢酶、超氧化物歧化酶活性之间均呈正相关关系,且萌发率与过氧化物酶活性的正相关显著(P<0.05),与超氧化物歧化酶活性的正相关极显著(P<0.01),说明在紫玉兰花粉的贮藏过程中,过氧化物酶活性和超氧化物歧化酶活性对花粉萌发率起着主导作用,即超氧化物歧化酶活性对花粉萌发率的影响作用大于过氧化物酶和过氧化氢酶活性的,过氧化物酶活性的作用大于过氧化氢酶活性的。
3 结论与讨论
紫玉兰花粉贮藏对实现与广玉兰的杂交育种具有重要意义。贮藏后的花粉保持较高的萌发率和较强的生活力是评价花粉贮藏成败的两个指标[4,8]。在本试验条件下,紫玉兰花粉的最佳贮藏温度是-20和-70℃,且贮藏40 d时紫玉兰花粉萌发率仍有19%和38%,此时正值广玉兰的盛花期,为杂交育种的较佳时期。利用-20和-70℃条件下贮藏的紫玉兰花粉与广玉兰杂交,成功率还是较高的。
自由基学说认为植物体内活性氧的产生和清除处于一种动态的平衡状态,而一旦平衡被打破,就会出现逆境胁迫[5,9]。贮藏花粉,首先要进行花粉贮藏前的预处理,即将花粉的含水率降至10%左右,形成水分胁迫。在这种条件下,花粉动员其体内的过氧化物酶、过氧化氢酶、超氧化物歧化酶等保护酶系统清除由水分胁迫产生的活性氧自由基,维护细胞膜的稳定,保护细胞免遭膜脂氧化的伤害,这是细胞对胁迫产生的自我保护机制,是一种保护性适应[4];随着贮藏时间的延长,花粉细胞不断失水,水分胁迫加重,同时活性氧代谢失调不断累积,花粉细胞不断衰老,出现氧化胁迫,在水分、低温和氧化三重胁迫下,紫玉兰花粉的过氧化物酶、过氧化氢酶、超氧化物歧化酶酶活性不足以补偿因胁迫而造成的伤害,致使细胞逐渐失活、死亡。本试验表明,在紫玉兰花粉的贮藏过程中,室温条件下花粉的过氧化物酶、过氧化氢酶、超氧化物歧化酶活性均呈下降趋势,且花粉萌发率也是急剧下降,贮藏至30~40 d时,萌发率接近零,这可能是室温条件对花粉的胁迫过于严重,花粉自身的保护酶系统来不及启动,花粉细胞就死亡了,因此说要中长期贮藏花粉,室温条件是不可行的;4℃条件下花粉的过氧化物酶首先启动,即在花粉贮藏至10 d时就有升高的趋势,单一的过氧化物酶酶的抗氧化能力有限,随着胁迫的加剧,过氧化氢酶和超氧化物歧化酶酶也先后启动,分别在20和30 d时达到高峰,此时也是花粉萌发率快速下降的时期,之后3种酶活性又下降,4℃条件适合10~20 d的短期花粉贮藏;-20和-70℃条件下的花粉过氧化物酶、过氧化氢酶、超氧化物歧化酶酶变化趋势较一致,只是-70℃条件下的花粉酶活性变化幅度较小、高峰值出现的较晚,且其花粉萌发率也较高,40 d时还有38%的花粉具有生活力,-70℃更适合进行长期的花粉保存,具体到何时花粉失活,有待进一步研究。
[1]Parton E,Vervaeke I,Delen R,et al.Viability and storage of bromeliad pollen[J].Euphytica,2002,125:1552 -1661.
[2]王钦丽,卢龙斗,吴小琴,等.花粉的保存及其生活力测定[J].植物学通报,2002,19(3):365 -373.
[3]孙爱芹,常伟光,韩斌,等.不同枣品种花粉生活力及贮藏方法研究[J].中国农学通报,2010,26(1):166 -168.
[4]赵文飞,邢世岩,姜永旭.贮藏时间对银杏花粉保护酶活性和萌发率的影响[J].武汉植物学研究,2004,22(3):259 -263.
[5]谭健晖.贮藏温度和时间对马尾松花粉保护酶活性及萌发率的影响[J].林业科学,2011,47(9):28 -32.
[6]李合生,孙群,赵世杰,等.植物生理生化试验原理和技术[M].北京:高等教育出版社,2000.
[7]赵世杰,刘华山,董新纯.植物生理学试验指导[M].北京:中国农业科技出版社,1998.
[8]孙霞,邢世岩,路冬,等.银杏花粉生活力研究[J].果树科学,1998,15(1):58 -64.
[9]Kanazaw S,Sano S,Koshiba T,et al.Changes in antioxidative in cucumber cotyledons during naturalsence:comparison with those during dark induced senescence[J].Plant Physiol,2000,109:211 -216.
