2,4-二氯苯氧乙酸代谢中的水解反应机理
2013-09-17徐雯丽姚建华
李 佳 徐雯丽 胡 静 凌 敏 姚建华
(中国科学院上海有机化学研究所,上海200032)
1 引言
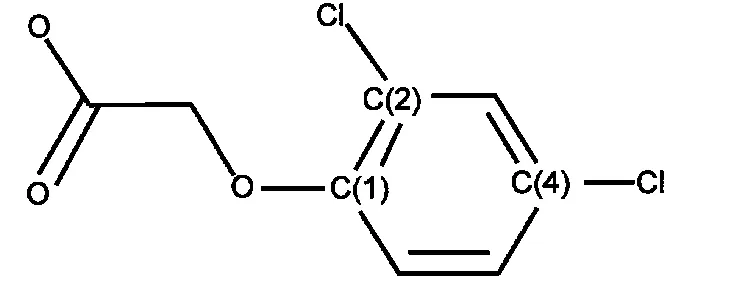
图1 2,4-二氯苯氧乙酸(2,4-D)结构Fig.1 Structure of 2,4-dichlorophenoxy acetic acid(2,4-D)
2,4-二氯苯氧乙酸(2,4-D,CAS:94-75-7)(化学结构如图1所示),是世界上第一个工业化的选择性激素类高效有机除草剂.目前已大量应用于农田、牧场和湖岸等场所,主要作用作物有小麦、大麦、水稻及玉米等,是应用最为广泛的除草剂之一.1,2低浓度的2,4-D对植物生长具有刺激作用,促进作物早熟增产,而高浓度的则对植物具有灭杀作用,对于双叶子杂草具有良好的防治效果.3但是,它对环境和人类健康有一定的不良影响.已有的实验结果显示,它会导致人体内分泌失调,4它的急性毒性(大鼠经口)半数致死量(LD50)是370 mg·kg−1,5为中等毒性.由于2,4-D的生物降解非常缓慢,它已经被认定为地表和地下水中主要污染物,6并被作为监测对象.同时,它在降解过程中所产生的化合物对环境的影响也值得重视.
已有很多与2,4-D代谢相关的实验研究报道,主要包括它的光照降解、7−12微生物降解及在植物内降解13−18和水解19−21等.根据已有的文献22报道整理得到2,4-D的代谢信息如图2所示.
已有的报道主要关注了两个方面:(1)环境中各种因素对2,4-D代谢速度的影响,(2)2,4-D在各种环境中的代谢过程.Luna等7研究在光照体系中,各种氧化剂浓度及体系pH值对2,4-D光氧化降解速度的影响;Rivera-Utrilla等11研究2,4-D在TiO2催化剂体系中的光催化降解行为;Laurent等13研究了2,4-D在双加氧酶催化作用下转化为2,4-二氯苯酚;Tiedje等16考察其在生物酶溶液中的代谢,表明其最终产物为丁二酸;Hagin等17则研究了2,4-D在具有抗药性植物中的转化,由于转化为3-2,4-二氯苯氧乙酸-丙酸,而失去了活性;Hamilton等18对其在豆科类植物中转化的研究表明,它主要转化为2,3-二氯-4-羟基苯氧乙酸.在这些研究工作中,只有Grosby等19在1966年提出了2,4-D的稀溶液在光照下水解反应机理,水解反应式如图3所示.即主反应为图3中所示的途径(2)和(3),途径(1)仅发生少量反应.由于水解反应副产物有HCl和羟基乙酸,反应之后溶液pH值将减小.
图2 2,4-D代谢信息(粗线部分参见图3)Fig.2 Metabolism information of 2,4-D(bold also shown in Fig.3)
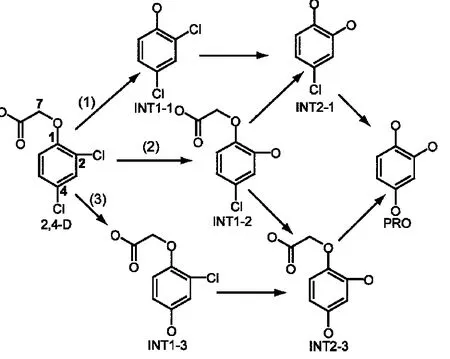
图3 2,4-D水解反应Fig.3 Hydrolysis reactions of 2,4-D
本文将介绍采用量子化学理论,研究2,4-D的代谢过程中的水解反应.采用B3LYP/6-311G(d,p)方法对已发表的实验研究结果(如图3所示),开展理论研究,以阐述2,4-D代谢过程中的水解反应机理.本文尝试对2,4-D代谢过程中水解反应涉及到的三个基本问题作出适当回答:(I)2,4-D代谢过程中各步水解反应的内在机理是什么?(II)2,4-D代谢过程中哪条反应途径具有动力学优势,并对反应体系中各中间体浓度如何影响?(III)在理论计算中,采用导体极化连续模型(CPCM)23模拟水溶液环境对反应过程中几何结构和势能面如何影响.
2 研究方法
采用Gaussian 09程序,24在密度泛函理论(DFT)B3LYP25,26/6-311G(d,p)27计算水平上,优化气相反应的所有可能的反应复合物、中间体、过渡态和产物几何结构.在相同计算水平上,对优化构型进行了振动频率分析,以确定极小点(所有的振动频率都是正值)或过渡态(有且只有1个虚频).采用反应内禀坐标(IRC)解析28寻找和验证关联该过渡态的反应物和产物;采用频率计算获得各个结构的相关热力学数据,如零点振动能(ZPVE),并且得出各反应过渡态的振动方式.另外,所有的优化构型都进行了自然键轨道(NBO)理论分析.29由于该反应环境为水溶液中,本文还采用CPCM,模拟水溶液环境对照气态分子反应结果,以阐述溶剂化效应对该反应的影响.
3 结果与讨论
3.1 水解反应中的电荷和键长
从原理上讲,连接在2,4-D苯环C(1)、C(2)和C(4)上的基团,均有发生水解反应可能.因此,有三种可能水解途径(如图3所示).2,4-D水解反应中三条途径的反应物、各中间体和过渡态及产物结构如图4和图5所示.图6为反应物及各途径中第一个过渡态自然布居分析所得原子电荷示意图.
在水解反应中,由亲核试剂水分子进攻C(1)、C(2)和C(4)原子,继而形成过渡态.图6所示的2,4-D化合物的原子电荷分布结果显示,除C(1)原子外,苯环上C原子均带负电荷.对于C(1)、C(2)和C(4)原子而言,水分子中的O原子并非直接进攻C原子,而是先通过氢键作用形成络合物.在逐步形成过渡态过程中,C(1)、C(2)和C(4)原子因逐步失去电子而带正电荷.三条途径的第一过渡态,被解离键的C原子均带较多的正电荷(+0.325 C(1),+0.235 C(2),+0.259 C(4))(如图6所示),从而有利于带孤对电子的羟基顺利发生亲核反应.
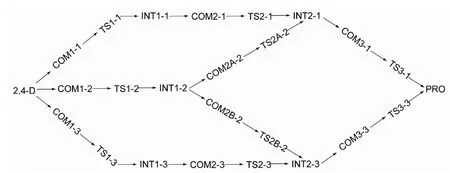
图4 2,4-D水解反应过程Fig.4 Hydrolysis reaction processes of 2,4-D
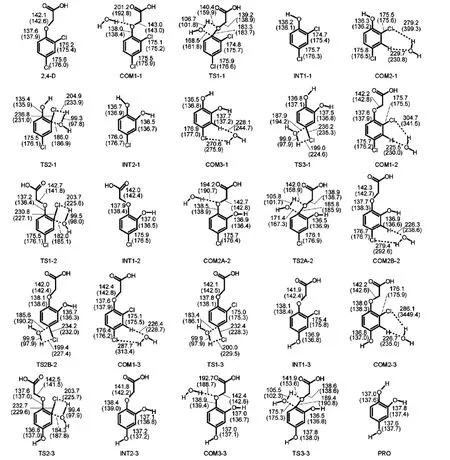
图5 2,4-D水解过程中反应物、各中间体、过渡态和产物的优化结构Fig.5 Optimized structures of the reactant,intermediates,transition states,and product in the hydrolysis reaction of 2,4-D

图6 2,4-D反应物及过渡态的原子电荷Fig.6 Atomic charges of 2,4-D and the transition states
图5 显示,途径(1)的反应过程为:(1)水分子的H原子与C(1)原子上相连的O原子形成氢键络合物COM1-1,其键长为201.2 pm.(2)水分子的O原子进攻C(1)原子,形成四元环的过渡态TS1-1.此时,C(1)―O键由138.0 pm拉长至183.3 pm,而水分子中O―H键也拉长至106.7 pm.水分子中的O原子与H原子也分别靠近被解离C(1)―O键,其距离分别为168.5和140.4 pm.(3)经过过渡态形成化合物INT1-1,这过程中反应消耗1个水分子,产生羟基乙酸分子.(4)水分子的C(2)―Cl键进行水解,同样以氢键的形式,水分子接近C(3)原子相连的H原子形成络合物COM2-1,其氢键键长为229.7 pm.在络合物中,水分子中H原子与C(2)相连的Cl原子应该有一定非常弱的相互作用.在过渡态TS2-1中,存在C(2)―O―H―Cl四元环,同样被解离的C(2)―Cl键拉长至236.8 pm.水分子中的O―H变化较小,稍微拉长至99.3 pm,同时即将形成新的C(2)―O、Cl―H化学键.产生1个HCl分子后,形成中间体INT2-1.(5)在C(4)―Cl键发生水解,通过氢键络合物COM3-1形成过渡态TS3-1.两次水解C―Cl键所形成过渡态中C―O―H―Cl四元环各键长差别较小,均在2 pm以内,表明该反应中不同的取代位置对C―Cl水解过程影响较小.最后在消耗3分子水,生成2分子HCl和1分子羟基乙酸后,生成最终产物1,2,4-三苯酚,整个过程中反应体系中水溶液pH值减小.
图4和图5显示,途径(2)反应过程与途径(1)的有区别.途径(2)反应过程为:(1)水分子对C(2)―Cl进行水解,在形成氢键络合物COM1-2时,氢键键长为225.5 pm.(2)进攻C(2)原子,形成C(2)―O―H―Cl四元环的过渡态TS1-2.C(2)―Cl键由175.7 pm拉长至230.8 pm,水分子中O―H变化较小,只拉长至99.5 pm,同时即将形成新的C(2)―O、Cl―H化学键.(3)经过羟基对Cl原子的取代后形成INT1-2,并在反应途径上解离C(1)―O键形成过渡态TS2A-2,或解离C(4)―Cl键形成过渡态TS2B-2.(4)进攻C(1)原子则形成C(1)―O―H―O四元环过渡态TS2A-2,此时C(1)―O键长由138.5 pm拉长至185.8 pm,而水分子中O―H键也拉长至105.8 pm.在实现氢转移后,则失去1分子羟基乙酸得到INT2-1,后续反应与途径(1)重合.(5)水分子进攻C(4)原子则同样经过氢键络合物COM2B-2,形成TS2B-2过渡态.C(4)―Cl键由176.7 pm拉长至234.2 pm,水分子靠近C(4)―Cl形成新的C―O、H―Cl键,失去1分子HCl后生成INT2-3,后续反应与途径(3)重合.
途径(3)的反应过程与途径(2)的较为相似,即对C(4)―Cl进行水解,在通过氢键络合物COM1-3、过渡态TS1-3后得到INT1-3.再依次对C(2)―Cl和C(1)―O进行水解,最后生成最终产物1,2,4-三苯酚.
以上均为在气态情况研究反应的进程,而实际反应体系在水溶液中.因此,为了考虑溶剂化效应的影响,我们采用CPCM模拟水溶液环境,再优化反应物、各中间体、过渡态和产物.文献30,31报道溶剂化效应对化合物结构影响不大.但是,图5中的信息显示,常规的化学键键长受其影响较小,约为0.5 pm.但对于过渡态中反应中心的键长则影响较大,可达30 pm左右.因此,对于反应体系的几何结构优化,考虑溶剂化效应非常必要,尤其对于反应过程中的过渡态结构优化.
3.2 反应势能面
表1列出了反应物、各中间体和过渡态、产物总能量以及包含零点能校正(ZPVE)的相对能量,各过渡态的唯一虚频.图7为其反应势能面图,将各点零点能校正后相对能量直观的表现于反应进程中.
表1中数据和图7中的能垒变化图显示,在形成氢键络合物过程中,由于氢键的弱作用,络合物能量降低较少,大多在10 kJ·mol−1左右.图7显示,三种途径中C(1)―O键解离活化能分别为276.3、284.7和296.2 kJ·mol−1,其振动频率分别为 764.4i、734.2i和727.6i cm−1,而振动模式则表现为H原子在两个O原子之间的摆动,即氢转移过程.而C(2)―Cl的解离活化能则分别为 218.1、228.4 和 233.1 kJ·mol−1,C(4)―Cl键解离活化能分别为239.0、234.4和230.7 kJ·mol−1.C―Cl键的解离振动频率在475i cm−1左右,振动模式表现为Cl原子在C原子和H原子间摆动,即Cl原子被取代离去过程.可见,C(1)―O键的解离活化能明显高于C―Cl键的,相同化学键在不同途径中的活化能差别表明,化学环境对反应活化能有一定影响.反应中两种化学键的解离均需较高的活化能,也表明2,4-D在水溶液中水解过程将比较缓慢,光照在一定程度上将活化化学键,加快其水解速度.
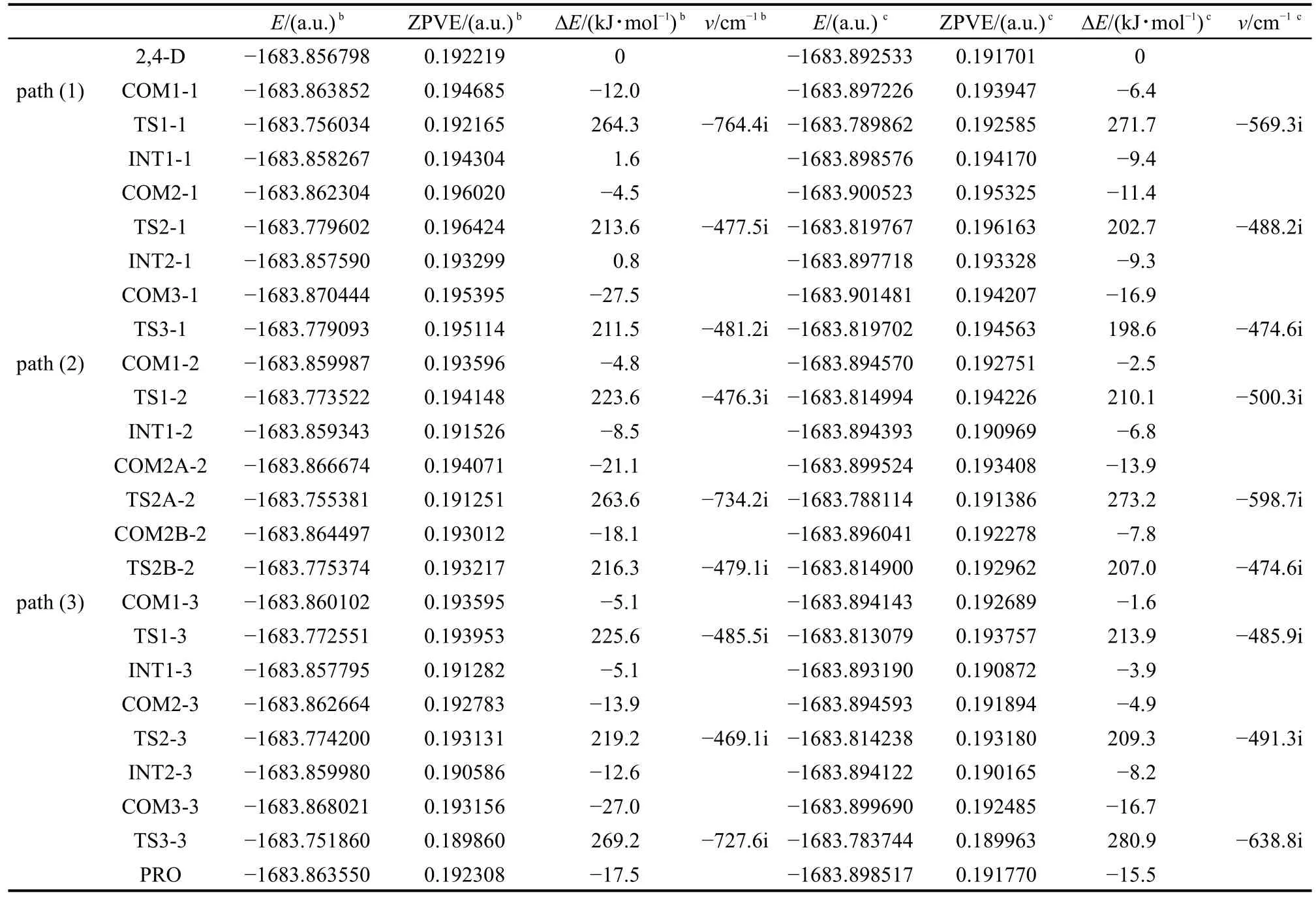
表1 反应物、各中间体和过渡态、产物的总能量(E)以及经零点能(ZPVE)校正的相对能量(ΔE)aTable 1 Energies(E)and relative energies(ΔE)corrected by zero-point vibrational energy(ZPVE)of a reactant,intermediates,transition states,and a producta
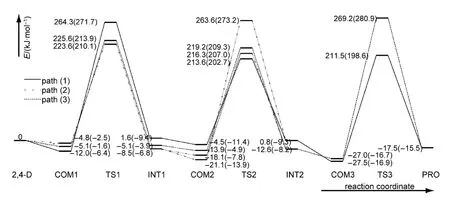
图7 2,4-D化合物水解反应势能面示意图Fig.7 Potential energy profiles of hydrolysis of 2,4-D
与C―Cl键相比,C(1)―O键键长仅为137.6 pm,比C―Cl键约短40 pm,同时其C和O原子电荷分别为+0.275和−0.553,导致其静电引力明显强于C―Cl键.另外对于亲核亲电反应,多数情况下为两者的最高占据分子轨道(HOMO)与最低非占据分子轨道(LUMO)相互作用.在本体系中,亲核试剂水分子的HOMO与2,4-D的LUMO作用.图8中显示了2,4-D的LUMO,其为C(2)―Cl键的反键轨道,表明当亲核试剂水分子的孤对电子与该轨道作用,C(2)―Cl将拉长解离,即亲核试剂水分子应是优先解离C(2)―Cl键,从活化能上也显示其能垒最小.
反应活化能与速率常数成指数关系,C(1)―O键解离活化能相对C―Cl键大约高60 kJ·mol−1左右,反应速率常数则将远小于C―Cl键的水解.因此,水解反应的各条途径将存在明显的动力学差异,反应更倾向于C―Cl键的水解.途径(2)和(3)为主要反应途径,C(1)―O键的解离速度将明显较慢.在反应体系中表现为途径(2)和(3)的反应中间体浓度较高,如途径(3)的INT2-3,即2,4-二羟基苯氧乙酸中间体在体系中浓度将明显偏高,这将有助于使农药对环境影响的研究从初始农药化合物扩展到可能存在的中间体.
考虑溶剂化效应的影响,采用CPCM研究本反应体系.结果表明采用CPCM后,三条途径中C(1)―O键解离活化能分别为278.1、287.1和297.6 kJ·mol−1,均略高于气态分子的计算结果.而C(2)―Cl的解离活化能则分别为 214.1、212.6 和 214.2 kJ·mol−1,C(4)―Cl键解离活化能分别为215.5、214.8和215.5 kJ·mol−1,两者则均略低于气态分子的计算结果.考虑溶剂化效应后,虽然不会对结果产生定性的变化,但对于C(1)―O键解离活化能偏高,而C―Cl键解离活化能偏低,使得反应选择性差异进一步增大.这也表明对于研究反应体系势能面,考虑溶剂化效应非常必要,其对不同的反应能垒影响不同,可能使反应选择性更明确.
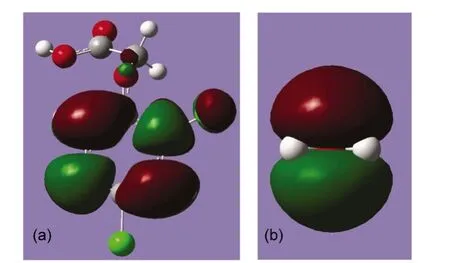
图8 (a)2,4-D的LUMO及(b)H2O的HOMO示意图Fig.8 Schematic diagrams of(a)LUMO of 2,4-D and(b)HOMO of H2O
4 结 论
采用密度泛函理论B3LYP/6-311G(d,p)方法,研究了2,4-D代谢中的水解反应,同时采用CPCM模拟水溶液体系,通过与气态分子体系结果比较,阐述了溶剂化效应对水解反应的影响.研究结果表明:密度泛函理论能够在分子水平上明确阐述2,4-D代谢中的水解反应机理,并可说明其反应选择性,以及在代谢过程中,各种产物在产生浓度差别的原因,从而更全面地阐述了2,4-D水解机理.
2,4-D水解反应存在三条可能水解途径,包括氢转移的C(1)―O键解离和氯被取代的C―Cl键解离两种反应机理.势能面的分析结果显示,C(1)―O键解离比C―Cl键解离所需活化能约高60 kJ·mol−1,2,4-D的水解反应更倾向于先水解C―Cl键,途径(2)和(3)为主要反应途径,同时根据各反应步骤的不同反应速率可以判断2,4-D水解体系中途径(3)中INT2-3,即2,4-二羟基苯氧乙酸中间体将在反应体系中表现出浓度较高.
此外,在水解反应体系中,考虑溶剂化效应非常必要.因为溶剂化效应对过渡态反应中心的几何结构影响非常大,而且对于反应势能面中各极点能量同样有一定影响.具体表现在对不同反应步骤活化能影响不同,可使反应选择性更确定.
致谢: 本工作使用了中国科学院上海高等研究院高性能计算与数据中心的计算资源.
(1) Zeljezic,D.;Garaj-Vrhovac,V.Toxicology 2004,200(1),39.doi:10.1016/j.tox.2004.03.002
(2) Lerch,T.Z.;Dignac,M.F.;Barriuso,E.;Bardoux,G.;Mariotti,A.J.Microbiol.Meth.2007,71,162.doi:10.1016/j.mimet.2007.08.003
(3) e-Pesticide Manual V4.2,version 4.2,copyright BCPC,2008-2009,Publisher BCPC.
(4) Colborn,E.;Vom Saal,F.S.;Soto,A.M.Environmental Impact Assessment Review 1993,14,469.
(5)Zeep,R.G.;Wolfe,N.L.;Gordon,J.A.;Baughman,G.L.Environ.Sci.Technol.1975,9,1144.doi:10.1021/es60111a001
(6) Hoover,D.G.;Borgonov,G.E.;Jones,S.H.Appl.Environ.Microb.1986,51,226.
(7) Luna,A.J.;Chiavone-Filho,O.;Machulek,A.;de Moraes,J.E.F.;Nascimento,C.A.O.J.Environ.Manage.2012,111,10.doi:10.1016/j.jenvman.2012.06.014
(8) Cabrera,M.I.;Martin,C.A.;Alfano,O.M.Water Sci.Technol.1997,35(4),31.
(9) Lee,Y.;Lee,C.;Yoon,J.Chemosphere 2003,51,963.doi:10.1016/S0045-6535(03)00043-2
(10) Wang,Q.;Lemley,A.T.Environ.Sci.Technol.2001,35,4509.doi:10.1021/es0109693
(11) Rivera-Utrilla,J.;Sánchez-Polo,M.;Abdel daiem,M.M.;Ocampo-Pérez,R.Appl.Catal.B-Environ.2012,126,100.doi:10.1016/j.apcatb.2012.07.015
(12) Seck,E.I.;Dona-Rodríguez,J.M.;Fernández-Rodriguez,C.;González-Díaz,O.M.;Arana,J.;Pérez-Pena,J.Appl.Catal.BEnviron.2012,125,28.doi:10.1016/j.apcatb.2012.05.028
(13) Laurent,F.;Debrauwer,L.;Rathahao,E.;Scalla,R.J.Agric.Food Chem.2000,48(11),5307.doi:10.1021/jf990672c
(14) Niedrée,B.;Vereecken,H.;Burauel,P.J.Environ.Radioactiv.2013,115,168.doi:10.1016/j.jenvrad.2012.08.008
(15) Fontmorin,J.M.;Huguet,S.;Fourcade,F.;Geneste,F.;Floner,D.;Amrane,A.Chem.Eng.J.2012,195,208.
(16) Tiedje,J.M.;Duxbury,J.M.;Alexander,M.;Dawson,J.E.J.Agric.Food Chem.1969,17(5),1021.doi:10.1021/jf60165a037
(17) Hagin,R.D.;Linscott,D.L.;Dawson,J.E.J.Agric.Food Chem.1970,18(5),848.doi:10.1021/jf60171a030
(18) Hamilton,R.H.;Hurter,J.;Hall,J.K.;Ercegovich,C.D.J.Agric.Food Chem.1971,19(3),480.doi:10.1021/jf60175a031
(19) Crosby,D.G.;Tutass,H.O.J.Agric.Food Chem.1966,14(6),596.doi:10.1021/jf60148a012
(20) Linscott,D.L.;Hagin,R.D.;Dawson,J.E.J.Agric.Food Chem.1968,16(5),844.doi:10.1021/jf60159a035
(21) Feung,C.S.;Hamilton,R.H.;Mumma,R.O.J.Agric.Food Chem.1973,21(4),637.doi:10.1021/jf60188a058
(22) Roberts,T.R.Metabolic Pathways of Agrochemicals;The Royal Society of Chemistry:Cambridge,UK,1998;pp 66−74.
(23) Barone,V.;Cossi,M.J.Phys.Chem.1998,102(11),1995.doi:10.1021/jp9716997
(24) Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 09,RevisionA.02;Gaussian Inc.:Pittsburgh,PA,2009.
(25) Perdew,J.P.Phys.Rev.B 1986,33,8800.doi:10.1103/PhysRevB.33.8800
(26) Lee,C.;Yang,W.;Parr,R.G.Phys.Rev.B 1988,37,785.doi:10.1103/PhysRevB.37.785
(27) Ditchfield,R.;Hehre,W.J.;Pople,J.A.J.Chem.Phys.1971,54,724.doi:10.1063/1.1674902
(28) Deng,L.;Ziegler,T.;Fan,L.J.J.Chem.Phys.1993,99,3823.doi:10.1063/1.466129
(29) Reed,A.E.;Curtiss,L.A.;Weinhold,F.Chem.Rev.1988,88,899.doi:10.1021/cr00088a005
(30) Jia,X.J.;Pan,X.M.;Wang,L.W.;Liu,Y.;Sun,H.;Su,Z.M.;Wang,R.S.Chem.J.Chin.Univ.2008,29,1224.[贾秀娟,潘秀梅,王莉伟,刘 颖,孙 昊,苏忠民,王荣顺.高等学校化学学报,2008,29,1124.]
(31) Yi,G.Q.;Zeng,Y.;Xia,X.F.Chem.Phys.2008,345(1),73.doi:10.1016/j.chemphys.2008.01.036
