响应面优化冷榨花生粕酶法制备多肽工艺的研究
2013-09-17肖怀秋李玉珍林亲录龚春平
肖怀秋 李玉珍 林亲录 杨 涛 邓 靖 龚春平
(湖南化工职业技术学院制药与生物工程系1,株洲 412004)
(中南林业科技大学食品科学与工程学院2,长沙 410004)
(湖南工业大学包装与材料工程学院3,株洲 412000)
(广东佛山南海宏仁食品有限公司4,佛山 528000)
花生(Arachis hypogeal L.)属豆科(Leguminosae)落花生属一年生草本植物,是我国重要的油料与经济作物。我国花生播种面积占全球花生播种面积约20%左右,年产量约500~650万吨,榨油后产生的花生粕约150多万吨[1]。花生粕中蛋白质含量高达50~70%(干基)[2],由于其溶解度差而无法直接应用于食品工业,主要用于畜禽或鱼类饲料和肥料,导致花生粕精深加工严重不足,优质的蛋白质资源未能得到充分深加工利用[3]。低温冷榨花生粕由于其蛋白质、氨基酸、维生素和甾醇等有效成分没有受到热变性而保存较好,而且花生蛋白与大豆蛋白相比,含胃胀气因子和抗营养因子少,与菜籽粕和棉子粕相比,含毒性物质较少。因此,是一类非常重要的植物蛋白质资源。花生粕蛋白经酶促水解后可以产生小分子蛋白质、多肽以及氨基酸,其中分子多肽比蛋白质的营养性能更好,生物吸收利用率比氨基酸更高,可直接为小肠黏膜吸收利用[4]。此外,花生肽还具有多种生理活性,如抗氧化、降血压和抗菌等。蛋白质酶促水解制备的活性多肽已成为治疗高血压、糖尿病、癌症、艾滋病、SARS等诸多疾病的特效或潜在药物[5],国外已有多肽药物和营养产品推向市场,市场前景极为可观[6]。本试验以低温冷榨花生粕为原料,通过碱性蛋白酶进行酶促水解,研究最佳酶促水解条件,为低值花生粕制备活性多肽提供技术支持,也为其蛋白质资源的精深加工提供帮助。
1 材料与方法
1.1 试验材料
低温冷榨花生粕:德州宏鑫花生蛋白食品有限公司;碱性蛋白酶:北京鸿润宝顺科技有限公司;其他试剂均为分析纯。
1.2 试验仪器与设备
LABCONCO冷冻干燥仪:美国 Labconco公司;HERMLE Z323K冷冻离心机:德国Hermle公司;722型可见分光光度计:上海舜宇恒平科学仪器有限公司;pHS-3C pH计:上海仪电科学仪器股份有限公司;KQ-300DE型数控超声波清洗器:昆山市超声仪器有限公司。
1.3 试验方法
1.3.1 花生粕蛋白质提取工艺
低温冷榨花生粕→烘干→粉碎→碱溶两次(1 mol/L NaOH 调 pH 8.5,料液比 1∶15,50 ℃,2 h)→离心(4 000 r/min,15 min)→上清液酸沉(3 mol/L柠檬酸调pH 4.5左右,室温静置30 min)→离心(4 000 r/min,15 min)→收集蛋白凝块→醇洗2次→加碱调整pH 6.5→真空冷冻干燥→花生蛋白粉
1.3.2 花生粕蛋白质酶解工艺
准确称取一定量的花生蛋白粉于反应器中,依据固液比要求添加适量蒸馏水搅拌至分散均匀,超声预处理10 min并于90℃预热10 min,冷却至室温后调整到预设pH值,根据蛋白酶活力并结合酶/底物配比精密准确称取碱性蛋白酶添加到酶解反应器中,缓慢搅拌,酶解过程中注意维持酶解系统pH恒定。酶解结束后将酶解液迅速置于沸水浴中灭酶10 min。冷却至室温后4 000 r/min离心10 min,收集上清液。
1.3.3 多肽测定
参考白永莲等[6]报道方法,略有改动。精密移取酶解液1 mL,加入双缩脲试剂4 mL作为测定管;精密量取7%标准蛋白0.05 mL加0.9%NaCl 0.95 mL,再加4 mL双缩脲试剂作为标准管;精密移取0.9%NaCl溶液1 mL加双缩脲试剂4 mL作为空白管,分别于525 nm波长处测定吸光值。多肽含量按下式计算:
多肽质量分数 =[(A测-A空)/(A标-A空)]×7% ×0.05
1.3.4 Min Run Equirelicated Res IV 析因设计
该析因设计方法能以较少的试验次数从众多影响因素中快速有效地筛选出主要显著影响因素(主效因子)。拟考察酶浓度[E]、底物浓度[S]、酶解温度、酶解时间和酶解pH等因素对多肽含量的影响,因素与水平见表1。

表1 析因设计因素与水平表
1.3.5 爬陡坡试验
响应面优化所拟合的多元非线性回归方程只有在考察的最优邻域里才能充分近似真实情况,若远离最优邻域,则拟合的回归方程与实际条件会不一致,甚至没有实际意义[7]。为此,基于析因设计结果并结合回归方程模型系数符号及大小设置步长及变化方向,使主效因子同时逼近最优邻域,以获得较优区域。
1.3.6 响应面法优化
中心复合设计(central composite design,CCD)具有灵活性和作为序贯试验设计的有用性,其灵活性取决于星号臂!和中心点数目n。CCD在基本保留回归正交设计试验次数的前提下,通过牺牲部分正交性而获得旋转性,由此可简化计算和部分消除回归系数之间的相关性以及克服预测值方差过分依赖于试验点在因子空间中的位置的不足,可以很好的根据预测值直接寻求最优区域。每因素设5水平,即±r(上下星号臂),±1(上下水平点)和0(零水平)。本试验中心点试验为6次。数据拟合模型可表示为:
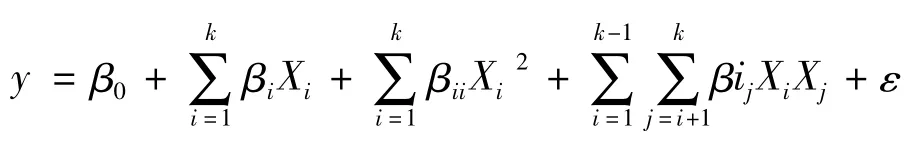
式中:y为响应值(多肽含量),β0为模型截距,βi为线性项回归系数,βii为二阶项回归系数,βij为模型交互项回归系数,Xi和Xj是独立自变量(考察因素),ε为模型误差,ε~N(0,σ2)。
用 Design expert (Version 8.0.6,Stat- Ease,Inc.,Minneapolis,MN)研究酶浓度(X1)、底物浓度(X2)和酶解时间(X3)对多肽生成的影响,因素水平与编码见表2。

表2 中心复合设计因素水平与编码
1.3.7 验证试验
在优化试验条件下重复6次试验,测定酶解液中多肽含量以验证优化试验条件的稳定性。
2 结果与分析
2.1 Min Run Equirelicated Res IV 析因设计
酶浓度(X1)、底物浓度(X2)、酶解 pH(X3)、酶解温度(X4)和酶解时间(X5)对多肽含量影响如表3所示。
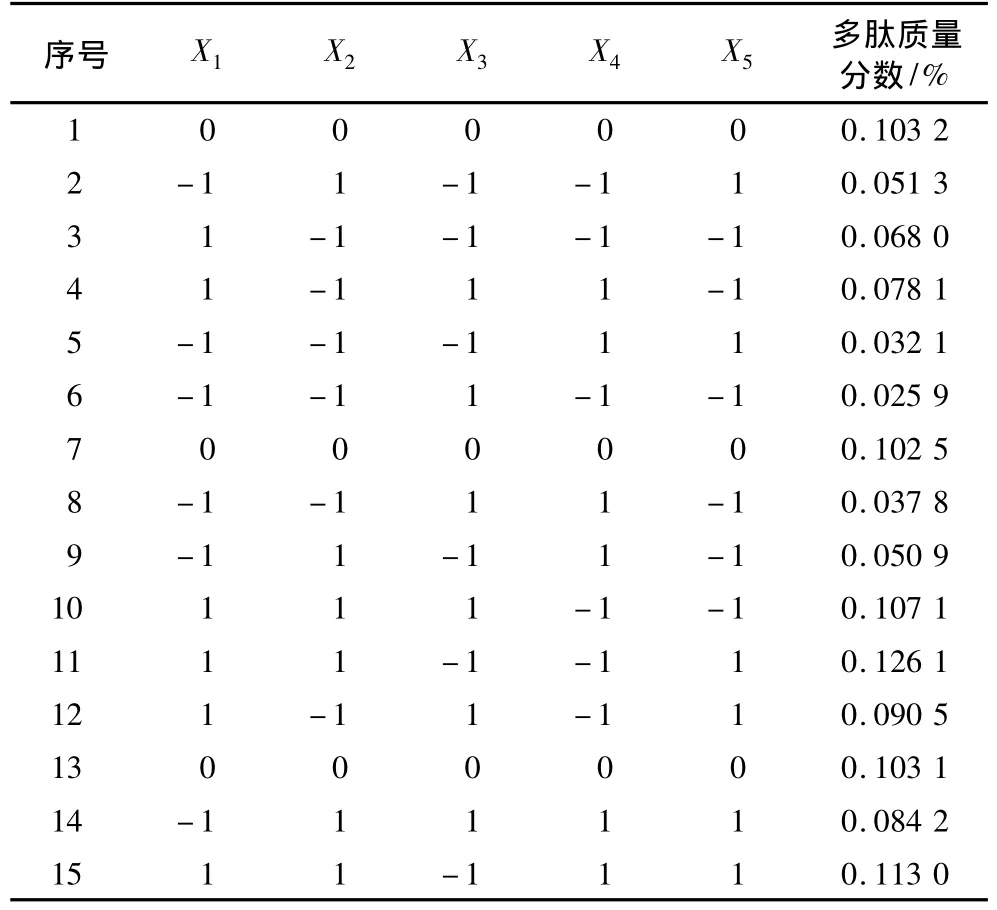
表3 析因设计编码与试验结果
经回归分析得到回归方程为 y=0.078+0.026x1+0.016x2+6.464E - 003x3+2.558E -003x4+7.465E-003x5。显著性分析表明模型极显著(P=0.0 043<0.01)。百分贡献率分析发现,酶浓度[E]、底物浓度[S]、酶解时间和酶解 pH为重要因素,特别是[E]和[S],累积百分贡献率和为72.43%。显著性分析发现,[E]和[S]影响极显著(P<0.01),酶解pH和酶解时间影响显著(P <0.05),酶解温度影响不显著(P=0.2 798 >0.05),各因素影响均为正影响,宜适当提升各因素水平。
2.2 爬陡坡设计
基于析因设计结果进行爬陡坡设计,各因素爬坡试验方向及步长如表4所示。
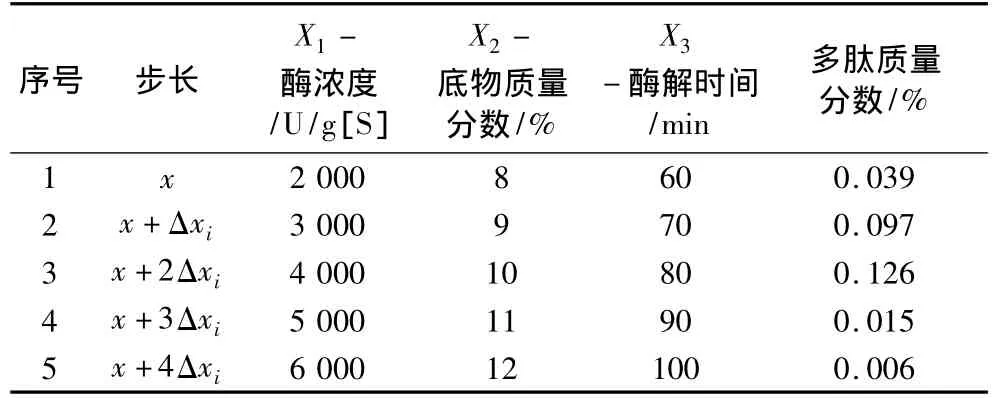
表4 爬陡坡试验结果
由表4可看出,试验组 3号多肽含量最高(0.126%),因此,以该试验条件为CCD的中心点。
2.3 响应面优化结果与分析
2.3.1 数学模型的建立
对酶浓度(X1)、底物浓度(X2)和酶解时间(X3)进行中心复合设计响应面优化试验,结果如表5所示。
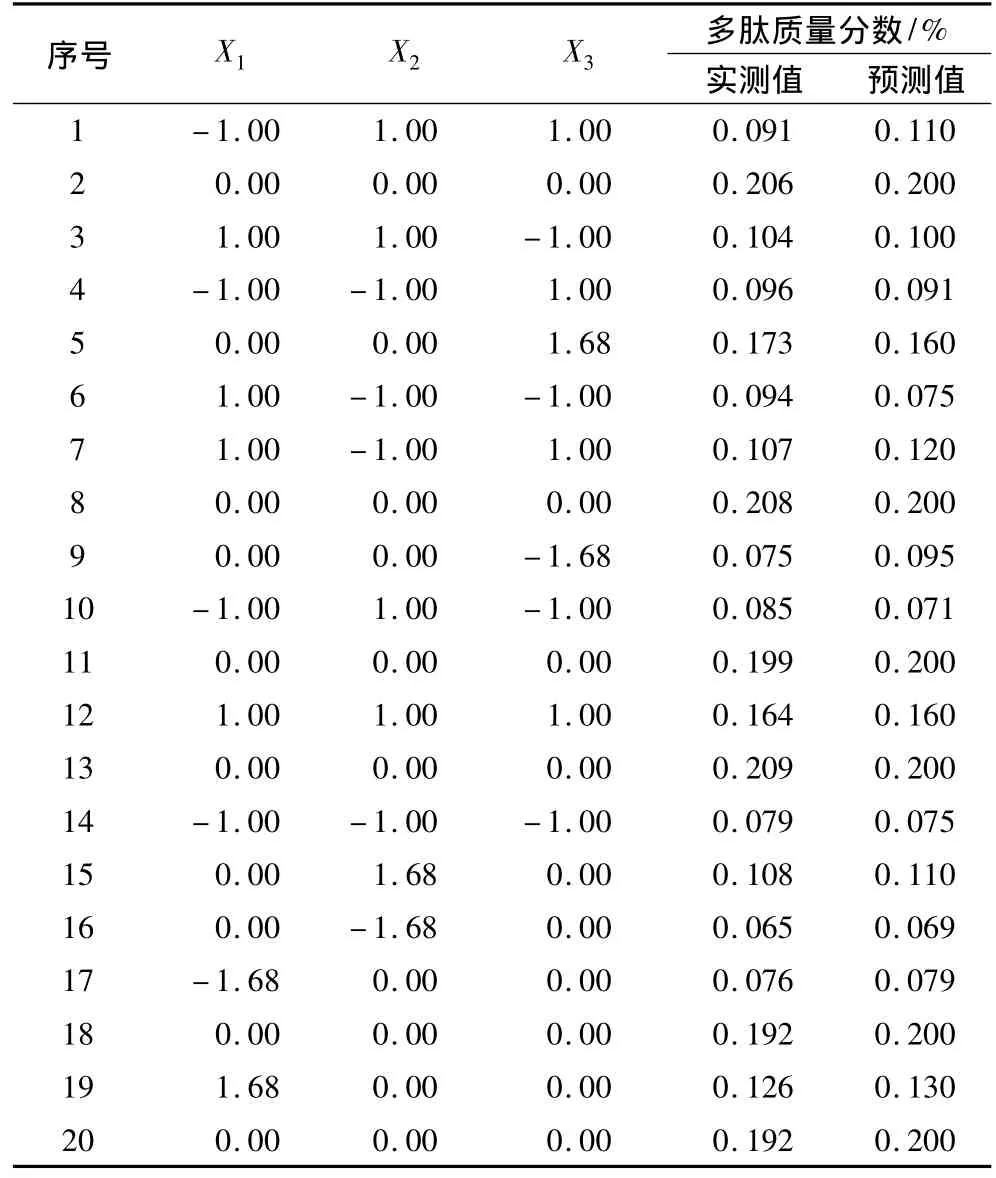
表5 中心复合响应面优化试验设计结果(含模型预测值)
对表5数据进行多元回归拟合可求出影响因素的一次、二次及交互效应关联方程,即 y=0.20+0.015x1+0.010x2+0.019x3+8.250E - 003x1x2+6.250E -003x1x3+4.500E -003x2x3-0.034x12-0.040x2-0.026x32。
2.3.2 模型方差分析与回归方程显著性分析
模型方差分析结果如表6。
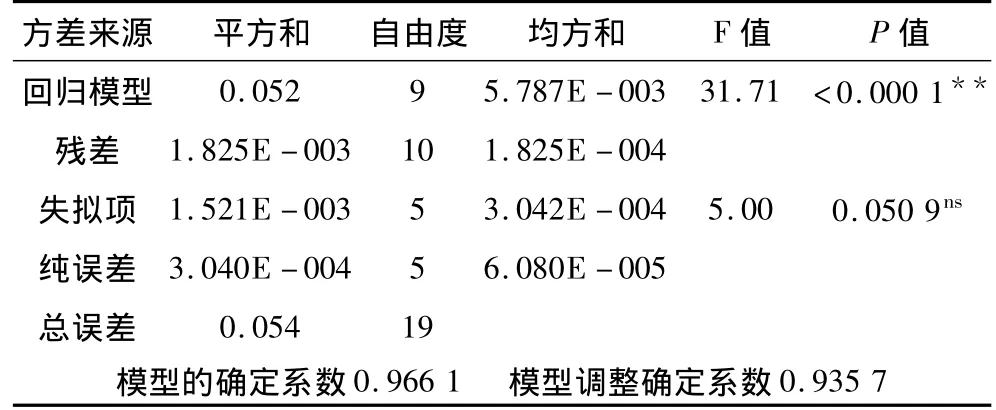
表6 回归模型方差分析表
由表6可看出,模型极显著(P<0.000 1),模型失拟项不显著(P=0.050 9>0.05),说明用此二阶回归模型对数据进行拟合是合适的,不需用更高阶模型进行数值模拟。回归模型R2=0.966 1,RAdj2=0.935 7,说明该模型可以解释总变异的93.57%。模型信躁比为13.641,大于4,说明模型精度是符合要求的[8]。
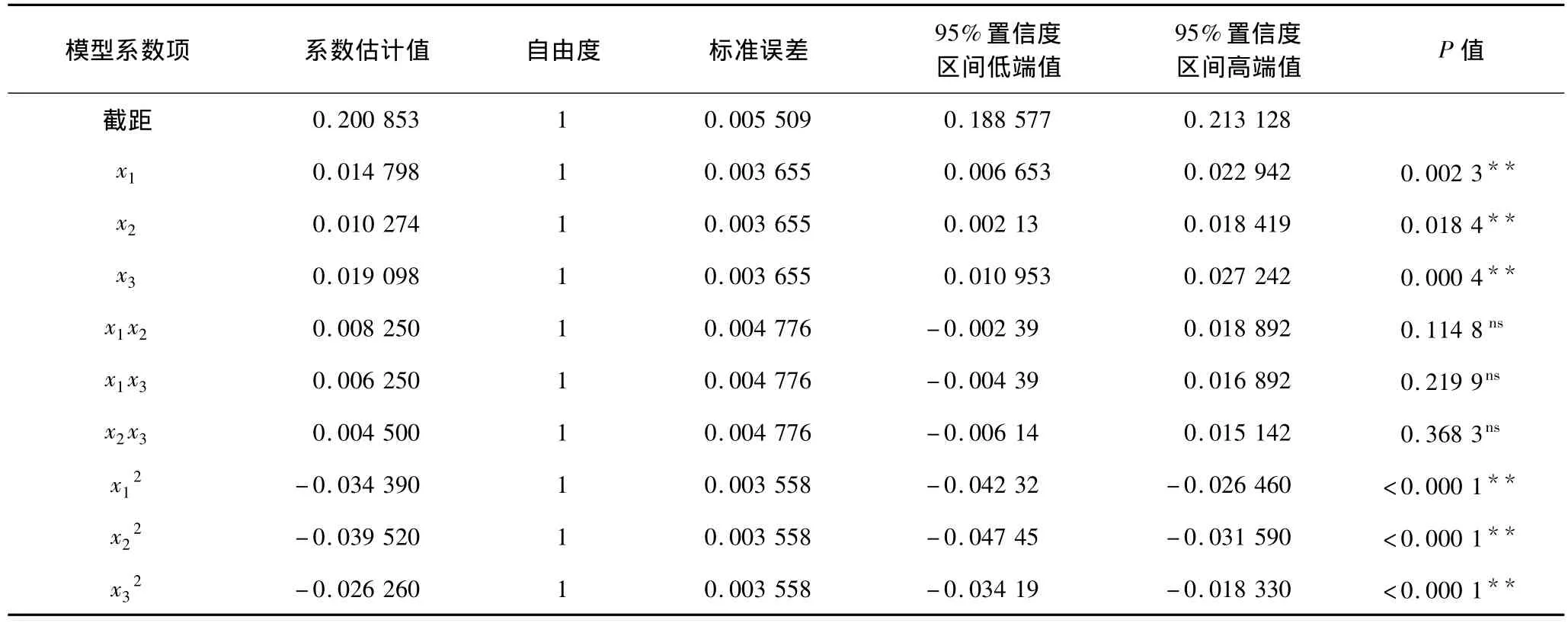
表7 回归方程系数显著性检验表 (全模型)
对回归方程进行系数显著性分析检验,结果如表7所示。由表7可以看出,模型一次项x1和x3影响为极显著(P <0.01),x2影响显著(P <0.05)。二次项x12,x22和x33均极显著(P <0.01),模型交互作用项 x1x2,x1x3和 x2x3影响均不显著(P >0.05)。
2.3.3 回归拟合模型诊断
模型正确性可通过残差分析进行评价。用内部t化残差进行模型分析是基于模型无法完全解释变异基础上进行的。残差分析主要以图形方法进行评价[9]。在模型诊断中,开展误差方差齐性检验是非常有必要的,因为如果模型选择合适,其残差呈正态分布[10]。由图1A可以看出,预测值的内部t化残差分布是随机分布的,所以,残差方差齐性是符合要求的。除此之外,合理的模型还要求模型残差要呈正态概率分布[11],模型残差正态分布如图1B所示。由图1B可以看出,残差分布呈正态性且相互独立。因此,本试验拟合的数值模型是可行的。
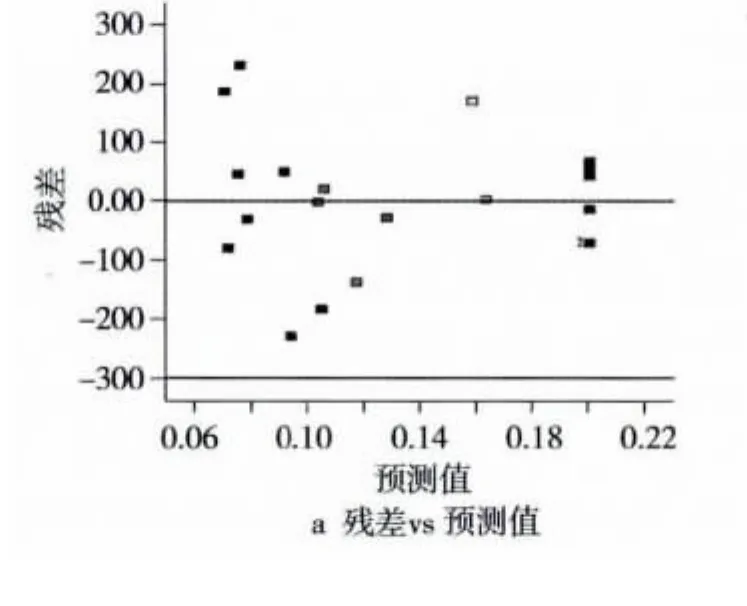
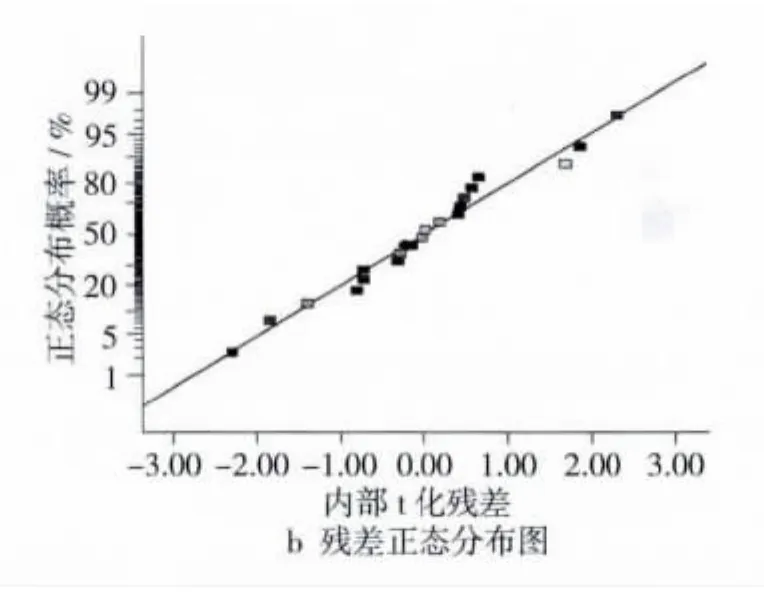
图1 模型诊断图和残差正态分布概率图
2.3.4 响应面优化分析
响应面图是所拟合的数值模型在数据区域的图形化表征[9,12]。在响应面分析中,若观察某两个因素同时对响应值的影响可借助降维分析[13],即在其他因素条件固定在零水平的情况下,观察两个因素对响应值的影响并得到影响的二次方程以及响应面图和等高线图。等高线图能直观反映因素交互作用对响应值的影响,圆形表示因素间交互作用不明显,椭圆形则表示交互作用显著。由图2可以看出,x1x2,x2x3和 x1x3交互作用不明显(P >0.05)。设计筛选出主效因子并借助爬陡坡试验使各主效因子同时逼近最优邻域,确定中心复合设计中心水平,然后利用中心复合响应面设计对酶解条件进行了优化并获得最优酶解条件,即酶浓度[E]=4 300 U/[S],底物浓度[S]=10.0%和酶解时间为85 min,最优条件下进行验证试验以考察模型拟合度及试验稳定性,试验结果为(0.209 ±0.005)%(n=6),接近模型预测值,说明该模型可很好的用于冷榨花生粕蛋白质酶促水解制备活性多肽工艺的预测。
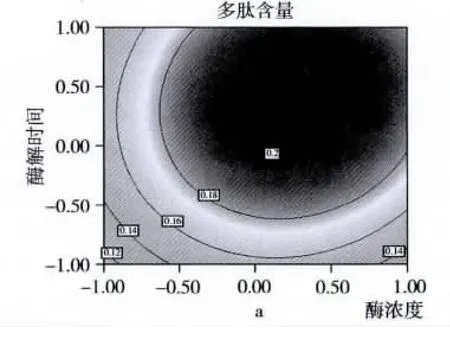
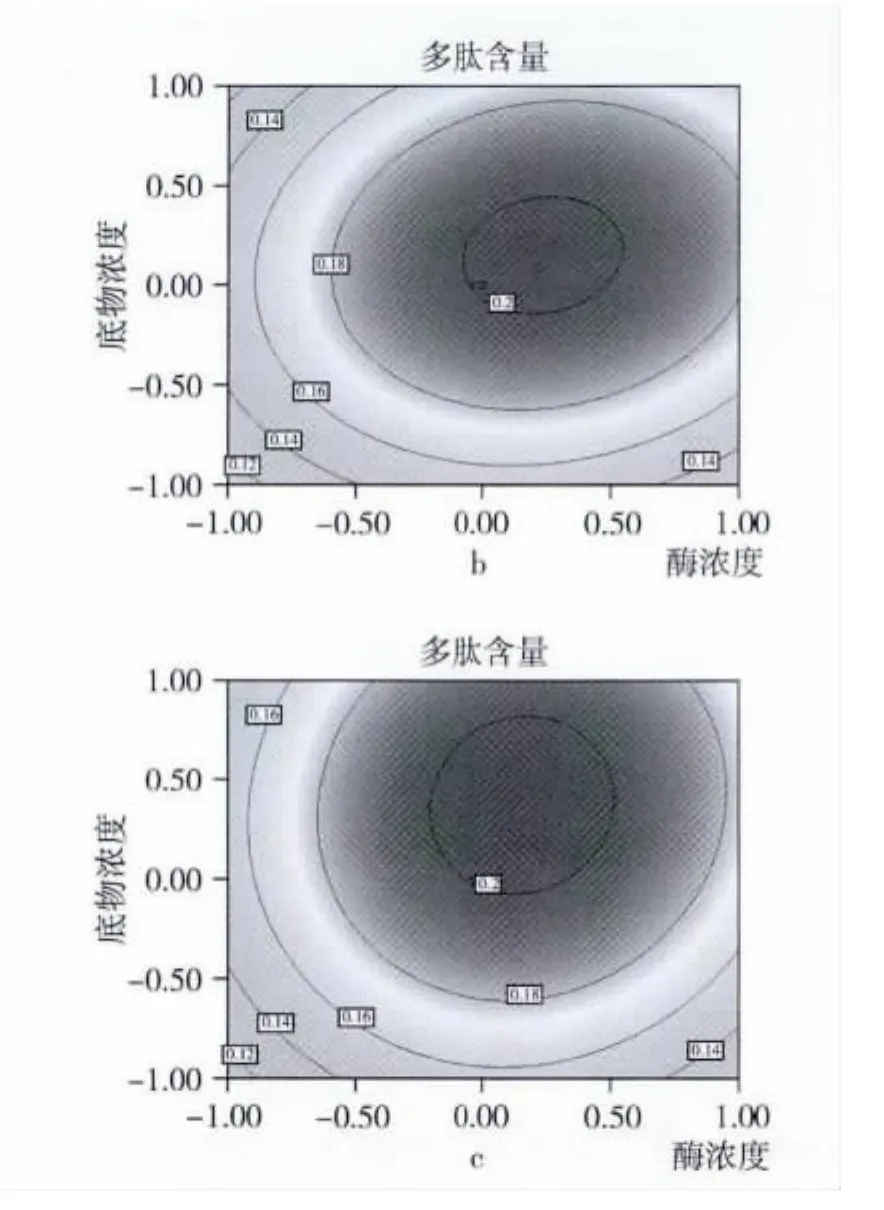
图2 y=f(X1,X2),y=f(X1,X3)和 y=f(X2,X3)等高线图
2.3.5 方程最优解求解与验证试验
将回归方程分别对各自变量求偏导数并令其等于零,可得到下列三元一次方程组:
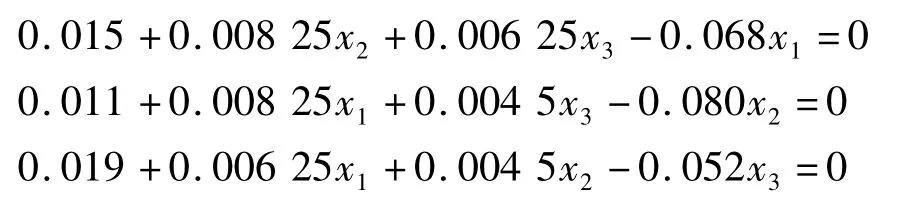
利用Maxima5.20.1进行规划求解可得到方程解分别为 x1=0.28,x2=0.19 和 x3=0.42。经转换,可得到实际的因素水平为酶浓度[E]=4 333 U/[S],底物浓度[S]=10.23%,酶解时间为 85.04 min。为实际操作方便,将试验条件修约为酶浓度[E]=4 300 U/g[S],底物浓度[S]=10.0%和酶解时间为85 min。在最优条件下进行验证试验,酶解液中多肽质量分数为(0.209 ±0.005)%(n=6),与预测值0.207 8%接近,偏差为5.77%。
3 讨论与结论
超声波借助空化作用与机械作用可断裂蛋白质中化学键,有利于改善酶解环境并使酶解效率得到有效提升,还可改善花生蛋白质酶解后的营养与生物学功能[14]。蛋白酶酶促水解是一个高度复杂的非线性过程,酶解过程具有高度的产物多样性与动力学复杂性[5]。为了对酶解过程进行数值分析并研究各因素对响应值(多肽含量)的影响,本文利用析因
[1]胡志和,郭嘉.利用冷榨花生饼制备花生多肽饮料[J].食品科学,2011,32(20):335 -340
[2]张氽,魏益民,张波,等.蛋白质含量对花生粕组织化产品质量的影响[J].中国农业科学,2007,40(8):1753 -1759
[3]刘明津.我国花生加工产业现状分析[J].广东农业科学,2011,(17):161 -164
[4]张伟,孙智达,徐志宏.花生多肽的制备及生理功能的研究进展[J].中国油脂,2007,32(1):74-76
[5]齐威,何志敏,何明霞.基于蛋白质结构知识解析活性多肽的酶解制备反应行为(I)-酶解反应动态特性的32D图形表[J].化工学报,2005,56(12):2387 -2391
[6]白永莲,张洪林,邱峰.酶水解制备花生粕多肽工艺的优化[J].生物技术,2009,19(6):74-77
[7]L DAVIES O P G E,C.LEWIS R.The design and analysis of industrial experiments[M].London:Longman Group Limited,1978
[8]谈佳玉,王承明.响应面法优化酶法制备花生蛋白的工艺研究[J].中国粮油学报,2011,26(8):100-104
[9]RYAD A,LAKHDAR K,MAJDA K S,et al.Optimization of the culture medium composition to improve the production of hyoscyamine inelicited datura stramonium L.hairy roots using the response surface methodology(RSM)[J].International journal of molecular sciences,2010,11(11):4726 -4740
[10]MONTGOMERY D C.Design and analysis of experiments[M].John Wiley & Sons,Inc.:New York,NY,USA,2008
[11]N.R.D,SMITH H.Appliedregression analysis(2nded)[M].John Wiley& Sons Publication New York,NY,USA,1981
[12]金梅,赵瑞昌,姜东,等.响应面法优化麦麸蛋白超声波-酶法提取工艺[J].中国粮油学报,2010,25(8):6-14
[13]李玉珍,肖怀秋,杨涛,等.响应面优化低值豆粕液态制备多肽工艺[J].大豆科学,2012,31(4):649 -654
[14]邓红,仇农学,孙俊.超声波辅助提取文冠果籽油的工艺条件优化[J].农业工程学报,2007(13):249-254.
