Klebsiella sp.B-36的分离鉴定及产脂肪酶特性研究
2013-09-17张开平高春媛
惠 明 张开平,2 田 青 高春媛
(河南工业大学生物工程学院1,郑州 450001)
(百色学院2,百色 533000)
脂肪酶(EC3.1.1.3)又称三酰基甘油水解酶,是继蛋白酶和糖化酶之后的第三大类酶[1],是一类可催化长链脂肪酸甘油酯分解成甘油和长链脂肪酸的生物催化剂,也可以催化该反应的逆反应[2]。脂肪酶广泛存在于动物、植物和微生物中,其中微生物来源脂肪酶极其丰富,具有比动植物源脂肪酶更宽的作用pH和作用温度范围,便于工业化生产获得高纯度酶制剂[3]。近年来,国内外很多学者对脂肪酶耐高温、耐酸等特性提出了新的要求,并且已成为一个新的研究热点,但耐高温、耐酸性脂肪酶产生菌的培养条件十分苛刻,脂肪酶的获得非常困难,相关研究论文并不多见[4-6]。针对脂肪酶在工业应用中的特殊酶学性质需求,寻找性能优良的耐热、耐酸以及符合现代生物工程需求的产脂肪酶菌株是脂肪酶应用研究开发的基础,因此,获得耐高温酸性脂肪酶产生菌具有重要意义。本试验从郑州市西郊富含油酯的土壤中分离筛选目标菌株,并对其酶学特性进行初步研究,为后续菌种改良及该菌产耐高温酸性脂肪酶的应用奠定了基础。
1 材料和方法
1.1 材料
1.1.1 土样采集
在郑州西郊的榨油厂、饲料厂、汽车修理厂、花生地、菜市场、餐厅下水道等富含油污的土壤中,共采集50余个样本,标记后备用。
1.1.2 主要试剂和仪器
主要试剂:橄榄油(西班牙产)、聚乙烯醇、三丁酸甘油酯、溴甲酚紫、吐温-80:国产分析纯。
主要仪器:HZQ-F160全温振荡培养箱:哈尔滨东联电子有限公司;PYX-DHS隔水式电热恒温培养箱:上海跃进医疗器械厂;H1650-W台式高速离心机:长沙湘仪仪器有限公司;YS 100摄像显微镜:日本Nikon;BSll0S电子天平:北京赛多利斯有限公司;JSM-6390LV型扫描电子显微镜:日本电子株式会社;TP600 PCR扩增仪:日本 TaKaRa BIO INC.;Mupid核酸电泳仪:泰国 ADVANCE-BIO Co.,Ltd;3730XL DNA测序仪:美国 Applied Biosystem公司等。
1.1.3 培养基
富集培养基(g/L):酵母膏 5.0,KH2PO41.5,Na2HPO42.0,NaCl 0.5,MgSO4·7H2O 1.0,橄榄油10.0 mL/L,pH 6.0。
溴甲酚紫平板初筛培养基(g/L):蛋白胨10.0,牛肉膏 5.0,NaCl 5.0,K2HPO41.0,琼脂 15.0,PVA- 橄榄油乳化液120 mL/L,Tween -80 4.0 mL/L,pH 6.0。培养基冷却到60℃时,按0.4%加入过滤除菌后的溴甲酚紫指示剂(50 mg/100 mL,pH 6.5),无菌条件下乳化倒平板。
种子培养基(g/L):蛋白胨 5.0,MgSO4·7H2O1.0,K2HPO41.0,(NH4)2SO45.0,葡萄糖 10.0,橄榄油 10.0 mL/L,pH 6.0。
发酵培养基(g/L):蛋白胨 5.0,酵母膏 20.0,蔗糖20.0,MgSO4·7H2O 1.0,(NH4)2SO42.0,K2HPO41.0,橄榄油 10.0 m/L,pH 6.0。
三丁酸甘油酯培养基:PVA-三丁酸甘油酯乳化液20.0 mL,LB 培养基18.0 mL,pH 5.5 乙酸 -乙酸钠缓冲液 1 000 mL,琼脂 18.0 g。
1.2 方法
1.2.1 产脂肪酶菌株的筛选
富集培养:称取2 g土样溶于20 mL无菌水中,振荡摇匀制成土壤悬液,静置,取每种土壤悬液3 mL加入到盛有50 mL富集培养基的三角瓶中,置于45℃、160 r/min摇床振荡培养48 h后,无菌操作移取1 mL培养液至另一盛有新鲜富集培养基的三角瓶中继续培养,相同条件下重复富集培养3轮[7]。
初筛培养:吸取1.0 mL富集培养液于9.0 mL无菌水中,将菌液进行梯度稀释至1×10-5~1×10-7倍,分别取 50 μL涂布于平板初筛培养基,40℃倒置培养48~72 h,观察有无黄色透明水解圈,通常菌落水解圈直径与菌落直径之比值(D/d)越大,该菌株产酶能力越强。将水解圈大的单菌落挑至斜面培养基上进行划线培养,然后4℃保藏,以供复筛备用[8]。
复筛培养:将初筛挑选的菌株进行划线分纯。挑取一环分纯后的菌落转接到种子培养基中,40℃、160 r/min摇床振荡培养24 h后按1%的接种量转接到发酵培养基中,40℃、160 r/min摇床振荡培养48 h[9]。
1.2.2 粗酶液的制备
Klebsiella sp.B-36经富集培养48 h后,取少量发酵液,12 000 r/min,4℃离心20 min,收集上清液即为粗酶液[10]。
1.2.3 酶活测定
采用橄榄油-聚乙烯醇乳化液滴定法,参照国标 GB/T 23535—2009[11]。
1.2.4 酶活定义
1 mL液体酶,在40℃和pH 7.5条件下,反应15 min,每分钟水解底物产生1 μmol可滴定的脂肪酸,即为1个酶活力单位(U),以U/mL表示。
1.2.5 酸性脂肪酶菌株的筛选
采用三丁酸甘油酯琼脂平板鉴定法,操作步骤参考王琰等[12]。
1.2.6 菌株鉴定
形态观察:根据《伯杰细菌鉴定手册》[13]以及《常见细菌系统鉴定手册》[14],对筛选的菌株进行菌落形态和生理生化鉴定。
分子鉴定:测定特异性基因(16S rDNA)序列,将测序结果在NCBI上检索比对。试验方法如下:①变性:挑取B-36菌体于50 μL TaKaRa Lysis Buffer for Microorganism to Direct PCR(Code No.D304)中变性后离心取上清作为模板,反应条件为80℃,15 min。②PCR扩增:使用TaKaRa 16S rDNA Bacterial Identification PCR Kit(Code No.D310)进行PCR扩增目的片段,反应体系为前述①的变性反应液1 μL,PCR Premix 25 μL,Forward primer(20 pmol/μL)0.5 μL,Reverse primer2(20 pmol/μL)0.5 μL,16S - free H2O 23 μL;反应程序:预变性94 ℃,5 min,1 cycle;94 ℃变性 1 min,55 ℃退火1 min,72 ℃延伸1.5 min,30 cycles;72℃延伸5 min,1 cycle;取5 μL扩增产物进行3%琼脂糖凝胶电泳,使用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.3.0(Code No.D823A),切胶回收目的片段。③测序:以Seq Forward、Seq Internal和Seq Reverse为引物进行DNA测序。
1.2.7 酶学特性研究
酶反应最适温度及热稳定性:将酶液分别在35~75℃条件下测酶活,确定该酶的最适反应温度,然后将酶液分别置于不同温度(40~80℃)的恒温水浴锅中保温70 min,每隔10 min取样测定残余酶活[15]。
酶反应的最适pH值和pH稳定性:用磷酸盐缓冲液作为缓冲体系进行脂肪酶水解活力的测定,在不同pH(2.0~8.0)条件下测酶活,确定该酶的最适pH值,然后将酶液与不同pH值(2.0~6.0)缓冲液以1∶3的比例混合,40℃静置1 h后测酶活[16]。
金属离子对酶活力的影响:分别将酶液与10 mmol/L 的 Ca2+、K+、Fe3+、Mn2+、Cu2+、Zn2+、EDTA、Na+和Mg2+等体积混合,室温下静置1 h后测酶活,以未添加任何金属离子的反应体系作为对照[7]。
2 结果与分析
2.1 产脂肪酶菌株的筛选
经过富集、初筛、复筛等过程,用溴甲酚紫平板从富含油脂的土壤中筛选得到产脂肪酶的菌株,其中大部分的酶活都在5.0~9.6 U/mL之间。对酶活力9.0~9.6 U/mL的菌株进行酸性三丁酸甘油酯平板筛选,得到8株能够在pH 5.5的酸性平板上生长并且有透明的水解圈,将以上筛选到的8株菌按1%的接种量转接于发酵培养基中,40℃、160 r/min培养48 h后测酶活,其中B-36菌株酶活力最高,为9.2 U/mL。虽然其初步发酵酶活力同已知相关菌种伯克氏菌(Burkholderia pseudomallei)(酶活力达50.50 U/mL)[17]及地霉属(Galactomyces geotrichum)真菌 FL002(酶活力达 75.50 U/mL)[12]有一定差距,但考虑到菌种资源发掘的特殊性(事实上采用Klebsiella sp.发酵产耐高温酸性脂肪酶在国内外未见报道),本试验选择B-36菌株作为出发菌株,对其进行酶学特性研究。
2.2 菌株鉴定
2.2.1 形态学及生理生化鉴定
将筛选到的B-36菌株涂布于溴甲酚紫平板初筛培养基上进行形态观察,发现其菌落呈黄色或橙色,表面光滑凸起,革兰氏染色阴性,扫描电镜(SEM)观察(图1),菌体大小为0.5 ~0.8 ×1 ~3 μm之间,单独、成双或短链状排列,无芽孢,无鞭毛。常规生理生化测试表明,菌株B-36甲基红试验阴性,V.P.试验阴性,接触酶阳性,氧化酶阴性,发酵葡萄糖、麦芽糖,乳糖、木糖、蔗糖、D-山梨醇,不发酵D-阿拉伯糖、D-甘露醇,水解淀粉,石蕊牛奶试验阴性,柠檬酸盐试验阴性,硫化氢试验阴性,硝酸盐还原试验阳性,亚硝酸还原阴性,不液化明胶,产脂酶,不产脲酶,不产吲哚。
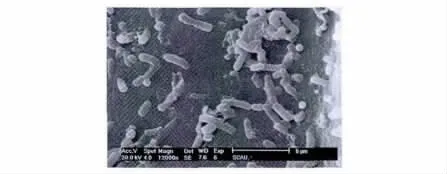
图1 菌株B-36的形态观察(SEM)(放大12 000倍)
2.2.2 分子生物学鉴定
菌株B-36 16S rRNA基因含有高度保守的基因片段,大约1.5 Kb,其PCR扩增产物3%琼脂糖凝胶电泳见图2,在1 000~2 000 bp之间有明显的条带,这表明PCR反应扩增出了预期长度的16S rDNA序列,送到大连宝生物工程有限公司进行测序,将测得的序列提交GenBank数据库中进行BLAST比对(登录号:JQ793784),用 MEGA 4.1构建系统进化树。构建结果如图3。与菌株B-36序列相似度高的相关菌株均为克雷伯氏菌属,系统发育分析得出该菌与 HM352367.1(Klebsiella sp.)在同一个分支上,亲缘关系最近,相似性达99%以上,再结合形态和生理生化特征,可以初步鉴定该菌为克雷伯氏菌,命名为 Klebsiella sp.B -36。
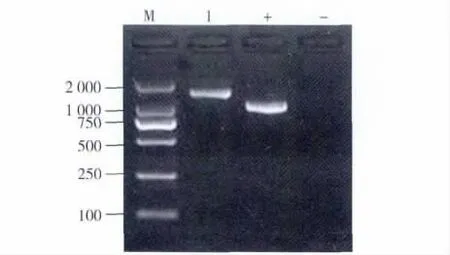
图2 16S rDNA基因PCR反应产物凝胶电泳结果
由宝生物工程(大连)有限公司测得的B-36菌株16S rDNA序列如下:ACGCTGGCGGCAGGCCTAA CACATGCAAGTCGAGCGGTAGCACAGAGAGCTTGCT CTCGGGTGACGAGCGGCGGACGGGTGAGTAATGTCT GGGAAACTGCCTGATGGAGGGGGATAACTACTGGAA ACGGTAGCTAATACCGCATAACGTCGCAAGACCAAA GTGGGGGACCTTCGGGCCTCATGCCATCAGATGTGCC CAGATGGGATTAGCTGGTAGGTGGGGTAACGGCTCAC CTAGGCGACGATCCCTAGCTGGTCTGAGAGGATGACC AGCCACACTGGAACTGAGACACGGTCCAGACTCCTA CGGGAGGCAGCAGTGGGGAATATTGCACAATGGGCG CAAGCCTGATGCAGCCATGCCGCGTGTGTGAAGAAG GCCTTCGGGTTGTAAAGCACTTTCAGCGGGGAGGAAG GCGGTGAGGTTAATAACCTTGTCGATTGACGTTACCC GCAGAAGAAGCACCGGCTAACTCCGTGCCAGCAGCC GCGGTAATACGGAGGGTGCAAGCGTTAATCGGAATT ACTGGGCGTAAAGCGCACGCAGGCGGTCTGTCAAGT CGGATGTGAAATCCCCGGGCTCAACCTGGGAACTGCA TTCGAAACTGGCAGGCTAGAGTCTTGTAGAGGGGGG TA GAATTCCAGGTGTAGCGGTGAAATGCGTAGAGAT CTGGAGGAATACCGGTGGCGAAGGCGGCCCCCTGGA CAAAGACTGACGCTCAGGTGCGAAAGCGTGGGGAGC AAACAGGATTAGATACCCTGGTAGTCCACGCTGTAAA CGATGTCGATTTGGAGGTTGTGCCCTTGAGGCGTGGC TTCCGGAGCTAACGCGTTAAATCGACCGCCTGGGGAG TACGGCCGCAAGGTTAAAACTCAAATGAATTGACGGGGG CCCGCACAAGCGGTGGAGCATGTGGTTTAATTCGA TGCAACGCGAAGAACCTTACCTGGTCTTGACATCCAC AGAACTTTCCAGAGATGGATTGGTGCCTTCGGGAACT GTGAGACAGGTGCTGCATGGCTGTCGTCAGCTCGTGT TGTGAAATGTTGGGTTAAGTCCCGCAACGAGCGCAAC CCTTATCCTTTGTTGCCAGCGGTCCGGCCGGGAACTC AAAGGAGACTGCCAGTGATAAACTGGAGGAAGGTGG GGATGACGTCAAGTCATCATGGCCCTTACGACCAGGG CTACACACGTGCTACAATGGCATATACAAAGAGAAG CGACCTCGCGAGAGCAAGCGGACCTCATAAAGTATG TCGTAGTCCGGATTGGAGTCTGCAACTCGACTCCATG AAGTCGGAATCGCTAGTAATCGTAGATCAGAATGCTA CGGTGAATACGTTCCCGGGCCTTGTACACACCGCCCG TCACACCATGGGAGTGGGTTGCAAAAGAAGTAGGTA GCTTAACTCTTCGGGAGGGCGCTTACCACTTTGTGATT CATGACTGGG(1455 bp)

图3 菌株B-36系统进化树
2.3 菌株B-36酶学特性
2.3.1 酶反应最适温度和热稳定性
在35~75℃,间隔5℃的不同温度下测酶活,结果如图4a可知,该酶的适宜反应温度为60℃,但是在75℃时,该酶依然存在50%的活性,属于高温脂肪酶。此外,将酶液置于40~80℃,间隔10℃的不同温度的恒温水浴锅中保温70 min,每隔10 min取样,在60℃下测酶活,用未经处理的酶液作对照。结果见图4b,该酶在60℃之内稳定性较好,处理70 min中酶活力还保持在80%以上,当温度超过60℃时,酶活力逐渐降低,但70、80℃处理30 min后对酶活力无显著影响,均保持在80%以上。70℃处理70 min后还有70%的酶活力;80℃处理70 min后还有46%的酶活力,说明该酶具有良好的热稳定性。目前,国外已报道热稳定性较好的耐热脂肪酶——环状芽孢杆菌(Bacillus circulansⅢB153)脂肪酶,该酶在40~60℃之间具有良好的热稳定性,在60℃处理1 h后还有80%以上的酶活力;80℃处理1 h后还有45%的酶活力[18]。国内已报道根霉SFE-L01脂肪酶,该酶在30~60℃之间具有良好的热稳定性,在70℃处理70 min后还有62%的酶活力,80℃处理70 min后还有35%的酶活力[19]。

图4 B-36产脂肪酶作用的最适温度及酶的热稳定性
2.3.2 酶反应的最适pH值和pH稳定性
配制pH 2.0~8.0、间隔1个 pH值单位的缓冲液,测相同酶液在不同pH值条件下的酶活力,结果如图5a,该酶作用的适宜pH 4.0,可见该酶是一种酸性脂肪酶。对该酶进行耐酸性试验,将酶液与不同pH 值(2.0 ~6.0)缓冲液以1∶3 的比例混合,40 ℃静置1 h,再将酶液调回到最适pH值测酶活,用未经处理的酶液作对照。结果如图5b,该酶在酸性环境中保温1 h后可保持70%以的酶活力,尤其在pH 4.0时可保持83.2%的酶活力,因此,说明该酶在酸性条件下较为稳定。目前,国外已报道pH稳定性较好的耐酸性脂肪酶——嗜热青霉(Mesophilic Penicillium)脂肪酶,该酶在pH 4.0~6.0之间比较稳定,在pH 5.0时作用2 h后,仍能保持65%以上的酶活;80℃处理1 h后还有45%的酶活力[3]。国内已报道地霉属Galactomyces geotrichum FL002菌株产脂肪酶在pH 6.0~8.5 之间比较稳定,在pH 6.0 时作用1 h后,仍能保持80%的酶活力[12]。
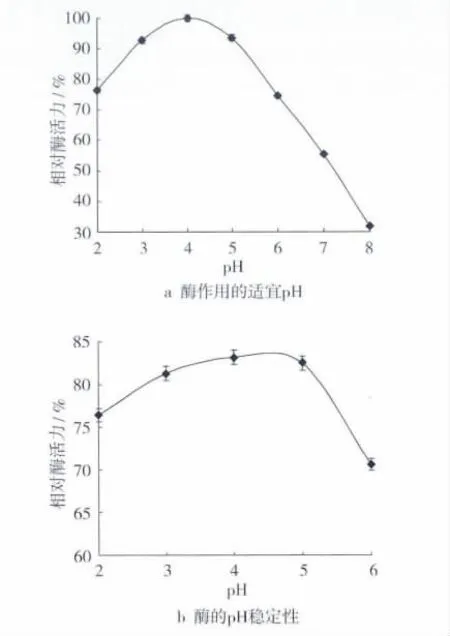
图5 脂肪酶作用的最适pH及酶的pH稳定性
2.3.3 金属离子及EDTA对脂肪酶稳定性的影响
分别将酶液与 10 mmol/L的 Ca2+、K+、Fe3+、Mn2+、Cu2+、Zn2+、Na+、Mg2+和 EDTA 等体积混合,室温下静置1 h后测酶活,以未添加任何金属离子的反应体系作为对照,结果如图6。Mg2+对脂肪酶的水解具有强烈的激活作用,使酶活力提高了2倍多;Ca2+、Mn2+、EDTA以及 Na+对酶有明显的激活作用,Fe3+、Cu2+及Zn2+对酶水解有较强的抑制作用,K+对酶几乎没有作用,初步判定该酶是金属离子依赖酶。
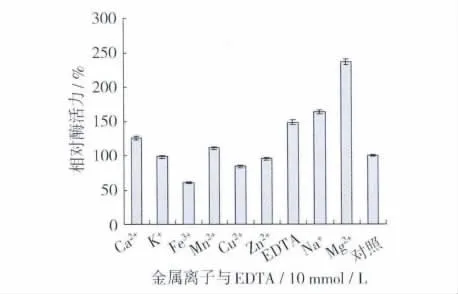
图6 金属离子及EDTA对酶稳定性的影响
3 结论
本试验从50余个土壤样品中分离筛选到8株产酸性脂肪酶的菌株,对其中一株高产菌株B-36通过形态观察、生理生化特征以及16S rDNA序列分析,鉴定为克雷伯氏菌(Klebsiella sp.)。对该菌株脂肪酶性质研究结果可知:其适宜作用温度为60℃,适宜作用pH 4.0,并且在60℃处理70 min中酶活力还保持在80%以上,说明该酶具有良好的热稳定性;同时该酶在酸性环境中保温1 h后可保持70%以上的酶活力,尤其在 pH 4.0时仍保持83.2%的酶活力,说明该酶在酸性条件下较为稳定。与其他种类的脂肪酶相比,Klebsiella sp.B-36所产脂肪酶兼具耐热和耐酸特性,具有较大的开发应用潜力,可以作为微生物脂肪酶生产的出发菌株,为菌种改良或构建高效脂肪酶基因工程菌奠定了基础。
[1]Contesini F J,Lopes D B,Macedo G A,et al.Aspergillus sp.lipase:potential biocatalyst for industrial use[J].Journal of Molecular Catalysis B:Enzymatic,2010,67(3):163 -171
[2]Guncheva M,Zhiryakova D.Catalytic properties and potential applications of Bacillus lipase[J].Journal of Molecular Catalysis B:Enzymatic,2011,68(1):1 -21
[3]Gutarra M L,Godoy M G,Maugeri F,et al.Production of an acidic and thermostable lipase of the mesophilic fungus Penicillium simplicissimum by solid - state fermentation[J].Bioresource Technology,2009,100(21):5249 -5254
[4]Fickers P,Marty A,Nicaud J M,et al.The lipases from Yarrowia lipolytica:genetics,production,regulation,biochemical characterization and biotechnological applications[J].Biotechnology Advances,2011,29(6):632 - 644
[5]Lafuente R F.Lipase from Thermomyces lanuginosus:uses and prospects as an industrial biocatalyst[J].Journal of Molecular Catalysis B:Enzymatic.2010,62(4):197 -212
[6]Rafael C,Roberto F L.Lipase from Rhizomucor miehei as an industrial biocatalyst in chemical process[J].Journal of Molecular Catalysis B:Enzymatic,2010,64(1):1 -22
[7]Arifin A R,Kim S J,Yim J H,et al.Isolation and biochemical characterization of Bacillus pumilus lipases from the antarctic[J].Journal of Microbiology and Biotechnology,2013,23(5):661-667
[8]Park D H,Yoo H Y,Ryu H W,et al.Isolation and screening lipase-producing soil bacteria and its application to biodiesel production[J].Journal of Biotechnology,2010,150:175 -180
[9]Mehta A,Kumar R,Gupta R,et al.Isolation of lipase producing thermophilic bacteria:optimization of production and reaction conditions for lipase from Geobacillus sp.[J].Acta Microbiologica et Immunologica Hungarica,2012,59(4):435 -450
[10]Velu N,Divakar K,Nandhinidevi G,et al.Lipase from Aeromonas caviae AU04:isolation,purification and protein aggregation[J].Biocatalysis and Agricultural Biotechnology,2012,1(1):45 -50
[11]GB/T 23535—2009,Lipase preparations[S]
[12]王琰,张志敏,王斌,等.耐酸性脂肪酶产生菌的筛选及酶学性质研究[J].饲料工业,2011,32(10):29 -33
[13]Buchanan R E,Gibbons N E.Bergey's manual of determinative bacteriology[M].8th ed.Balt7imore:The Williams and Wilkins Company,1974
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001
[15]Selvin J,Kennedy J,Lejon D P,et al.Isolation identification and biochemical characterization of a novel halo-tolerant lipase from the metagenome of the marine sponge Haliclona simulans[J].Microbial Cell Factories,2012(11):1475 -1486
[16]Tanaka D,Yoneda S,Yamashiro Y,et al.Characterization of a new cold-adapted lipase from Pseudomonas sp.TK -3[J].Applied Biochemistry and Biotechnology,2012,168(2):327-338
[17]闫丽娟,谢振荣,赵春雷,等.耐高温酸性脂肪酶菌株NJY-1-3的选育及发酵条件的研究[J].食品科技,2010,35(3):11 -15
[18]Johri S,Bhat A,Sayed S,et al.Novel thermostable lipase from Bacillus circulansⅢB153:comparison with the mesostable homologue at sequence and structure level[J].World of Journal Microbiology and Biotechnology,2012,28(1):193-203
[19]孙春艳,赵祥颖,董学前,等.1株产耐热脂肪酶根霉突变株的选育[J].食品与发酵工业,2012,38(3):109 -114.
