硫酸亚铁铵制备实验研究
2013-09-16任有良孙红丽
刘 萍,任有良,孙红丽
(商洛学院 化学与化学工程系,陕西商洛 726000)
硫酸亚铁铵 (NH4)2SO4·FeSO4·6H2O 俗称摩尔盐,是浅蓝绿色单斜透明晶体,在空气中比一般亚铁盐稳定,不易被氧化,能溶于水,不溶于酒精。因此在定量分析中常用来配置亚铁离子的标准溶液。
硫酸亚铁铵的制备是无机化学实验多年一直开设的一个典型的设计实验。无机化学实验教学大纲中将此实验作为学生的必做实验,因为它让学生了解复盐的一般特征和制备方法的同时,还能综合训练学生水浴加热、蒸发、浓缩、结晶、常压过滤等基本操作;但按照不同版本的教材[1-7]介绍的方法实验时,在反应时间、产率和纯度等方面出现了差异,本文在大量的实验基础上对影响该实验的各种因素进行了探究,重点在选取铁的种类、铁的去污方法和反应时间等因素进行了探究,并对产物的质量和等级进行了鉴定,探究出了该实验的最佳反应条件。
1 实验原理
制备硫酸亚铁铵比较简单,在实验室中一般都是先制备FeSO4,然后在FeSO4的水溶液中加入(NH4)2SO4,即可制得硫酸亚铁铵。
将过量的铁溶于稀H2SO4中,可制得FeSO4,其反应式为

向FeSO4水溶液中加入等物质的量的(NH4)2SO4,使其全部溶解,再加热浓缩,在冷却过程中会析出溶解度更小的硫酸亚铁铵,其反应式为
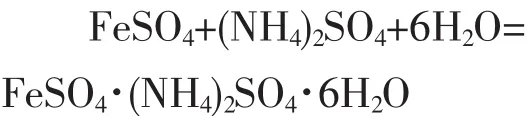
FeSO4·(NH4)2SO4·6H2O 在水中的溶解度比其组分FeSO4和(NH4)2SO4都要小。因此,从FeSO4和 (NH4)2SO4的混合水溶液中很容易得到结晶的摩尔盐。
2 教材上的制备方法及存在的问题
大学化学实验、无机及分析实验教材等[1-2]上的实验方案:在锥形瓶中放入2 g铁屑加入20 mL 1.0 mol·L-1Na2CO3溶液,小火加热约 10 min,以除去铁屑表面的油污。在盛有洗净铁屑的锥形瓶中,加入 15 mL 3.0 mol·L-1的 H2SO4溶液,放在水浴上加热,使铁屑与稀硫酸发生反应(在通风橱中进行)。根据已作用的铁的质量和反应式中的计量关系,按m FeSO4:m(NH4)2SO4=1:0.8(或1:0.75)称取所需硫酸铵固体的质量,在烧杯中配制(NH4)2SO4的饱和溶液;将(NH4)2SO4的饱和溶液倒入盛FeSO4的溶液中,蒸发浓缩,抽滤得硫酸亚铁铵晶体。
按教材介绍的方法制备硫酸亚铁铵时主要存在的问题:铁与硫酸完全反应时所用时间较长;由于铁中有杂质,当其与硫酸反应时会产生有毒、有害且具有刺激性气味的气体(PH3、H2S),对实验环境污染很大;铁表面油污处理方法较复杂;当做Fe3+的限量分析这一步时,硫酸亚铁铵溶液较容易被空气中的氧气所氧化,造成与标准溶液目测比色时的误差。
3 实验探究的内容与方法
本文从选取不同类型的铁屑及限量、表面除污方式、硫酸亚铁与硫酸铵的用量比等多个因素考虑,做了大量的探究性实验。
3.1 熟铁屑与生铁屑的比较
分别称取等量的生铁屑和熟铁屑,与等量的稀硫酸在其它条件相同的情况下反应以制备硫酸亚铁;进而制备硫酸亚铁铵。最后对实验的反应时间及产量等方面加以比较。
3.2 铁屑去油污方法的比较
在利用废铁屑制备硫酸亚铁铵时,因其表面有油污而需要清除。传统的方法是用Na2CO3溶液进行煮沸[8-9];本文采用直接灼烧的方法来清除。其它实验步骤相同于制备硫酸亚铁铵。对比反应时间、生成物的产率和纯度。
3.3 铁屑与硫酸反应的最佳用量
分别称取 2,3,4,5,6,7,8 g 的铁屑,再分别加入15 mL 3.0 mol·L-1的H2SO4溶液,放在水浴上加热,并以m FeSO4:m(NH4)2SO4=1:0.8制备硫酸亚铁铵。通过对反应时间、产物的产率、纯度的比较,以找出过量铁的最佳用量。
3.4 增加尾气吸收装置
在用熟铁代替生铁反应所述中,虽然缩短了反应时间,但熟铁与硫酸比生铁与硫酸反应时放出的有毒、有害且具有刺激性气味的气体(PH3、H2S)多[10-11],易造成实验环境污染,因此,本文在原反应器的基础上增加了自制的尾气吸收装置,其中铁屑与硫酸的反应仍在锥形瓶中进行,释放的有毒有害气体(PH3、H2S)可用 1 mol·L-1的氢氧化钠溶液直接吸收。实验装置如图1所示。
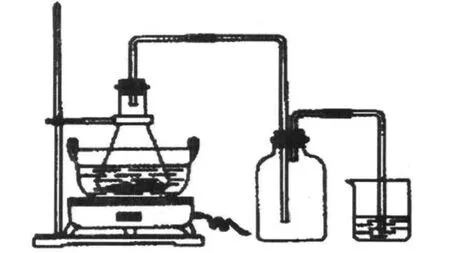
图1 制备硫酸亚铁铵改进后的实验装置
3.5 在纯度检验中增加油封举措
Fe(III)的限量分析:用烧杯将去离子水煮沸5 min,以除去溶解的氧,盖好、冷却后备用。称取1.00 g产品,置于比色管中,加入20.0 mL备用的去离子水,以溶解之,再加入 3.00 mL HCl(2.0 mol·L-1)溶液和0.05 mL KSCN(1.0 mol·L-1)溶液,最后以备用的去离子水稀释到25.00 mL,摇匀,再在溶液上部滴加数滴植物油油封液面,与空白对照进行比较。然后分别与标准溶液进行目测比色,以确定产品等级。
4 结果与讨论
4.1 原料类型对产物产率、纯度及反应时间的影响
分别称取2 g左右生铁屑和熟铁屑做实验,对比铁与稀硫酸完全反应的时间、产物的产率及 纯度;平行3次实验,实验数据记录见表1。
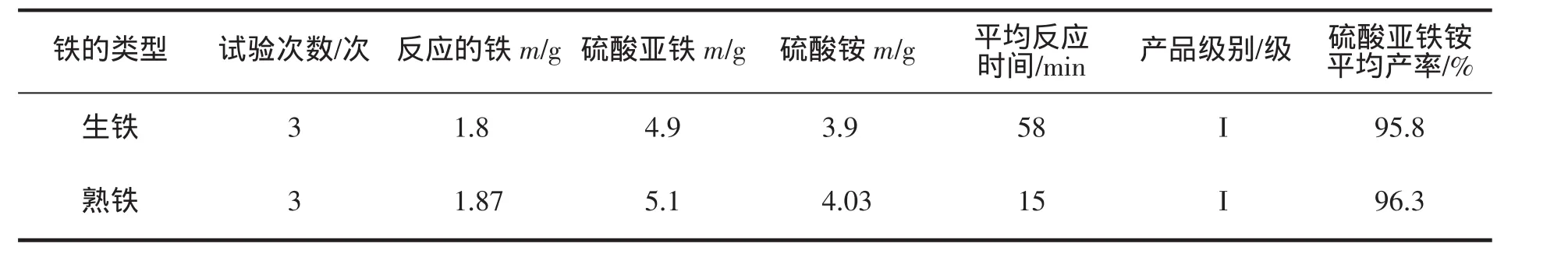
表1 相同质量的生铁屑与熟铁屑制备硫酸亚铁铵对比
通过表1中实验数据及实验过程中的现象表明:以相同质量的生铁屑和熟铁屑制备硫酸亚铁铵在其他条件相同的情况下,其反应区别有:熟铁屑比生铁屑制备的硫酸亚铁铵的产率稍高;熟铁屑比生铁屑与稀硫酸完全反应需要的时间要成倍的减少;熟铁屑比生铁屑与稀硫酸在水浴加热的条件下反应时放出有毒、有害且具有刺激性气味的气体(PH3、H2S)要多;熟铁屑与生铁屑制备的硫酸亚铁铵纯度等级一样。
在实验中,利用熟铁屑比生铁屑可以大大地节省时间和放出较多有毒的气体,这完全决定于两种铁屑的组成成分和结构性能。因为:熟铁的抗腐蚀性比生铁的较差,所以前者与硫酸反应的速率比后者要大;熟铁的含碳量虽比生铁小,但含磷、硫的杂质并不少,故在反应较快的情况下产生的有毒气体也相对的较多。
4.2 不同用量比的硫酸亚铁与硫酸铵对产率的影响
FeSO4与 (NH4)2SO4用量比分别以1:0.8和1:0.75做实验,平行3次,其产率的实验数据记录见表2。
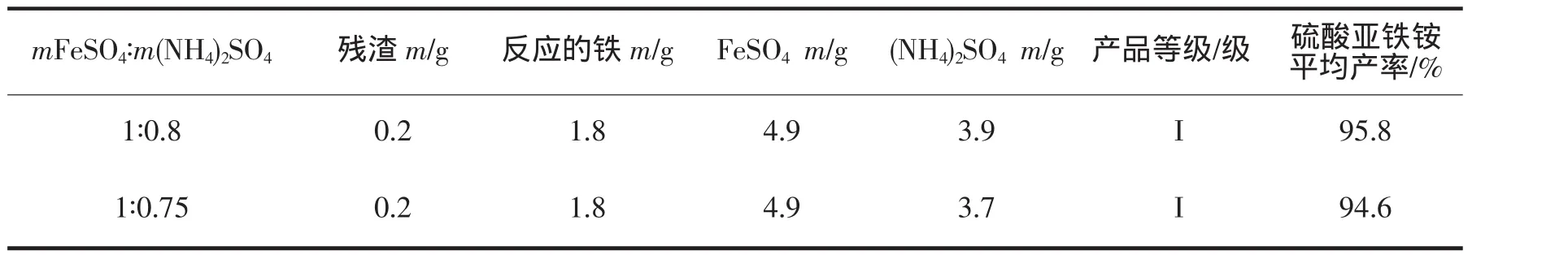
表2 FeSO4与(NH4)2SO4不同用量比的产率对比
由表2实验结果表明:在其他条件相同的情况下,以m FeSO4:m(NH4)2SO4=1:0.8比m FeSO4:m(NH4)2SO4=1:0.75制备的硫酸亚铁铵产率较高。
4.3 去油污方法的比较
分别称取2 g左右生铁屑编号a、b,将a铁屑放入到蒸发皿中加热,用直接灼烧去污的方法除去铁屑表面的油污,直至蒸发皿上空不再冒烟为止,表明铁屑表面的油污已除净(根据油的挥发点,当铁屑加热到一定温度达到油的挥发点时铁屑表面的油污就会挥发掉);再将b铁屑以普通去油污的方法(即将其放入到150 mL锥形瓶中,加入1.0 mol·L-1的Na2CO3溶液20 mL,小火加热约10 min,以除去铁屑表面的油污,用碱液清洗除去碱液,并用水将铁屑洗净)除去其表面的油,接下来同4.1的实验步骤相同,制备硫酸亚铁铵,同以上方法重复做3组这样的实验,对比反应时间、产物的产率和纯度,记录数据见表3。

表3 灼烧法与普通油污法制备硫酸亚铁铵对比
由表3实验数据及实验过程中的现象表明:将铁屑放在蒸发皿中灼烧除去铁屑表面油污的方法比普通除去铁屑表面油污的方法制得的硫酸亚铁铵的产量高,从产物的级别来看两个都差不多。实验结果表明:采用灼烧法除去铁屑表面油污的方法比传统方法简单省事,缩短反应的时间,且有利于反应的发生。
4.4 铁的用量对实验时间的影响
称取7组不同质量的生铁屑,经灼烧去油后,分别与15 mL 3.0 mol·L-1的H2SO4溶液反应(放在水浴上加热)及加入一定量的(NH4)2SO4来制备硫酸亚铁铵。所用的时间及产物产率的实验数据见表4。

表4 不同质量的铁制备硫酸亚铁铵对比
由表4结果表明:过量的铁与相同量的稀硫酸完全反应所用的时间较短,因为过量的铁大大增加了铁与硫酸的接触面积,从而减短了反应时间。但是增加也不是无限制的,以硫酸能完全浸湿增加的铁为宜。否则,铁过量太多将会造成没必要的原料浪费。由实验结果可知,每取15 mL 3.0 mol·L-1的H2SO4溶液时,铁屑的用量以5-6 g较合适。
4.5 Fe(III)的限量分析中油封的效果
Fe(III)的限量分析时,由于产品溶液的配置存在着一定的时间差,比色管上部的溶液与空气直接接触,溶液中的Fe(II)易被空气中的氧所氧化,故而造成比色误差。在溶液表面滴数滴油形成油封,防止其被氧化。通过实验对比,充分证实了这一点。
5 结论
本文在大量实验的基础上探究出了该实验的最佳方案:在锥形瓶中放入5-6 g事先灼烧过的熟铁屑,加入15 mL 3.0 mol·L-1的H2SO4溶液,然后安装好尾气吸收装置,放在水浴上加热(如图1所示),使铁屑与稀硫酸发生反应。根据已作用的铁的质量和反应式中的计量关系,按m FeSO4:m(NH4)2SO4=1:0.8称取所需硫酸铵固体的质量,在烧杯中配制 (NH4)2SO4的饱和溶液;将(NH4)2SO4的饱和溶液倒入到盛FeSO4的溶液蒸发皿中,蒸发浓缩,冷却,抽滤得到硫酸亚铁铵晶体。做产品的纯度检验时,最好在比色管的液面上采用油封的办法。采用最佳的实验方案可以大大缩短反应时间,提高产率,并减少了实验室环境的污染。
[1] 何水样,崔 斌,张维平,等.大学化学实验(I)[M].西安:西北大学出版社,2005.
[2] 蒋碧如,潘润身.无机化学实验[M].北京:高等教育出版社,1989.
[3] 浙江大学普通化学教研组.普通化学实验[M].3版.北京:高等教育出版社,1996.
[4] 南京大学《无机及分析化学实验》编写组.无机及分析化学实验[M].4版.北京:高等教育出版社,2006.
[5] 李 朴,古国榜.无机化学实验[M].2版.北京:化学工业出版社,2005.
[6] 史长华,唐树戈.普通化学实验[M].北京:科学出版社,2006.
[7]北京大学化学系普通化学教研室.普通化学实验[M].北京:北京大学出版社,1991:147-150.
[8] 何青云,颜文斌,华 骏,等.硫酸亚铁铵制备的改进[J].实验教学与仪器,2011(2):30-32.
[9] 姜述芹,马 荔,梁竹梅,等.硫酸亚铁铵制备实验的改进探索[J].实验室研究与探索,2005,24(7):18-20.
[10]王 锐.对硫酸亚铁铵制备实验的探讨[J].固原师专学报:自然科学版,2005,22(1):73-75.
[11]陈彦玲,岳淑美,林世威,等.用绿色化学理念改进硫酸亚铁铵制备实验的探究[J].长春师范学院学报:自然科学版,2010,29(4):62-64.
