CT引导肝脏特殊位置恶性肿瘤的局部消融治疗
2013-09-16王增林吴建满赵修一杨厚林陈良生
王增林 吴建满 赵修一 杨厚林 陈良生
CT引导肝脏特殊位置恶性肿瘤的局部消融治疗
王增林 吴建满 赵修一 杨厚林 陈良生
目的 评价在CT引导下经皮肝穿刺局部消融治疗肝脏特殊位置恶性肿瘤的临床应用价值。方法 36例肝脏恶性肿瘤患者, 共有45枚肿瘤, 所有患者肿瘤数目≤3个, 直径≤3 cm, 分别位于心脏大血管旁、近膈面、肝门部、肝包膜下、胆囊旁以及结肠旁等肝内特殊部位。使用方法包括微波、射频及无水酒精消融术, 根据情况选择单一或联合应用治疗方法, 随访12~84个月, 观察并发症和疗效。结果 所有患者45枚肿瘤, 其中8枚进行了微波治疗, 20枚进行了射频治疗, 10枚进行无水酒精局部注射治疗, 7枚进行了射频联合无水酒精局部注射治疗。未出现任何严重并发症。45枚肿瘤均完全坏死。结论 本组研究结果表明, 肝脏特殊位置恶性肿瘤数目≤3个, 直径≤3 cm, 根据情况选择方案进行CT引导局部消融治疗是一种安全、可行、有效的治疗方法。
肝脏恶性肿瘤;局部消融治疗; CT引导
肝脏恶性肿瘤(包括原发性和转移性), 是临床常见疾病,目前治疗有多种手段, 如手术切除、影像引导的原位消融、栓塞化疗、放射治疗、全身化疗、肝脏移植等。临床研究证实,经皮穿刺微波、射频及无水酒精消融术, 可以有效地治疗肝脏恶性肿瘤。该法创伤小、安全性高, 已成为一种治疗肝脏恶性肿瘤的重要手段[1]。但是对于一些位于心脏大血管旁、近膈面、肝门部、肝包膜下、胆囊旁以及结肠旁等肝内的特殊部位的恶性肿瘤, 进行经皮穿刺局部消融治疗具有一定难度和风险。本文报道一组CT引导下经皮肝穿刺局部消融治疗肝脏特殊位置恶性肿瘤患者的临床资料, 评估该方法的临床应用价值。
1 资料与方法
1.1 一般资料 收集本院2005年1月~2011年12月CT引导下经皮穿刺局部消融治疗肝内特殊部位恶性肿瘤36例,其中男24例, 女12例, 年龄35~84岁, 平均63岁。原发性肝癌23例, 转移性肝脏恶性肿瘤13例, 36例总共有45枚肿瘤, 其中位于心脏大血管旁5枚, 近膈面9枚、肝门部5枚、肝包膜下9枚、下腔静脉旁6枚、胆囊旁7枚以及结肠旁4枚。消融前使用TACE治疗者16例。所有患者均经临床或病理(手术或穿刺活检)明确诊断。所有患者肝功能Child评分为A级或B级。
1.2 方法
1.2.1 设备与材料 影像引导设备为德国西门子64排螺旋CT。射频仪采用美国RITA 1500X型多极射频针。微波仪采用南京康友第三代冷循环微波消融治疗系统( KY-2000型)。经皮穿刺注射用无水乙醇为分析醇, 纯度为99.7%。穿刺针为美国Cook 21~22GCHIBA针。
1.2.2 麻醉 采用穿刺点2%利多卡因5 ml局部麻醉联合术中静脉镇静、 镇痛。对于预计手术时间长、肿瘤位于疼痛敏感部位患者采用全身麻醉。
1.2.3 术前CT定位 根据CT或MR影像选择最佳治疗体位及进针路径, 熟悉病灶相对位置, 进针路径须经过部分肝组织, 避开大血管、胆管及重要脏器。
1.2.4 治疗方法与选择 射频消融:根据肿瘤的大小, 选择相应规格的射频针, 以CT定位的穿刺角度和深度, 经皮经肝穿刺。一般分步操作进行:先穿刺至一半进针深度重复CT扫描, 观察射频针与肿瘤及周围组织结构的关系。而后调整穿刺角度, 继续进针将射频针插入瘤体内部近侧, 复查CT, 一般按射频治疗程序射频针由小到大逐步展针, 超出肿瘤周围 0.5~1 cm正常肝组织, 常规退针时针道消融。微波消融:以CT定位的穿刺角度和深度, 经皮经肝穿刺, 微波消融针穿刺到肝肿瘤底部, 开启冷循环微波治疗仪, 实施单点不间断消融, 治疗功率60~70 W, 时间5~10 min, 治疗结束后逐步退出消融针, 并行针道消融。无水乙醇消融:经皮经肝穿刺,以多点缓慢注射, 尽可能的“淹没”病灶为原则。包膜下或膈顶的病灶局部消融治疗多采用射频;靠近心脏大血管、下腔静脉旁、胆囊旁病灶多采用无水乙醇消融;肝门区、结肠旁病灶采用微波或射频联合无水酒精消融。
1.3 随访复查和评价疗效 术后第一个月复查增强CT或增强MRI、肿瘤标志物和肝功能。以后每隔3个月复查彩超,如有可疑复查增强CT或增强MRI。消融灶边缘或内部无增强为“肿瘤完全消融”, 边缘或内部存在增强为“部分消融”或“肿瘤残留”。 首次复查CT 和(或) MRI 示肿瘤完全坏死和(或)AFP正常, 之后消融灶明显增大、存在边缘或内部增强和(或)AFP 下降后再次出现升高, 为“局部复发”[2]。
2 结果
所有患者45枚肿瘤(消融前使用TACE治疗者16例计20枚)。其中8枚进行了微波治疗, 20枚进行了射频治疗, 10枚进行无水酒精局部注射治疗, 7枚进行了射频联合无水酒精局部注射治疗。45枚肿瘤无重复消融, 随访12~84个月,平均随访时间约50个月, 未见局部肿瘤残留或局部复发, 未出现任何严重并发症。5年生存率100%, 肝转移患者无死亡。
3 讨论
本组CT引导下经皮穿刺局部消融治疗肝内特殊位置恶性肿瘤有以下特点:①本组所有病灶CT平扫均能显示。②由于位置特殊, 虽然对患者进行呼吸及屏气训练, 但仍有可能出现偏差, 需逐步进针, 邻近病灶时可以通过患者呼吸运动进行“微调”, 由CT证实到位。③本组部分病例, 由于考虑多发,术前先行DSA造影及碘油栓塞术, 约3~5 d后即行射频消融,碘油栓塞术后定位标记更明显, 这点比超声有优势。(如图1)
射频消融针穿刺入肿瘤后推出电极子针, 需超出肿瘤周围 0.5~1 cm正常肝组织。本组病例病灶直径≤3 cm, 为排除呼吸运动影响, 多采用3 cm或4 cm的重叠消融术以达到肿瘤完全消融目的。肿瘤完全消融一般表现为:射频及微波局部消融术后即时复查CT, 原病灶及其周围区域呈混杂密度改变覆盖原病灶。
无水酒精注射用21~22G CHIBA针, 经皮肝穿刺相对安全, 注射无水酒精理想效果是“淹没”病灶;射频针及微波针一般为14~17G, 心脏、大血管及重要脏器需回避, 射频针可逐步展针的特点容易覆盖包膜下病灶, 微波针需穿透病灶至底部。基于以上局部消融特点, 包膜下或膈顶的病灶局部消融治疗多采用射频;靠近心脏大血管、下腔静脉旁、胆囊旁病灶多采用无水乙醇消融;肝门区、结肠旁病灶相对安全区域采用微波或射频消融, 接近胆管、门静脉及结肠区域联合无水酒精消融。文献报道局部消融治疗并发症多数是与方法选择有关。CT引导下经皮穿刺局部消融治疗肝内特殊位置恶性肿瘤并发症文献报道发生较多。最常见的严重并发症为腹腔内出血、血气胸和肠穿孔。本组患者出现的主要并发症为肝被膜下少量出血, 术后予止血对症处理, 未见严重并发症。对于位于肝被膜下的病灶, 穿刺时避免直接穿刺病灶,需经过部分正常肝组织。如果行单次多位点治疗时, 需变换射频针的方向, 针尖应在肝被膜下调整位置。对于膈顶的病灶, 术前要训练患者呼吸及准确定位、分次进针, 应避免穿刺经过肺组织及反复穿刺。本组未见严重并发症发生的原因是根据具体情况选择单一或联合应用治疗方法, 以安全为前提, 以肿瘤完全消融为目的[3]。本组直径≤3 cm、数目≤3个的肝脏恶性肿瘤CT引导的原位消融与手术切除疗效相当,与国内外文献报道相近。
CT图像密度分辨率高, 可清晰显示进针路径、射频电极针(或微波针)与肿瘤及周围组织的关系, 定位精准, 无盲区;缺点是不能实时引导穿刺进针, 需要操作者有丰富的经验, 此外, 存在穿刺针的金属伪影及患者受到一定剂量的X线辐射。
经皮穿刺无水乙醇消融为微创化学消融治疗, 具有疗效确切、经济方便、重复性好的优点。由于针细(21~22G), 适应于心脏大血管、下腔静脉旁、胆囊旁病灶。对于无水乙醇的注射量存在争议, 在静脉麻醉情况下尽量多注射, 直径≤3 cm的病灶总量不超20 ml, 多点多方向缓慢注射, 尽可能的“淹没”病灶, 但需确保不进入血管、胆管、不漏入腹腔。(如图2)
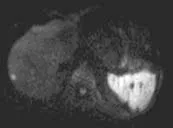
图1

图1a
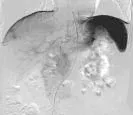
图1b
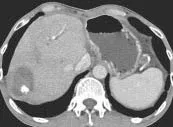
图1c


图2a
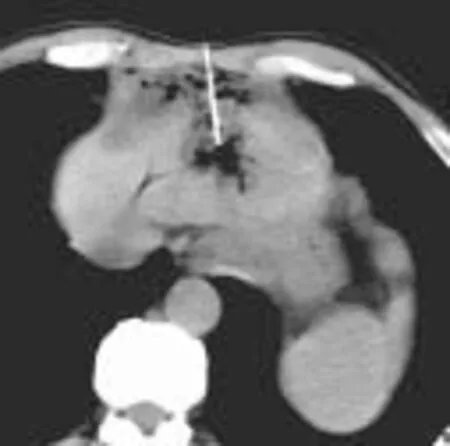
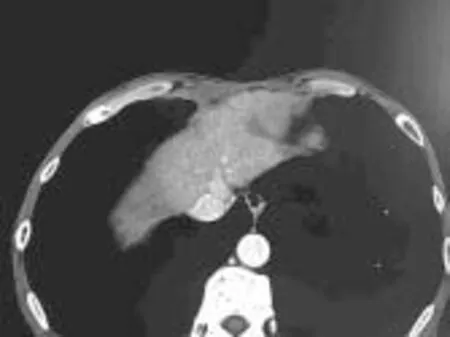
图2b
本研究表明, 对于心脏大血管旁、近膈面、肝门部、肝包膜下、胆囊旁以及结肠旁的肝脏恶性肿瘤, 治疗前周全考虑各种可能出现的损伤, 治疗时根据具体情况选择单一或联合应用局部消融治疗方法, 整个治疗过程在麻醉监护下进行,局部消融治疗是一种安全、可行、有效的治疗方法。
同时, CT引导肝脏特殊位置恶性肿瘤局部消融治疗具有痛苦小、一般无肝功能损害、住院时间短、费用较低等优势。是目前肝脏恶性肿瘤治疗切实可行的手段。
[1] 黄志强.肝癌治疗的历史和现状.中华消化外科杂志, 2010, 9(1): 1-3.
[2] 翟博,李晓燕,刘晟,等.膈顶部原发性肝癌的射频消融.介入放射学杂志, 2009,18(5):359.
[3] 中华医学会放射学分会介入学组.经皮肝脏肿瘤射频消融治疗操作规范专家共识.中华放射学杂志, 2012,46(7):581-585.
CT-guided percutaneous ablations for liver malignant tumors on special sites
Jian-man, ZHAO Xiu-yi, YANG Hou-lin, CHEN Liang-sheng. Department of Radiology, Fujian Provincial WANG Zeng-lin, WU Hospital, Fuzhou 350001,China
Objective To investigate the clinical values of CT-guided percutaneous ablations in patients with liver malignant tumors on special sites.Methods 45 lesions in 36 patients were studied, all patients with less than or equal to 3 lesions, and which were less than or equal to 3cm in diameter, and located on special sites of subcapsular, near heart or the great vessels, near hilar, near gallbladder, near adjacent colon and beneath diaphragm.All lesions were treated by microwaves ablation, radiofrequency ablation, ethanol ablation or combined ablations respectively.Then, patients were followed-up to study the complications and effectiveness arranged from 12 to 84 months.Results 8 lesions were treated by microwave ablation, 20 lesions were treated by radiofrequency ablation,10 lesions were treated by ethanol ablation,7 lesions were treated by radiofrequency combined ethanol ablations.All lesions were necrosis completely, and no sever complications were occurred in followed-up studies.Conclusion CT-guided percutaneous ablations is a feasible, safe, effective adjuvant therapeutic method for patients with liver malignant tumors on special sites.
Liver malignant tumor; Percutaneous ablation; CT-guided
350001 福州, 福建省立医院放射科
