有机酸类化感物质对甜瓜的化感效应
2013-09-15张志忠孙志浩陈文辉林文雄
张志忠,孙志浩,陈文辉,林文雄
(1.福建农林大学园艺学院,福州 350002;2.福州市蔬菜科学研究所,福州 350012;3.福建农林大学农业生态研究所,福州 350002)
甜瓜(Cucumis melo L.)是重要的园艺作物,栽培经济效益明显,目前我国已成为世界上甜瓜栽培面积、产量和消费量最大的国家[1]。近年来,甜瓜生产的基地化和设施化不断发展,轮作和间套作变得越来越难以实施,连作重茬现象日益严重。甜瓜连作后生长发育不良、病虫害加剧、产量降低、品质劣变甚至绝收,这一情况随着连作茬数的增多而不断加重,严重影响其生产效益[2-4]。
自毒作用是导致作物连作障碍的主要原因,植物通过向环境中释放化感物质对周围或后茬植物种子萌发和植株生长发育产生抑制作用的现象即为自毒作用。西瓜、甜瓜和黄瓜等瓜类作物的化感物质是其产生自毒作用的主要原因[5-6],迄今发现的化感物质以有机酸、酚类和萜类化合物最为多见[7]。有机酸尤其是酚酸类是最主要的一类化感物质,如水杨酸、苯甲酸、阿魏酸和苹果酸等最为常见[8-10]。在对西瓜的研究中发现自毒作用的强弱与植株浸提液中酚酸类的浓度呈正相关[10-11],研究并探讨化感物质的作用及其机理是克服瓜类连作障碍的重要途径之一。
目前关于甜瓜的自毒作用研究只局限于对其形态学指标变化的观察[2-4],其深度远不及黄瓜等其他瓜类作物[6,10-12],相较水稻[12]等大田作物的研究而言更是有极大的差距。对化感物质的分离、鉴定及其作用机理的研究是自毒作用研究中的主要内容,由于甜瓜的化感物质分离和鉴定存在一定困难,迄今对于哪些物质在甜瓜自毒作用中起主要作用尚无确切结论。本实验以目前瓜类作物中已鉴定出的常见有机酸类化感物质为研究对象,探讨其对甜瓜的化感效应,为明确其作用机理和生产中克服甜瓜自毒作用提供参考。
1 材料与方法
1.1 植物材料
甜瓜(Cucumis melo L.):品种名称“新银辉”,种子购于福建农嘉种业股份有限公司。
1.2 化感物质溶液的配制
实验中选取的7种有机酸类化感物质分别为苹果酸、柠檬酸、对羟基苯甲酸、肉桂酸、阿魏酸、水杨酸和香豆酸,试剂均为分析纯,购于上海生工生物工程有限公司。各种有机酸先用适当溶剂溶解后,分别用无菌双蒸水稀释配制成 1×10-5、1×10-4、1×10-3、1×10-2mol/L 的浓度梯度备用。
1.3 甜瓜种子发芽、幼苗生长和相关保护酶活性的测定
挑选饱满且大小一致的甜瓜种子,室温下浸种24h后置于无菌培养皿(Φ=9 cm)中,培养皿中事先铺2层无菌滤纸,每皿均匀摆放30粒种子,分别添加不同浓度的各种有机酸类化感物质溶液4 mL。试验选取7种有机酸类化感物质,4个处理浓度梯度,共计28个组合,以无菌双蒸水处理作为对照。将培养皿放置在恒温箱中,25℃培养,每天补加适量无菌双蒸水,保持滤纸湿润,观测和记录种子萌发和幼苗生长情况。每2d更换1次滤纸并添加相应浓度的化感物质溶液;培养2周后测量胚根长、胚轴长、幼苗鲜重和保护酶活性指标。以连续7 d不再有新种子发芽作为试验结束的标记,计算发芽率。种子发芽标准为种子露白长度达到种子长度一半。种子数发芽指数(GI)=∑(Gt/Dt),式中Gt为播种后第t天的发芽数,Dt为相应的发芽日数;保护酶活性测定方法参照文献[14]进行,以植株第2、3片新鲜功能叶为材料。试验重复3次。
1.4 数据统计分析
数据处理采用Excel 2003进行;数据显著性分析利用DPSv 9.50软件进行。
2 结果与分析
2.1 7种有机酸化感物质对甜瓜种子发芽的影响
7种有机酸处理对甜瓜种子发芽率的影响见表1,其中苹果酸和柠檬酸对发芽率基本表现为促进效应,对羟基苯甲酸抑制了发芽率,阿魏酸和香豆酸对发芽率的影响表现为低促高抑,但发芽率峰值出现的浓度不一致;肉桂酸和水杨酸处理没有表现出明显的规律性。在高浓度下(1×10-2mol/L)对发芽率抑制最严重的是肉桂酸,比对照相下降了35%,存在显著差异,其次是水杨酸和阿魏酸;对发芽率促进作用最强的是1×10-3mol/L浓度的香豆酸,比对照增加了7%,差异显著。
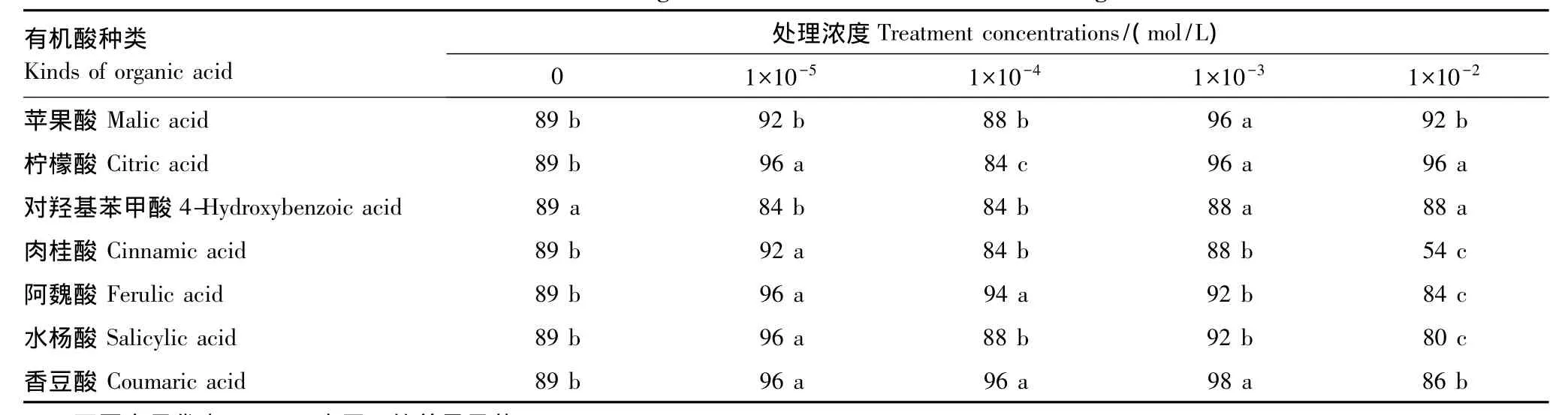
表1 7种有机酸类化感物质对甜瓜种子发芽率的影响/%Table 1 Effects of seven kinds of organic acid allelochemicals on melon seed germination rate/%
由表2可知,苹果酸和柠檬酸对甜瓜种子的发芽指数基本表现为促进作用,仅苹果酸在1×10-4m ol/L浓度时发芽指数低于对照,1×10-5mol/L浓度的柠檬酸对发芽指数的促进作用在所有处理中最强,较对照高出10.32%。肉桂酸和对羟基苯甲酸明显抑制了发芽指数,抑制程度随处理浓度增加而加强,其中肉桂酸的抑制作用最强,在1×10-2mol/L浓度下比对照降低了78.9%,存在显著差异。阿魏酸、水杨酸和香豆酸对发芽指数影响均表现为低促高抑效应,均在1×10-5mol/L浓度时达到峰值,此后逐步下降,且低于对照,阿魏酸在高浓度下的抑制效应仅次于肉桂酸。
2.2 7种有机酸类化感物质对甜瓜幼苗生长的影响
由表3可知,苹果酸、阿魏酸、水杨酸和香豆酸均抑制了甜瓜幼苗鲜重的增加,其中水杨酸和香豆酸随处理浓度提高抑制程度不断加深,在1×10-2mol/L浓度下二者分别比对照降低了66.5%和50.7%,均达到了显著差异水平。柠檬酸、对羟基苯甲酸和肉桂酸对幼苗鲜重表现为低促高抑效应,但鲜重峰值出现时的浓度略有差异,其中柠檬酸在浓度为1×10-4mol/L时对幼苗鲜重的促进效应是实验中所有处理中最强的,较对照高出21.42%,肉桂酸在浓度为1×10-2mol/L时抑制效应最强,较对照下降了72.2%。实验中7种有机酸处理只有苹果酸可以促进甜瓜幼苗胚根生长,随处理浓度的增加其促进效应不断增强,在1×10-2mol/L浓度时促进效应是实验所有处理中最强的,比对照高出45.10%。1×10-2mol/L浓度的阿魏酸在所有处理中抑制作用最强,比对照相下降了96.9%;对羟基苯甲酸、肉桂酸、水杨酸和香豆酸基本上随处理浓度的增加抑制程度不断加强。
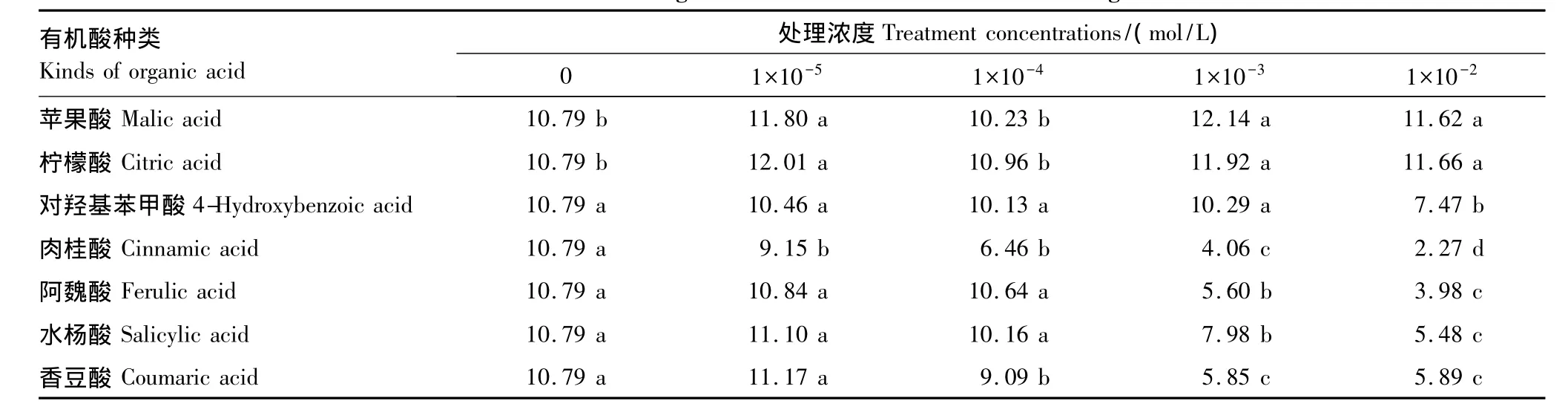
表2 7种有机酸类化感物质对甜瓜种子发芽指数的影响Table 2 Effects of seven kinds of organic acid allelochemicals on melon seed germination index
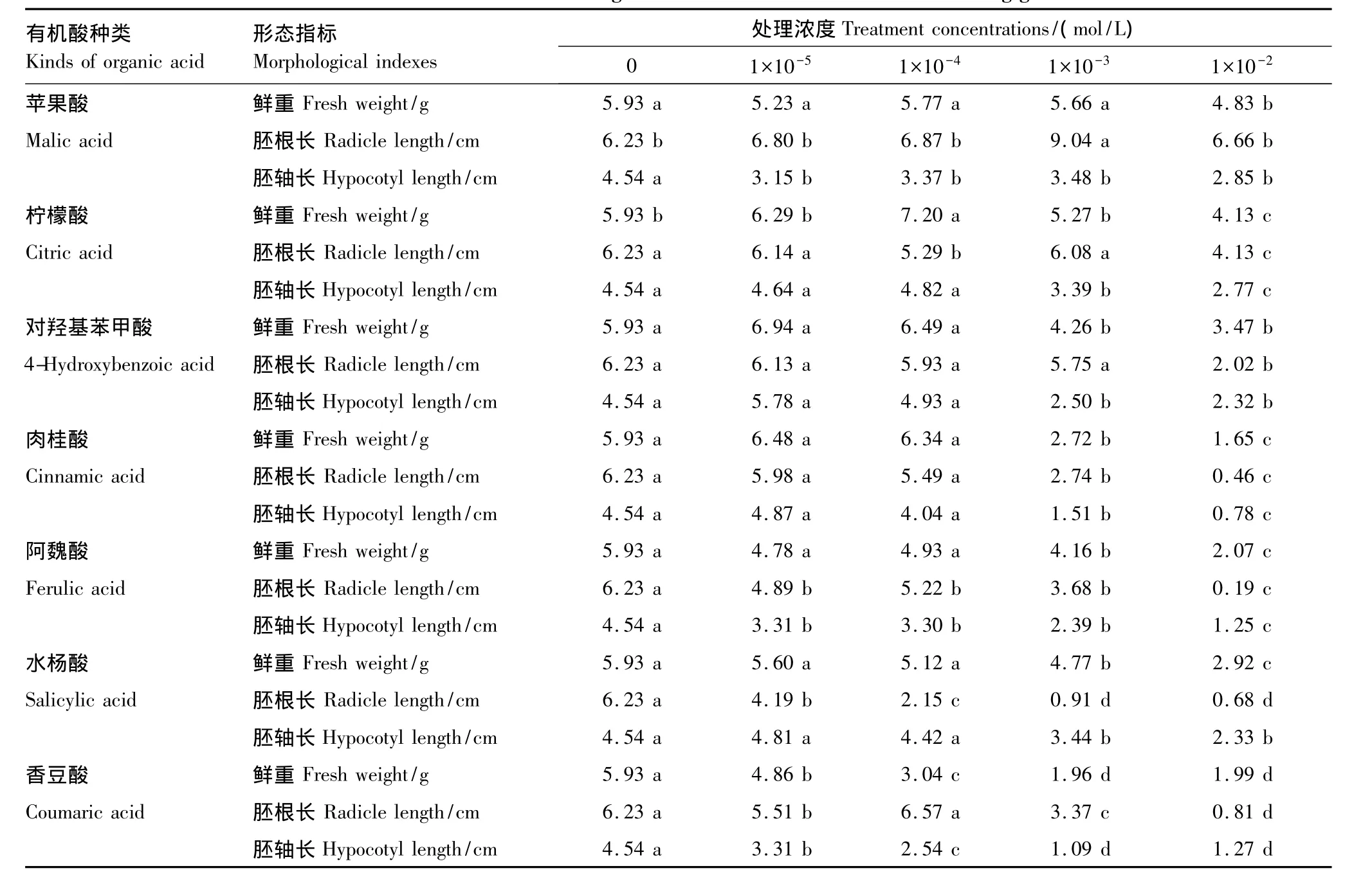
表3 7种有机酸类化感物质对甜瓜幼苗生长情况的影响Table3 Effects of seven kinds of organic acid allelochemicals on melon seedling growth
7种有机酸高浓度处理情况下甜瓜幼苗胚轴的生长几乎均被抑制了(表3),其中苹果酸所有处理浓度均可抑制胚轴生长,柠檬酸、对羟基苯甲酸、肉桂酸和水杨酸处理对胚轴的生长表现出明显的低促高抑效应,1×10-5mol/L的对羟基苯甲酸处理促进效应最强,比对照高出27.31%。阿魏酸和香豆酸处理的抑制作用基本上随处理浓度的升高而不断增强。1×10-2mol/L浓度的肉桂酸抑制作用在7种有机酸中最强,比对照下降了82.8%,存在显著差异。
2.3 7种有机酸类化感物质对甜瓜幼苗保护酶活性的影响
7种有机酸处理对甜瓜幼苗体内保护酶活性的影响见表4。苹果酸和肉桂酸处理后超氧化物歧化酶(SOD)活性均低于对照,但其变化趋势没有明显规律性;对羟基苯甲酸和水杨酸处理后SOD活性大致随处理浓度增加而逐步下降,但在低浓度下抑制作用不明显,只有浓度达到或超过1×10-3mol/L时才表现出显著性抑制。柠檬酸、阿魏酸和香豆酸对SOD活性基本表现为低促高抑效应,高浓度阿魏酸对SOD活性的抑制作用是实验中最强的,在1×10-2mol/L浓度时SOD活性无法检出。有机酸处理后过氧化物酶(POD)的活性变化较为复杂。苹果酸和水杨酸随处理浓度升高呈现出升-降-升趋势;柠檬酸、肉桂酸和阿魏酸表现出先降后升趋势;对羟基苯甲酸则为降-升-降趋势,且各处理间POD活性波动幅度极大;香豆酸对POD活性的影响不明显。7种有机酸在高浓度处理条件下均显著增强了甜瓜幼苗体内过氧化氢酶(CAT)活性,但CAT活性出现峰值时的处理浓度不一致,苹果酸、肉桂酸和香豆酸为1×10-3mol/L,柠檬酸、对羟基苯甲酸、阿魏酸和水杨酸为1×10-2mol/L时。除苹果酸外其余6种有机酸在低浓度条件下CAT活性增幅不大,当处理浓度达到或超过1×10-3mol/L时CAT活性开始大幅上升,其中肉桂酸的增幅最大,为对照的273.69%。
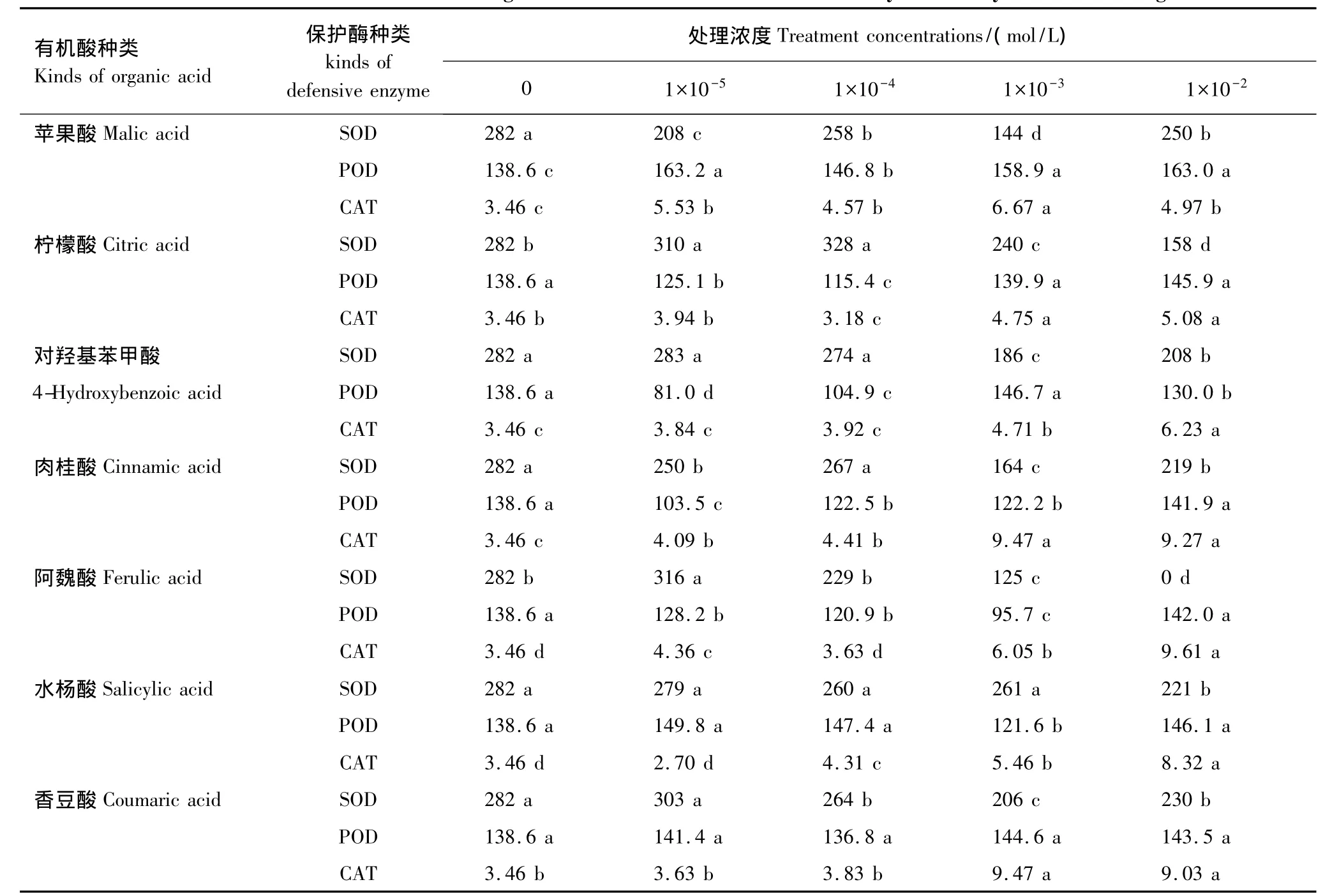
表4 7种有机酸类化感物质对甜瓜幼苗保护酶活性的影响Table 4 Effects of seven kinds of organic acid allelochemicals on defensive enzymes activity of melon seedlings
2.3 7种有机酸类化感物质对甜瓜幼苗丙二醛含量的影响
7种有机酸处理后甜瓜幼苗体内丙二醛(MDA)含量变化较为复杂(表5)。苹果酸处理甜瓜幼苗体内MDA含量均低于对照。柠檬酸和阿魏酸处理除最高浓度外MDA含量均显著性低于对照。对羟基苯甲酸和水杨酸处理均在1×10-5mol/L时出现了一个略高于对照的峰值,其他浓度均显著性低于对照。肉桂酸和香豆酸处理后所有浓度均低于对照。总体而言7种有机酸中只有5个处理组合的MDA含量高于对照,仅占所有处理组合的17.85%。
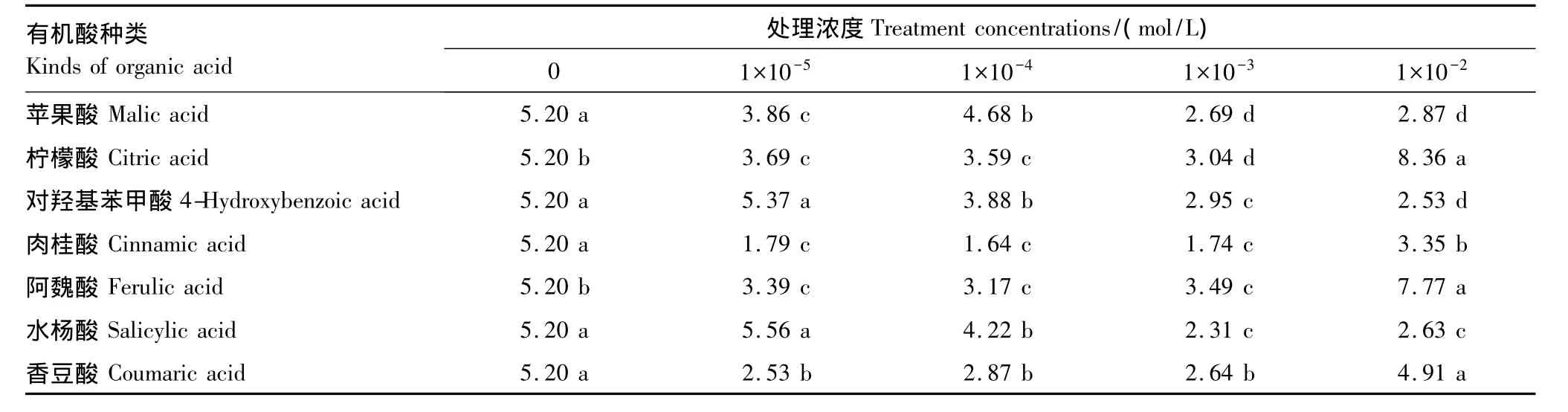
表5 7种有机酸类化感物质对甜瓜幼苗MDA含量的影响/(μmol/g鲜重)Table 5 Effects of seven kinds of organic acid allelochemicals on MDA content of melon seedlings/(μmol/g FW)
3 讨论
3.1 有机酸类化感物质对甜瓜种子发芽的影响
试验中7种有机酸类化感物质均能影响甜瓜种子发芽和幼苗生长情况,这种影响与化感物质类型和处理浓度密切相关。低浓度下有机酸类化感物质可表现出抑制或促进作用,但高浓度下则几乎均表现为抑制作用,只是抑制程度不同,这和前人的研究结果类似[15-17]。种子萌发过程中的各种参数是衡量化感效应的最常用指标[18],植株生物量和形态学指标也被广泛采用[19]。种子发芽被抑制可以分为种子不发芽和种子延迟发芽两种情况,采用种子发芽率来衡量不同物质的化感效应显然无法很好的反应后一种抑制情况,田间栽培情况下发芽迟缓的种子在竞争中无疑处于劣势地位,即使最终能够发芽也往往生长羸弱,难以形成壮苗。实验中甜瓜种子发芽率受到的影响较小,而发芽指数的变化更为敏感,采用种子发芽指数指标可以更好的反应不同有机酸物质的化感效应。
3.2 有机酸类化感物质对甜瓜幼苗生长的影响
同一化感物质处理甜瓜幼苗后鲜重和胚轴长变化趋势类似,幼苗胚轴部分在鲜重中所占比例较大可能是其原因之一。高浓度处理下胚根长指标的变化幅度更大,说明有机酸类化感物质对胚根的影响更显著,这与其他研究者利用不同植物获得的结果类似[15,17,19]。在植株生长期间,化感物质要发挥作用首先要被植株吸收,根系是首先被影响到的植物器官,其受到的影响也会较其他部分更加显著。抑制胚轴过快生长的同时促进胚根生长无疑会进一步增加植株的根冠比,这对于甜瓜培育壮苗,抑制徒长是极为有利的,实验中苹果酸对甜瓜种子发芽率和发芽指数的持续促进作用可能与此有关。同样,在低浓度处理条件下肉桂酸、阿魏酸和香豆酸的这一比值也基本高于对照,当处理浓度进一步上升时,胚根生长被严重抑制,这一比值大幅下降,这一规律和三者对发芽率和发芽指数的低促高抑效应相吻合。上述这些化感物质,采用合适的浓度添加到育苗基质中,对于培育甜瓜壮苗进而提高幼苗对不良环境的抵抗能力是否有益是值得进一步探讨的问题。
由发芽指标和幼苗生长的相关形态指标可以看出,有机酸类化感物质对甜瓜的化感效应基本符合低促高抑规律,按照其变化规律的相似程度可分为3组。肉桂酸、阿魏酸和香豆酸均属于苯烯酸衍生物,化学结构的类似性可能是三者处理后对甜瓜种子发芽率和发芽指数均表现为低促高抑效应的原因。苹果酸和柠檬酸均是植物三羧酸循环的重要物质,三羧酸循环是植物糖类、脂类和氨基酸代谢联系的枢纽和最终代谢通路,也是产生能量的重要途径。种子由休眠状态进入此后的萌发过程和幼苗生长过程期间各种代谢由开始的几乎停滞到不断活跃[20],苹果酸和柠檬酸可能促进并广泛参与了这一过程,导致甜瓜种子发芽率和发芽指数上升。水杨酸处理对发芽率和发芽指数也表现低促高抑效应,对羟基苯甲酸处理则表现为抑制,二者化学结构类似,但表现略有差异,其原因值得进一步深入研究。
3.3 有机酸类化感物质对甜瓜植株保护酶系统和MDA含量的影响
植株受到外来胁迫时通常会调动保护酶活性,增强其清除氧自由基的能力,保持细胞膜的稳定性,抵抗外界胁迫的不良影响。甜瓜幼苗体内SOD活性在7种有机酸类化感物质处理后整体呈下降趋势,这可能说明有机酸类化感物质会通过抑制其酶活性进而加重氧自由基对植物的危害。在对西瓜的研究中也有类似的结论,肉桂酸处理后的西瓜体内SOD活性也表现为下降趋势[21]。POD通常在老化组织中活性较高,是组织老化的一个重要生理指标,实验中随着胁迫浓度的增加植株生长受到的抑制作用越来越明显,组织老化程度不断加深,POD活性大多表现为持续升高。CAT活性在7种有机酸类化感物质处理后全部升高,且活性峰值大多出现在高浓度处理下条件,增加幅度均达到显著水平,这种大幅上升可能说明实验中选取的有机酸类化感物质对甜瓜的化感效应和其体内的过氧化氢水平相关程度较高。有机酸类化感物质对植物保护酶活性的影响较为复杂,不同研究结果间差异较大,如研究表明香草酸和对羟基苯甲酸处理可以使新疆甜瓜体内SOD、POD和CAT活性均上升[22];高浓度肉桂酸处理使西瓜体内SOD活性降低,POD活性升高[21];抗坏血酸处理后蚕豆的POD活性下降了[23]。这意味着对于不同植物种类即使是相同的化感物质在同样处理浓度条件下也会产生差异极大的影响,对其活性氧代谢系统各相关指标进行综合分析才有可能得出合理的结论。
MDA含量高低常用来衡量膜系统的伤害程度,实验中7种有机酸处理后甜瓜体内MDA含量大多低于对照,上述保护酶活性的变化可能是其原因之一。化感物质处理后保护酶活性的升高使得植株体内活性氧的清除能力增加,膜脂过氧化程度整体呈下降趋势。在不同的研究中化感物质对植株体内MDA含量变化产生的影响差异较大,这一方面可能是由于研究者采用的植物材料不同所致,另一方面MDA只是膜脂过氧化产物之一,单一根据其含量变化来衡量化感效应的强弱不够全面。化感物质可以通过对植物各种生理生化代谢过程的全方位影响而发挥作用,对于保护酶系统的影响只是其中的一部分,还可以通过影响水分代谢、矿质元素的吸收和光合作用等其他方面最终对植物的生长发育产生影响,同样植物也可以通过除保护酶系统外的其他途径缓解化感抑制作用,这是一个错综复杂的调控体系,单一通过研究保护酶系统的变化尚不足以解释这一复杂的情况,需要对化感物质处理后植物的各种代谢途径变化做深入研究才可能进一步明确其作用机理。
4 结论
苹果酸、柠檬酸、对羟基苯甲酸、肉桂酸、阿魏酸、水杨酸和香豆酸等7种有机酸类化感物质均能影响甜瓜种子发芽和幼苗的生长。低浓度的不同种类有机酸化感物质产生的作用不同,但高浓度下则几乎均表现为抑制效应。肉桂酸的抑制效应最强,可能是甜瓜的主要化感物质。有机酸化感物质处理后通过种子发芽率受到的影响较小,发芽指数变化更为敏感,采用发芽指数可以更好的衡量不同物质的化感效应。不同有机酸处理后甜瓜幼苗体内SOD和POD活性的变化规律不明显,CAT活性均随处理浓度增加而增强,有机酸类物质对甜瓜的化感效应可能和其体内的过氧化氢水平有较高的相关性。
[1] Bie Z L.Situation and development strategy of grafted nursery industry of watermelon and muskmelon in China.China Cucurbits And Vegetables,2011,24(2):68-71.
[2] Wen L.Continuous cropping obstacle and control measures in melon protected cultivation.Northern Horticulture,2007,(7):122.
[3] Zhuang J H,Yang CC,Gao ZG,Tang S,Zheng Y N,Wei H L.Simulation of allelopathy of melon under continuous cropping.Plant Protection,2008,34(5):137-139.
[4] Cheng Y,Bai SF,Zhuang J H,Gao Z G,Liu Z H.Promotive effects of muskmelon survival on Fusarium Wilt.Chinese Agricultural Science Bulletin,2011,27(8):217-221.
[5] Yu JQ;Du Y S.Soil-sickness Problem in the sustainable development for the protected production of vegetables.Journal of Shenyang Agricultural University,2000,31(1):124-126.
[6] Hao,Z P,Wang,Q,Christie,P,Li X L.Allelopathic potential of watermelon tissues and root exudates.Scientia Horticulturae,2007,112(3):315-320.
[7] Rice E L.Allelopathy(Second Edition).Orlando:Academic Press Inc,1984:5-7
[8] Uddin M R,Li X,Won O J,Park SU,Pyon J Y.Herbicidal activity of phenolic compounds from hairy root cultures of Fagopyrum tataricum.Weed Research,2012,52(1):25-33.
[9] Bezuidenhout SR,Reinhardt CF,Whitwell M I.Cover crops of oats,stooling rye and three annual ryegrass cultivars influence maize and Cyperus esculentus growth.Weed Research,2012,52(2):153-160.
[10] Chen SL,Zhou B L,Lin SS,Li X Y,Xue L.Accumulation of cinnamic acid and vanillin in eggplant root exudates and the relationship with continuous cropping obstacle.African Journal of Biotechnology,2011,10(14):2659-2665.
[11] Yu JQ,Shou SY,Qian Y R,Zhu Z J,Hu W H.Autotoxic potential of cucurbit crops.Plant and Soil,2000,223(1/2):147-151.
[12] Wang Q.The autotoxicity and mechanism of phenolic acids effects in watermelon(Citrullus lanatus Thunb.)monoculture problem.Beijing:China Agriculture University,2002.
[13] Lin W X,He H B,Xiong J,Shen L H,Wu M H,Lin R Y,He H Q.Advances in the investigation of rice allelopathy and its molecular ecology.Acta Ecologica Sinica,2006,26(8):2687-2694.
[14] Li H S.Principles and techniques of plant physiological biochemical experiment.BeiJing:Higher Education Press,2000:142-187.
[15] Ghareib H R,Abdelhamed M S,Ibrahim O H.Antioxidative effects of the acetone fraction and vanillic acid from chenopodium murale on tomato plants.Weed Biology and Management,2010,10(1):64-72.
[16] Chen SL,Zhou B L,Lin SS.Accumulation of cinnamic acid and vanillin in eggplant root exudates and the relationship with continuous cropping obstacle.African Journal of Biotechnology,2011,10(14):2659-2665.
[17] Ahrabi F,Enteshari S,Moradshahi A.Allelopathic potential of para-hydroxybenzoic acid and coumarin on canola:Talaieh cultivar.Journal of Medicinal Plants Research,2011,5(20):5104-5109.
[18] Philippe S,Craig CS,Michael A S,Michael P R,Gyles W R,Paul R P,Tom R H,Steve R Q,Doug R S.Alfalfa Autotoxicity:effects of reseeding delay,original stand age,and cultivar.Agronomy Journal,2002,94(4):775-781.
[19] Hesammi E.Effect of allelopathic weeds on characteristics seed growth in maize(Zea mays L).Advances in environmental biology,2012,6(1):297-301.
[20] Shahldul I.Physiological and biochemical variations in seed germination of cowpea(Vigna unguiculata L.Walp)cultivars.American Journal of Plant Physiology,2010,5(1):22-30.
[21] Sun H J,Wang Q.Effect of benzoic acid and cinnamic acid on watermelon seeding root cell protective enzymes and membrane permeability.Acta Agriculturae Boreali-occidentalis Sinica,2007,16(6):142-145.
[22] Xu SL,Chen Q Y,Chen X Q,Li SH,Gao JS.Effects of phenolic acids on growth and activities of membrance protective enzymes of muskmelon grafted on black-seed pumpkin.Journal of Fruit Science,2004,21(5):451-455.
[23] Niakan M,Mazandrani N.Allelopathic effects of ascorbic acid and canola on germination and antioxidant enzyme activity in soybean seedlings.Allelopathy Journal,2009,24(2):283-290.
参考文献:
[1] 别之龙.我国西瓜甜瓜嫁接育苗产业发展现状和对策.中国瓜菜,2011,24(2):68-71.
[2] 温玲.甜瓜设施栽培土壤连作障碍及防治措施.北方园艺,2007(7):122.
[3] 庄敬华,杨长成,高增贵,唐树戈,郑雅楠,魏汉莲.连作对甜瓜化感作用的模拟试验.植物保护,2008,34(5):137-139.
[4] 程莹,白寿发,庄敬华,高增贵,刘志恒.甜瓜残茬腐解物对镰孢枯萎病的助长作用.中国农学通报,2011,27(8):217-221.
[5] 喻景权,杜尧舜.蔬菜设施栽培可持续发展中的连作障碍问题.沈阳农业大学学报,2000,31(1):124-126.
[12] 王倩.西瓜连作障碍中的自毒作用及酚酸类物质作用机理的研究.北京:中国农业大学,2002.
[13] 林文雄,何海斌,熊君,沈荔花,吴敏鸿,林瑞余,何华勤,梁义元,李兆伟,陈婷.水稻化感作用及其分子生态学研究进展.生态学报,2006,26(8):2687-2694.
[14] 李合生.植物生理生化实验原理和技术.北京:高等教育出版社,2000:142-187.
[21] 孙会军,王倩.苯甲酸、肉桂酸对西瓜根细胞保护酶及膜透性的影响.西北农业学报,2007,16(6):142-145.
[22] 徐胜利,陈青云,陈小青,李绍华,高疆生.酚酸类物质对嫁接伽师瓜植株生长及保护酶活性的影响.果树学报,2004,21(5):451-455.
