风药、补虚药对脑缺血大鼠淀粉样β蛋白及其蛋白前体表达的影响
2013-09-15王海征张秋霞王雅丽杨亦龙
王海征 张秋霞 赵 晖 张 弛 张 楠 王雅丽 杨亦龙
(1首都医科大学中医药学院,北京,100069;2北京中医药大学期刊中心,北京,100029)
医圣张仲景在《内经》的基础上,提出了中风的病名,认为中风的病机是“内虚邪中”。侯氏黑散是张仲景针对中风“正虚邪中”病机关键而创立的治疗中风“第一方”[1]。方中以风药(菊花、防风、桂枝、川芎、细辛、桔梗)祛风、搜风、熄风,配伍补虚药(白术、人参、茯苓、当归)益气健脾、补益肝血,充分体现了风药佐助补虚药治疗脑中风的用药特色。《经方发挥》认为“《金匮要略》之侯氏黑散……列为治中风之首方,绝非偶然,而是有其深刻意义。”前期研究表明[1-6],侯氏黑散可通过调节神经营养因子、控制星形胶质细胞的适度活化,减少炎性反应因子的释放,对脑缺血大鼠神经血管单元有很好的保护作用。为进一步阐释侯氏黑散组方之精妙,本文利用免疫组化方法观察淀粉样前体蛋白(amyloid precursor protein,APP)、β-淀粉样蛋白(β-amyloid protein,Aβ)在缺血大鼠脑组织的表达变化,探讨侯氏黑散方中风药、补虚药及风药补虚药联用对脑缺血大鼠轴突转运及淀粉样沉淀的影响。
1 实验材料
1.1 实验动物 雄性Sprague-Dawley大鼠,清洁级,体重280~300 g,由北京维通利华实验动物技术有限公司提供(许可证号为SCXK(京)2012-0001)。饲养于首都医科大学实验动物中心(许可证号为SYXK(JING)2010-0020)。将动物分为假手术组、模型组、风药组、补虚药组、风药补虚药联用组(简称联用药组)。
1.2 受试药物 侯氏黑散方中主要药物分为风药组、补虚药组。风药由菊花40 g、防风10 g、桂枝3 g、川芎3 g、细辛3 g、桔梗8 g组成;补虚药由人参3 g、白术10 g、茯苓3 g、干姜3 g、当归3 g组成。(药物剂量依据《金匮要略》侯氏黑散原方的剂量比例确定)。风药补虚药联用组由菊花40 g、防风10 g、桂枝3 g、川芎3 g、细辛3 g、桔梗8 g、生白术10 g、茯苓3 g、干姜3 g、当归3 g、人参3 g组成。中药购自北京同仁堂药店。
1.3 试剂 APP:#1565-1,EPITOMICS;Aβ42:ab10148,Abcam;山羊抗兔IgG -HRP:ANR02-1,欣博盛生物;苏木素:CW0127,北京康为世纪生物科技有限公司;DAB,ZLI-9018,中杉金桥;3%H2O2,中杉金桥;兔超敏二步法检测试剂盒:PV-9001,中杉金桥。
1.4 主要仪器 DENVER INSTRUMENT电子天平:北京赛多利萁仪器系统有限公司;微波炉(PTOD20TL-D4):格兰仕微波炉电器有限公司;电热鼓风干燥箱:天津市泰斯特仪器有限公司;MENLAB-U/4C501H生物信号采集处理系统:南京美易科技有限公司;光学显微镜Nikon Eclipse 80i:日本;涡旋振荡器(VG3S25):IKA公司;台式离心机(94-108):Sigma公司;AR1140电子天平:美国Adrenturer公司;NIS-Elements Basic Research图像采集分析系统,日本;centrifuge 5810R离心机:美国Eppendorf公司。
2 实验方法
2.1 脑缺血大鼠模型制备 参照文献[7]制备大脑中动脉永久性缺血模型。雄性Sprague-Dawley大鼠,麻醉后,仰卧固定,结扎颈总动脉近心端和颈外动脉。将预先处理成圆头的尼龙线(直径0.265 mm)置于颈内动脉18 mm,阻断大脑中动脉的血液供应,扎紧动脉残端,缝合皮肤。假手术组大鼠麻醉后,仅暴露颈内外动脉分支,不闭塞大脑中动脉。参考Zea Longa[8]法于缺血24 h、48 h进行神经功能缺损评分。通过神经功能评分判断脑缺血模型的成功与否,2~3分为入选动物。
2.2 分组及给药 60只SD雄性大鼠,用随机数字表方法将实验动物随机分为5组,即假手术组、模型组、风药组、补虚药组,联用药组,每组12只动物。给药剂量按体表面积折算,风药组等效剂量为7.7 g/kg;补虚药组等效剂量为2.59 g/kg;联用药组等效剂量为10.5 g/kg。各给药组先灌胃给药3 d,第4 d给药后20 min施行手术,术后24 h及48 h各组每6 h给药1次。模型组灌胃等容量生理盐水。
2.3 取材及标本处理 大鼠造模后分别于缺血24 h、48 h取材。每组随机取5只大鼠,麻醉后,生理盐水快速灌流至清澈。继以4%多聚甲醛0.1 mol/L磷酸缓冲液(pH7.4)心内灌注固定,待充分固定后,开颅取脑。冠状位取视交叉向尾端3~4 mm组织块,投入相同固定液于4℃固定1周后,常规石蜡包埋,切片,进行免疫组化染色。
2.4 APP、Aβ42检测 采用二步法免疫组织化学染色法进行染色。APP、Aβ42免疫组织化学染色暴露抗原方法:用0.01 mol/L的柠檬酸缓冲液进行微波修复,PBS冲洗。然后每片滴加一抗50 μL(APP抗体稀释浓度1∶100;Aβ42抗体稀释浓度1∶50),4℃孵育40 h,37℃孵育1 h,PBS冲洗。接着每片滴加二抗Ⅰ50 μL,37℃孵育0.5 h,PBS冲洗,每片滴加二抗Ⅱ50 μL,37℃孵育1 h,PBS冲洗。最后DAB显色25 min,蒸馏水洗涤终止,苏木素染细胞核5 min,显色后脱水、透明、封片。
表1 风药、补虚药对脑缺血大鼠皮层APP表达的影响(IOD:s,n=5)

表1 风药、补虚药对脑缺血大鼠皮层APP表达的影响(IOD:s,n=5)
注:与模型组比较,*P <0.05,**P<0.01。
假手术组 7633.21±4908.46** 8962.43±6059.67**模型组 16067.40±11588.74 25097.16±13264.01风药组 12843.80±5874.36 16542.14±5403.21*补虚药组 10634.40±3613.26* 20982.00±6772.84联用药组 6528.33±2705.76**24905.17±15243.36
表2 风药、补虚药对脑缺血大鼠皮层Aβ42表达的影响(IOD:s,n=5)

表2 风药、补虚药对脑缺血大鼠皮层Aβ42表达的影响(IOD:s,n=5)
注:与模型组比较,*P <0.05,**P<0.01。
24 h 48 h假手术组 855.00±761.71** 794.50±511.03组别**模型组 13547.69±7183.60 17395.77±9104.63风药组 12829.25±5865.49 12245.82±5873.84补虚药组 11248.00±7170.08 17295.00±12773.28联用药组 12743.56±9080.78 9743.00±4618.24**
2.5 图像分析 在Olympus光学显微镜下观察免疫组化染色切片,在各组动物右侧(缺血侧)颞叶皮层选取5个视野,LEICA数字显微照相机采集图像,利用NIS-Elements Basic Research图像采集分析系统分析每个视野下APP及 Aβ42阳性表达的积分光密度(IOD,integrated optical density)以反映APP及Aβ42免疫染色强度。
3 结果
APP表达主要位于神经元核周体及周围的轴突部位。缺血24 h后,缺血侧脑组织APP免疫反应明显增强,棕黄色颗粒增多,染色加深,免疫阳性细胞呈丛状聚集。图像分析结果显示,缺血24 h、48 h大鼠颞叶皮层APP表达明显高于假手术组(P<0.01);与模型组相比,补虚药、联用药可明显下调缺血24 h大鼠颞叶皮层APP的表达(P<0.01或P<0.05);缺血48 h,风药组大鼠颞叶皮层APP表达也明显低于模型组(P<0.05)。见表1,图1。
Aβ42阳性表达物为棕褐色颗粒,分布于神经元细胞质中,并可见细胞核皱缩。随着缺血时间延长,Aβ42阳性表达增强。图像分析结果显示,缺血24 h、48 h大鼠颞叶皮层Aβ42表达较假手术组增强(P<0.01);风药补虚药联用可明显下调缺血48 h大鼠颞叶皮层Aβ42表达,差异较模型组显著(P<0.01)。见表 2,图 2。
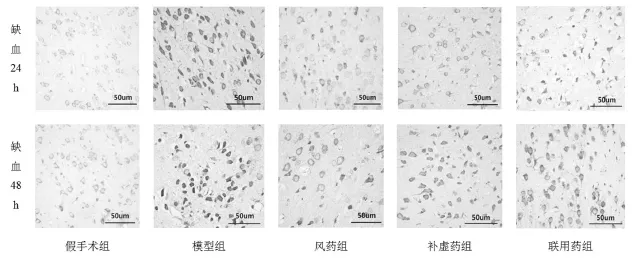
图1 脑缺血后大鼠皮层APP表达的变化(bar=50 μm)
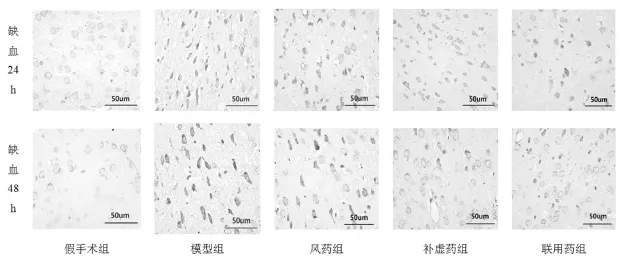
图2 脑缺血后大鼠皮层Aβ42表达的变化(bar=50 μm)
4 讨论
淀粉样前体蛋白(amyloid precursor protein,APP)为具有受体样结构的跨膜糖蛋白[9],通过轴浆快速顺行运输,具有维护突触膜稳定,促进细胞黏附、增殖和分化,抑制丝氨酸蛋白酶活性等作用[10]。近期研究表明,淀粉样前体蛋白也参与脑缺血损伤过程[11-13],并且是脑缺血的敏感指标之一[14]。在本实验中我们发现,局灶性脑缺血24 h后,缺血侧脑组织APP生成增多,APP代谢产物Aβ42表达明显增高,随着缺血时间延长,APP、Aβ42表达均成上升趋势。轴突纤维易受到缺氧或缺血性损伤[15],相关研究表明,局灶性脑缺血2 h后,就可见细胞骨架破坏,有髓纤维快速轴突运输发生障碍[16]。APP作为轴突损伤后的一种快速反应性蛋白在轴突微管结构破坏,细胞骨架崩溃后,出现异常聚集[17],APP的代谢方式有淀粉样降解途径(amyloidogenic pathway)和非淀粉样降解途径(nonamyloidogenic pathway)。生理状态下,APP主要经非淀粉样降解途径代谢,而病理状态下,APP则以淀粉样降解途径代谢,产生过量的Aβ42与Aβ40,造成Aβ的积聚[18]。目前研究表明APP的过度表达可直接引起神经损害,促神经细胞凋亡[19]。但APP的神经毒性主要是由APP异常裂解产生的Aβ所引起。Aβ42与Aβ40相比,延长的两个氨基不仅增加了Aβ的疏水性,而且使其更容易聚集,具有较强的神经毒性[20],可触及多种毒性机制:如通过突触体脂质过氧化物作用,引起自由基生成和氧化应激,损伤神经元;并通过扰乱细胞内环境的稳定,诱导细胞凋亡[21-22];还可直接激活补体系统,通过补体经典途径和膜攻击复合物介导产生神经毒性[23-24]。因而调节 APP表达,抑制 Aβ42异常聚集,可减轻神经元损伤并减缓神经元退行性变进程。
现代《中药学》以功效分类,将大部分风药归入解表药中,突出了它们发散表邪、解除表证的作用,却淡化了其他一些重要功能,在一定程度上束缚了风药的应用范围。侯氏黑散是仲景治疗缺血性脑中风的主方,方中集合诸药祛风、搜风、熄风:菊花用至四十分,祛风平肝;防风用至十分,助菊花祛风;川芎亦治风,本经谓治“中风入脑头痛”;细辛善治暗风卒倒(《世医得效方》);桂枝祛风更为仲景所推崇。配以白术、人参、茯苓益气健脾,当归补肝血、润肝燥。全方体现了风药佐助补虚药“补不足,损有余”的立法思想。本研究利用经典的脑缺血大鼠模型,探讨侯氏黑散方中风药、补虚药对淀粉样β蛋白及其蛋白前体表达的单独效应及联合作用。结果表明,风药、补虚药单独应用虽可不同程度降低APP表达,但对Aβ42的异常积聚没有明显的阻抑作用,补虚药与风药联用可明显下调APP表达,抑制Aβ4的异常积聚,降低Aβ42的毒性,从而发挥神经元的保护作用。仲景作为中医学理、法、方、药的奠基人,治疗脑中风善用“风药”,所立经方中“风药”妙用者举不胜举。长期的医疗实践证明,风药非独祛风,在调节人体脏腑经络、畅达气血津液等方面有着重要的意义,应用范围相当广泛,尤其在多种配伍中具有独特增效作用[25-26]。因此深入探讨风药佐助补虚药抗脑血损伤的作用机制,不仅有助于阐释仲景“内虚邪中”脑中风病机理论,还可指导风药在脑卒中临床治疗的合理配伍应用,拓宽中医治疗脑中风的思路。
[1]张秋霞,赵晖.侯氏黑散对大鼠大脑中动脉闭塞模型缺血脑组织Na+-K+-ATP酶及一氧化氮合酶活性的影响[J].中国实验方剂学杂志,2008,14(7):31 -33.
[2]赵晖,张秋霞,穆阳.侯氏黑散对缺血性中风大鼠NGF表达的影响[J].中国实验方剂学杂志,2006,12(11):43 -46.
[3]赵晖,张秋霞,穆阳.侯氏黑散对脑缺血大鼠血液流变学及自由基代谢的影响[J].中国实验方剂学杂志,2006,12(12):38 -40.
[4]张秋霞,赵晖.侯氏黑散对MCAO大鼠大脑皮质TGF-β1、bFGF蛋白表达的影响[J].辽宁中医,2007,34(2):238 -240.
[5]穆阳,赵晖,张秋霞.侯氏黑散及拆方对MCAO大鼠神经病理学的影响[J].山东中医药大学学报,2009,33(1):60 -62,65.
[6]Qiuxia Zhang,Hui Zhao,Lei Wang,et al.Effects of wind - dispelling drugs and deficiency-nourishing drugs of houshiheisan compound prescription on astrocyte activation and inflammatory factor expression in the corpus striatum of cerebral ischemia rats[J].Neural Regeneration Research,2012,7(24):1851 -1857.
[7]田金洲.血管性痴呆[M].北京:人民卫生出版社,2003:598-607.
[8]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84 -91.
[9]邢兆宏,张秋霞,赵辉,等.补阳还五汤与六味地黄丸合方对脑缺血大鼠APP蛋白及突触重构的影响[J].中国实验方剂学杂志,2012,18(20):161-165.
[10]王嘉鹏,崔理立,张应玖.淀粉样前体蛋白(APP)相互作用及其生物学意义[J].生命科学,2009,21(2):253 -258.
[11]欧阳欣,于挺敏.瑞香对大鼠前脑缺血后β-APP表达的影响[J].中华脑血管病杂志,2012,6(6):309 -312.
[12]Koike MA,Lin AJ,Pham J,Nguyen E,et al.APP konckout mice experence acute mortality as the result of ischemia[J].PLos One,2012,7(8):1-8.
[13]Koike MA,Garcia FG,,Kitarawa M,Green KN,et al.Long term changes in phospho-APP and tau aggregation in the 3xTg-AD mice following cerebral ischemia[J].Neurosci Lett,2011,495(1):55 -59.
[14]徐振华,许能贵,符文彬,等.电针对局灶性脑缺血大鼠缺血区APP与Tau-1蛋白表达的影响[J].中国老年学杂志,2010,30(3):361-363.
[15]王丽娟,赵玉梅,石学明.短暂性局灶性脑缺血轴突损伤定量研究方法[J].脑与神经疾病杂志,2010,18(3):216 -220.
[16]Dewar D,Yam P,McCulloch J.Drug development for stroke:importance of protecting cerebral white matter[J].Eur J Pharmacol,1999,375(1-3):41-50.
[17]Koo EH,Sisodia SS,Archer DR,et al.Precursor of amyloid protein in Alzheimer disease undergoes fast anterograde axonal transport[J].Proc Natl Acad Sci USA,1990,87(4):1561 -1565.
[18]Zhang YW,Thompson R,Zhang H,et al.APP processing in Alzheimer's disease[J].Mol Brain,2011,4:3.
[19]Kienlen -Campard P,Tasiaux B,Octave JN.The processing and biological function of the human amyloid precursor protein(APP):lessons from different cellular models[J].Exp Gerontol,2000,35(6 - 7):843-850.
[20]官杰,刘剑刚,李浩,等.还脑益聪方提取物对阿尔茨海默病模型小鼠脑组织Aβ、APP及相关分泌酶表达的影响[J].中药新药与临床药理,2011,22(3):236 -240.
[21]白洪涛,尹勇,赵万,等.弥漫性轴索损伤后早期β淀粉样前体蛋白及其炎性因子变化规律研究[J].海南医学,2012,23(9):92 -94.
[22]Van Nostrand WE,Davis J,Previti ML,et al.Clearance of amyloid -βprotein deposits in transgenic mice following focal cerebral ischemia[J].Neurodegener Dis,2013,10(1 -4):108 -111.
[23]Heurtaux T,Michelucci A,Losciuto S,et al.Microglial activation depends on beta-amyloid conformation:role of the formylpeptide receptor 2[J].J Neurochem,2010,114(2):576 -586.
[24]Marchesi VT.Alzheimer's dementia begins as a disease of small blood vessels,damaged by oxidative-induced inflammation and dysregulated amyloid metabolism:implications for early detection and therapy[J].FASEB J,2011,25(1):5 -13.
[25]王丽萍,白雪,杨思进.祛风药治疗缺血性中风的研究进展[J].中西医结合心脑血管病杂志,2006,4(2):146-148.
[26]郑国庆,王艳.风药治血与中风病证治[J].中国医药学报,2001,16(1):13-17.
