生长因子-1诱骗寡核苷酸对大鼠颈总动脉球囊损伤后血小板源性生长因子-B B表达的影响
2013-09-14王泰然刘闺男
王泰然 刘闺男
1.河北省邯郸市中心医院心内科,河北邯郸 056001;2.中国医科大学附属第一医院心内科,辽宁沈阳 110001
冠心病是临床多发病症,在现代社会当中,冠心病患者也逐年增加,临床治疗冠心病的方法较多,但目前为止还没有标准的治疗方案,从冠心病患者的形成机制进行研究,分析形成冠心病的主要因素,可以在很大程度上提高患者的临床治疗效果,达到临床治疗的目的。血小板源性生长因子 (platelet derived growth factor,PDGF)是促进血管平滑肌细胞(vascular smooth muscle cell,VSMC)增殖的重要的生长因子,尤其是血小板源性生长因子-BB(PDGF-BB)刺激VSMC的作用更强烈[1-2]。文献证实,抑制其活性可以很好地起到抑制RS的作用[1-2]。本次研究主要通过大鼠颈总动脉球囊损伤后的PDGF-BB分析,观察生长因子-1诱骗寡核苷酸对其影响,进而分析临床治疗的可行性,详细研究内容如下:
1 材料与方法
1.1 材料
研究选用北京医科大学提供的健康雄性Wistar大白鼠96只,美国Baxter health corporation生产的2F Fogarty导管,Egr-1 decoy ODN、Egr-1 杂码寡核苷酸 (scrambled decoy ODN,decoy ODN SCR)、Santa Cruz公司出产的 Egr-1兔抗大鼠多克隆抗体,逆转录聚合酶链反应(reverse transcription polymerase chain reaction,RT-PCR)试剂盒、武汉博士的公司出产的PDGF-BB兔抗大鼠多克隆抗体,大连宝生物公司出产的PCR引物合成,瑞士Roche公司生产的FuGENE6试剂。
1.2 方法
首先采用10%水合氯醛对Wistar大鼠进行麻醉,之后取大鼠颈部中间入路,将大鼠的左颈部动脉进行钝性分离,使用血管夹进行左颈动脉暂时性的阻断,采用2F导管插入大鼠左颈动脉,注入0.2 mL的0.9%氯化钠,最后反复抽拉大鼠的左颈动脉,制作大鼠左颈动脉内膜损伤模型[3]。
将96只大鼠按照随机原则分为4组,每组大鼠24只,在分组之后,标注组别,并根据组别进行不同的手术及研究。其中第一组为假手术组,采用分离左颈动脉,之后不进行球囊拉伤;第二组为损伤组,在大鼠球囊拉伤之后注入200 μL的1 mmol/L MgCl2液;第三组为SCR组,拉伤大鼠的左颈总动脉后注入 200 μL 含有 500 μg SCR ODN、30 μL转染试剂FuGene6的1 mmol/L MgCl2液;第四组为治疗组,在大鼠左总动脉球囊拉伤之后,局部注入200 μL含有500 μg FITC 标记的 decoy ODN、30 μL 转染试剂 FuGene6的1 mmol/L MgCl2溶液。不同组别大鼠处理完成之后,分别进行观察研究,研究期间将每组24只大鼠分为4个小组,每个小组6只大鼠,进行观察研究。
设计合成Egr-1特异诱骗寡核苷酸和Egr-1杂码寡核苷酸Egr-1特异诱骗寡核苷酸基因序列为:上游5'-TCGCCCTCGCCCCCGCTAAGGG-3',下游 3'-AGCGGGGGC GGGGGCGATTCCC-5'。并合成 Egr-1 decoy ODN SCR,即与诱骗序列类似的乱序排列寡核苷酸,其基因序列为:上游 5-AGCCGCACCGGCCTGCCTCGTC-3', 下游 3'-TCGGCGTGGCCGGACGGA-GCAG-5'。在其3'端和 5'端进行硫代修饰,部分诱骗寡核苷酸5'端用异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)标记用于观察转染效率。
在体decoy ODN转染室温下将Egr-1 decoy ODN 500 μg和转染试剂FuGENE6 30 μL充分混合成复合物,将复合物溶入170 μL的1 mmol/L MgCl2液当中,保持在大鼠血管球囊损伤模型制作的同时,可以进行大鼠颈部外的动脉注射。使用荧光显微镜观察大鼠的转染情况,当大鼠转染治疗1 d后,杀死1只大鼠,并提取该大鼠的治疗部分的血管,将切下的血管保存在液氮当中,制作冰冻切片,最后进行荧光显微镜观察,判断大鼠转染的成功与否,若经波长460 nm激发后残存血管内膜及中膜发出绿色荧光,则为转染成功。
保持无菌的情况下,于手术的不同时间内制作大鼠的标准,将大鼠进行麻醉并分离大鼠的左颈部的总动脉,切下大鼠的球囊,使用肝素盐水冲洗大鼠的血管,将一半大鼠的球囊进行中性甲醛固定病理学检查,另一半球囊在-70℃中保存,提供RNA提取及组织蛋白的检测等。
将大鼠的球囊病理检测标本使用石蜡进行包裹,并在其横截面上随机切下3张5 μm厚的切片,通过HE染色之后在光镜显微镜下观察其血管内膜增生的发展及发生情况,最后采用计算机进行图像分析,统计每隔3张切片内的检测结果,计算大鼠内膜增生的面积、中膜、管腔面积及内膜与中膜的面积比等数据。
Egr-1和PDGF-BB mRNA的检测采用Trizol一步法提取血管组织总RNA,取各组总RNA 3 μL逆转录合成cDNA,逆转录反应根据逆转录试剂盒要求的标准进行。以2 μg cDNA为模板进行PCR扩增,总反应体系为20 μL,包 括 2 μL 的 c DNA,10 μL 的 S YBRPremix Ex TaqTM,0.4 μL的引物和7.2 μL的超纯水。Egr-1上游引物5'-CCCAAACTGGAGGAGATGA-3',下游引物 5 'GAGGCAGAGGAAGACGATG-3'。PDGF-BB上游引物5'-CCAGGACGGTCATTTACG-3',下游引物 5 '-TGGTCTGGGTTCAGGTTG-3'。β-actin 上游引物 5 '-CGTGCGTGACATTAAAGAG-3',下游引物5'-TTGCC-GATAGTGATGACCT-3'。β-actin作为每个样品的内参。使用美国的ABI 7500实时荧光PCR仪,反应条件为:1 个循环的预变性(95°C 30 s),40 个循环的退火(95°C 5 s)和延伸(60°C 34 s)。目的基因相对于对照基因的表达量用2-△△Ct[3]法算,实验重复3次。
Egr-1和PDGF-BB蛋白的表达:每两个血管样本为一组,剪碎后提取各组动脉总蛋白,测定蛋白浓度,并进行蛋白变性、配胶、电泳、转印、封闭、一抗孵育,之后再加入稀释的辣根过氧化酶标记的二抗孵育1 h,洗膜液洗3次,每次10 min,显色2~5 min,待蛋白条带显示清晰时,中止反应,扫描,凝胶成像分析系统测定条带的平均积分光密度值,记录结果。
1.3 统计学方法
研究中所有数据统一使用SPSS 18.00统计学软件进行处理,计量资料采用均数±标准差(±s)表示,采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 在体转染效果观察
本次研究当中大鼠转染均较为成功,通过荧光显微镜观察可以发现残存血管当中的内膜及中膜出现大量的绿色荧光分布,详细情况见图1。
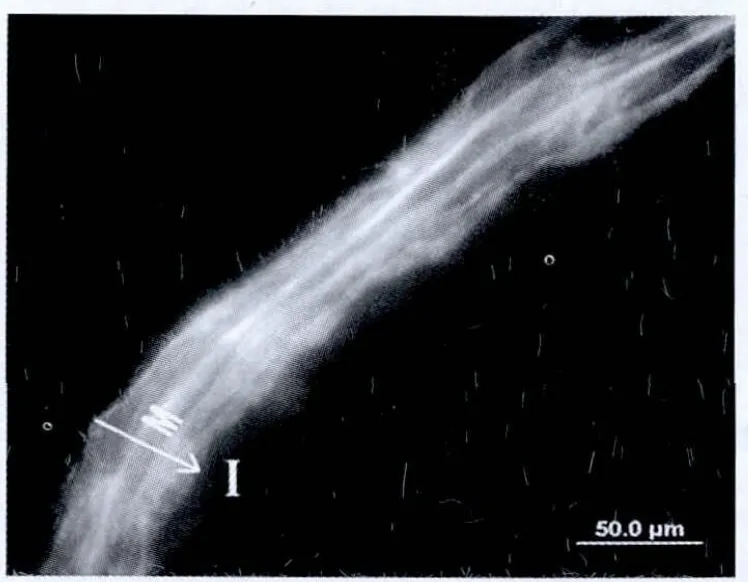
图1 Egr-1 decoy ODNs的在体转染
2.2 血管病理形态学观察
假手术组当中大鼠为假手术处理,结果大鼠的总动脉内膜非常完整,手术完成后,损伤组和SCR组大鼠的内皮出现剥落,且没有发生内膜增生。手术完成1周后,损伤组和SCR组大鼠发生血管内的内膜增生,发生管腔狭窄情况,其中2、3周后,大鼠的血管内膜增生更加明显,通过检查,发生血管内膜增生当中具有非常多的平滑肌细胞和胶原纤维,且排列非常紊乱,形态差异较大,血管管腔显著狭窄。损伤组、SCR组与治疗组相比,大鼠的内膜增生差异明显,治疗组大鼠的内膜增生受到了较强的抑制,没有明显内膜增生情况发生。见图2。
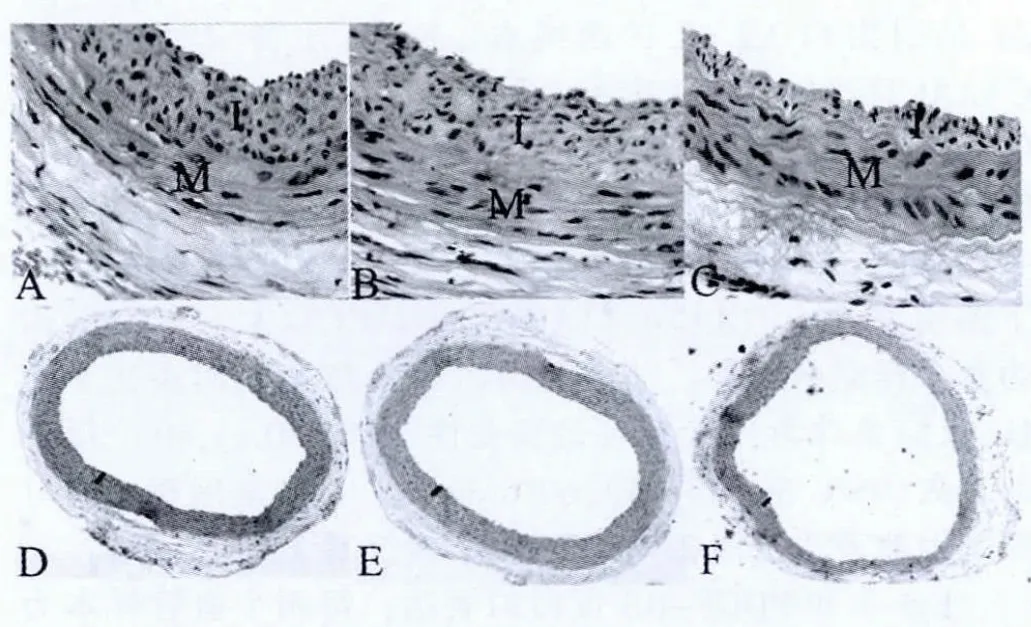
图2 Egr-1 decoy ODNs对球囊损伤后新生内膜增生的影响(HE染色)
2.3 血管壁Egr-1和PDGF-BB mRNA表达结果
假手术组的大鼠检测结果均为微弱表达情况,大鼠的球囊在损伤之后,血管壁的两种表达结果都出现增加的情况,且Egr-1的增加情况非常明显,处于持续增加的状况当中,而在第21天的检测时,损伤组及SCR组的检查结果为假手术组的(20.12±2.13)倍和(18.38±1.87)倍。而 PDGFBB mRNA的高峰在14 d,在SCR组和对照组的表达分别是假手术组的(19.03±1.55)倍和(18.39±1.62)倍,治疗组大鼠通过治疗之后,每个时间点内的血管壁检查结果都显示其表达减少,明显低于损伤组、SCR组大鼠的检查结果(P<0.01)。见图3。

图3 各组Egr-1和PDGF-BB mRNA的表达
2.4 大鼠Western blot检测Egr-1和PDGF-BB的蛋白合成检查结果
假手术组大鼠的两种检查结果都处于微弱表达情况,大鼠的球囊损伤后与血管壁检测的表达结果较为相似,同样为Egr-1的表达随着时间持续增强;而PDGF-BB的最高表达在14 d,之后开始下降,治疗组大鼠完成治疗后,蛋白表达情况明显减弱,与损伤组、SCR组大鼠的情况相比较为明显。见图4。
3 讨论
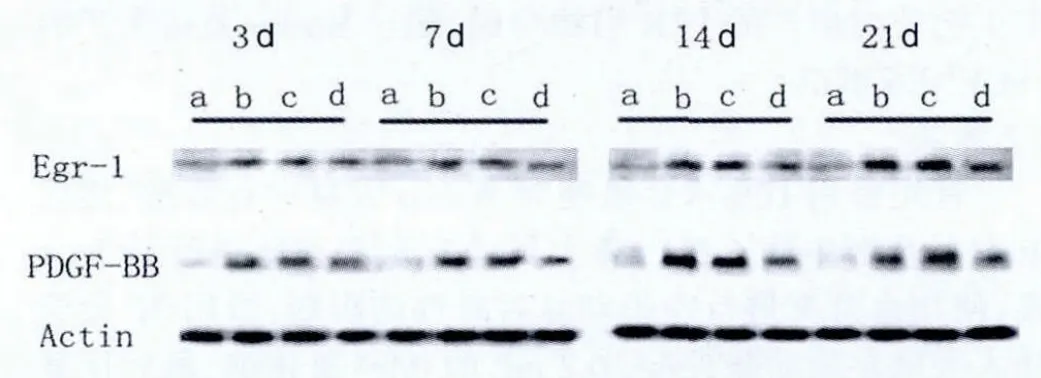
图4 Western blot法检测各组血管组织Egr-1和PDGF-BB的表达
冠心病病症的治疗,采用手术方法可以有效提高患者的治疗效果[4-5],然而临床也发现,患者在手术治疗完成后,容易发生再狭窄并发症,对患者的身体健康和恢复情况造成较大的影响,且会导致患者远期疗效降低的情况[6-8]。通过对不同因素及形成机制进行研究,深入到再狭窄患者的基因研究当中,可以从一定程度上观察到患者的内皮细胞,并对其出现的分裂、增生、内膜增生等表达情况进行分析,可以在很大程度上提高冠心病患者术后并发症的防治工作[9-14]。通过对文献资料研究,有研究利用Egr-1的特异脱氧核酶抑制了动脉损伤后Egr-1表达及新生内膜的增生,在研究中发现,Egr-1在VSMC的增殖中具有非常明显的调控作用,通过干预Egr-1转录因子基因表达,可以有效的防止VSMC增殖,进而降低内膜增生的发生概率,也就是在一定程度上降低了冠心病患者术后再狭窄并发症的出现概率,效果也较为明显[15]。
在临床免疫检验分析当中,冠心病术后并发症同样也被证实是通过细胞内转染而发生的,且这种转染的竞争性、活化性非常强,可以快速完成识别结构,同理,在研究治疗过程中,从这个角度出发,抑制下游基因表达,那么就可以有效降低患者的并发症发生情况,降低术后再狭窄的出现概率。根据文献研究,使用decoy ODN调控基因表达的基因治疗策略,同样是通过大鼠颈总动脉球囊损伤研究,结果大鼠在球囊损伤后2个星期内的新生内膜得到了有效的抑制[16-17],证实这种基因表达改变可以有效地抑制内膜增生,效果非常明显。同时,有研究利用NF-κB decoy ODN转染球囊损伤后鼠颈动脉亦显著减轻了新生内膜的生成[18]。研究表明Egr-1 Decoy ODNs抑制VSMC增殖,此作用与其抑制PCNA、cyclin D1、CDK4的表达,阻止细胞周期由G0/G1期向S期转换,抑制S期细胞合成有关[8]。
PDGF-BB是由多种细胞分泌的促细胞生长因子,是VSMC最有力的促有丝分裂原之一。球囊损伤血管后,损伤的内皮细胞、激活的血小板、移行于内皮下的单核巨噬细胞以及表型转化后的合成型VSMC都能以自分泌、旁分泌形式释放大量的PDGF-BB。PDGF-BB与其膜表面受体结合,激活受体的内源性酪氨酸激酶活性,通过磷酸化胞浆中的信号分子,最终将信息传递到核内,导致VSMC增殖[19]。动物实验表明,动脉损伤后升高的PDGF-BB水平同新生内膜细胞的增殖有关[20-22]。针对PDGF的抗PDGF抗体[13],受体表达的反义寡核苷酸[23],或使用PDGF的信号转导抑制剂都被证明可以减轻内膜的增生。总结这些研究结果表明,PDGF-BB在再狭窄中起着重要的作用。本研究结果表明,正常血管壁PDGF-BB表达微弱,动脉损伤后血管壁PDGF-BB的表达升高,14 d表达水平最高,之后开始下降,decoy OND治疗后其表达减少。因此表明Egr-1 decoy ODN通过切割Egr-1mRNA,从而减少Egr-1的表达,这也就在一定程度上控制了PDGF-BB的转录和表达,进而达到抑制动脉损伤后的内膜增生出现概率。
综上所述,通过本次研究,可以证实Egr-1诱骗寡核苷酸可以有效地对大鼠颈总动脉球囊损伤后的PDGF-BB进行抑制,效果非常显著,因此,在冠心病的临床医学研究当中,可以将这种基因表达治疗方法纳入研究体系中,为患者的临床治疗提供一定参考,进一步地进行理论和实验研究后,为防治患者术后并发症提供医疗保证,意义较强,研究也为临床医学提供一定参考。
[1]McCaffrey TA,Fu C,Du C,et al.High-level expression of Egr-1 and Egr-1-inducible genes in mouse and human atherosclerosis [J].J Clin Invest,2000,105(5):653-662.
[2]Levon M.Khachigian.Early Growth Response-1 in Cardiovascular Pathobiology[J].Circ Res,2006,98(2):186-191.
[3]Santiago FS,Lowe HC,Kavurma MM,et al.New DNA enzyme targeting Egr-1 mRNA inhibits vascular smooth muscle proliferation and regrowth after injury[J].Nat Med,1999,5 (11):1264-1269.
[4]Mann MJ,Dzau VJ.Therapeutic applications of transcription factor decoy oligo-nucleotides[J].J Clin Invest,2000,106(9):1071-1075.
[5]Ryuichi M,Jitsuo H,Naruya T,et al.Application of transcription factor"decoy"strategy as means of gene therapy and study of gene expression in cardiovascular disease [J].Circ Res,1998,82 (10):1023-1028.
[6]Schtmittgen TD,Livak KJ.Analyzing real-time PCR data by the comparative C(T)method[J].Nat Protoc,2008,3(6):1101-1108.
[7]Ohtani K,Egashira K,Usui M,et al.Inhibition of neointimal hyperplasia after balloon injury by cis-element‘decoy’ of early growth response gene-1 in hyper-cholesterolemic rabbits[J].Gene Therapy,2004,11(2):126-132.
[8]张磊磊,司忠义.基质金属蛋白酶与血管损伤后再狭窄的防治[J].广东医学,2010,31(18):2463-2466.
[9]Blaschke F,Bruemmer D,Law RE.Egr-1 is a major vascular pathogenic transcription factor in atherosclerosis and restenosis[J].Rev Endocr Metab Disord,2004,5(3):249-254.
[10]Yoshimura S,Morishita R,Hayashi K,et al.Inhibition of intimal hyperplasia after balloon injury in rat carotid artery model using cis-element “decoy” of nuclear factor-kappa B binding site as a noved molecular strategy[J].Gene Ther,2001,21(8):1635-1642.
[11]Nakamura T,Morishita R,Asai T,et al.Molecular strategy using cis-element'decoy'ofE2F bindingsiteinhibitsneointimal formation in porcine balloon-injured coronary artery model[J].Gene Ther,2002,9(8):488-494.
[12]Han W,Liu GN.EGR-1 decoy ODNs inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia of balloon-injured arteries in rat[J].Life Science,2010,86(7-8):234-243.
[13]王云雅,汪静,邓敬兰,等.放射性PDGFR反义寡核苷酸对血管平滑肌细胞增殖和凋亡的影响[J].心脏杂志,2006,18(4):388-390.
[14]Papaharalambus CA,Griendling KK.Basic mechanisms of oxidative stress and reactive oxygen species in cardiovascular injury[J].Trends Cardiovasc Med,2007,17(2):48-54.
[15]Huang M,Duhadaway JB,Prendergast GC,et al.RhoB regulates PDGFR-beta trafficking and signaling in vascular smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2007,27(12):2597-2605.
[16]Seo JM,Jin YR,Ryu CK,etal.JM91,a newly synthesized indoledione derivative,inhibits rat aortic vascular smooth muscle cells proliferation and cell cycle progression through inhibition of ERK1/2 and Akt activations[J].Biochem Pharmacol,2008,75(6):1331-1340.
[17]Uchida K,Sasahara M,Morigami N,et al.Expression of plateletderived growth factor B-chain in neointimal smooth muscle cells of balloon injured rabbit femoral arteries[J].Atherosclerosis,1996,124(1):9-23.
[18]Yang X,Thomas DP,Zhang X,et al.Curcumin inhibits plateletderived growth factor-stimulated vascular smooth muscle cell function and injury-induced neointima formation [J].Arterioscler Thromb Vasc Biol,2006,26(1):85-90.
[19]Lim Y,Kim TJ,Jin YR,et al.Epothilone B inhibits neointimal formation after rat carotid injury through the regulation of cell cycle-related proteins [J].J Pharmacol Exp Ther,2007,321(2):648-655.
[20]Ferns GA,Raines EW,Sprugel KH,et al.Inhibition of neointimal smooth muscle accumulation after angioplasty by an antibody to PDGF[J].Science,1991,253(5024):1129-1132.
[21]SiroisMG,SimonsM,Edelman ER.Antisenseoligonucleotide inhibition of PDGFR-beta receptor subunit expression directs suppression of intimal thickening[J].Circulation,1997,95(3):669-676.
[22]Panetta CJ,Miyauchi K,Berry D,et al.A tissue-engineered stent for cell-based vascular gene transfer[J].Hum Gene Ther,2002,13(3):433-441.
