输尿管结扎预适应通过上调热休克蛋白2 7的表达减轻肾脏缺血再灌注损伤
2013-09-14张治国韩从辉
董 洋 郝 林 张治国 韩从辉,▲
1.东南大学临床医学院,江苏南京 210009;2.江苏省徐州市中心医院泌尿外科,江苏徐州 221009
缺血再灌注(IR)损伤是指组织或器官缺血后重获血流灌注或氧供,组织或器官损伤反而加重的现象。临床上肾IR是肾移植中不可避免的损伤之一,如何有效地预防和减轻IR损伤一直受到广泛重视[1-2]。有研究表明,输尿管结扎(UO)预适应可有效减轻肾脏IR损伤,但其具体机制尚不明确[3]。热休克蛋白27(HSP27)作为一种有效的抗细胞凋亡蛋白,能减少细胞坏死,在稳定纤维型肌动蛋白细胞骨架中发挥重要作用[4]。本研究旨在运用野生型小鼠和肾内靶向抑制HSP27表达的小鼠,通过建立小鼠肾脏UO及IR模型,探讨HSP27在UO减轻肾IR损伤中的作用。
1 材料与方法
1.1 实验动物与主要试剂
1.1.1 实验动物 8~10周龄雄性C57BL/6小鼠,体重23~28 g,无固定病原体级,购自中国科学院上海实验动物中心,自由进食、饮水,于清洁环境下昼夜各12 h规律饲养。
1.1.2 实验试剂 包装有干扰HSP27表达的短发夹RNA的重组腺病毒购于Invitrogen公司;抗HSP27抗体(1∶500稀释)购于 Cell Signaling Technology公司;抗肌动蛋白(βactin)抗体购于Santa Cruz Biotechnology公司;聚合酶链反应(PCR)引物购于TaKaRa公司;胱天蛋白酶3活性检测试剂盒购于上海碧云天公司。
1.2 模型制备
1.2.1 输尿管结扎预适应(UO)24 h模型制备 参阅已有的UO模型基础[2],笔者进行了改进。小鼠于腹腔注射戊巴比妥钠,短暂麻醉后,常规消毒皮肤,取下腹部正中切口,暴露左侧肾脏及输尿管,确认输尿管后,沿输尿管于距肾盂1 cm用7-0丝线打一活结,结扎输尿管,右侧输尿管不做处理,丝线的另一端待缝合切口时埋于皮下,24 h后松掉7-0丝线,使输尿管再通。
1.2.2 肾脏缺血再灌注损伤(IR)模型制备 小鼠输尿管再通后48 h进行IR处理。使用戊巴比妥钠(60 mg/kg)腹腔注射麻醉小鼠,用AIT-HTP动物恒温维持系统(上海奥尔科特生物科技有限公司)维持小鼠体温在36℃左右,腹正中线开腹,切除右肾,游离左侧肾蒂,无损伤动脉夹毕左侧肾蒂25 min,随后开放血管。
1.3 检测UO对肾IR损伤及炎性反应的影响
为了检测UO对肾IR损伤及炎性反应的影响,本研究采用随机数字表法将C57BL/6小鼠分为3组,每组各30只,进行实验观察:①空白对照组:以正常C57BL/6小鼠作为对照。②UO+IR组:结扎小鼠左侧输尿管24 h后再通,再通48 h后行IR处理。③non-UO+IR组:除不结扎左输尿管,其余操作同UO+IR组。IR后24 h处死小鼠,收集血清和肾组织样本,检测Cr水平及TNF-α和IL-6两种炎症因子mRNA表达情况。
1.4 检测UO对肾组织HSP27的影响
为了检测UO对肾组织HSP27的影响,笔者采用随机数字表法将C57BL/6小鼠分为2组,每组各20只,进行实验观察:①UO组予以左侧UO处理,UO 24 h后输尿管再通,再通48 h后处死小鼠,取左肾组织样本,检测HSP27蛋白表达。②non-UO组:除不结扎左输尿管其余操作同UO组。
1.5 检测靶向抑制小鼠肾脏HSP27表达的效果及其对UO效果的影响
采用随机数字表法将C57BL/6小鼠分为2组,每组各50只,一组小鼠予以左肾脏实质组织注射包装有干扰HSP27表达的短发夹RNA的重组腺病毒100 μL靶向抑制HSP27的表达,并将该小鼠设为HSP27干扰组;另一组小鼠予以注射空病毒100 μL作为对照组。10 d后每组随机取10只小鼠获取左肾组织,通过蛋白质印迹法验证成功干扰HSP27表达后,每组再随机分为UO+IR与non-UO+IR两个亚组,每个亚组各20只小鼠 (UO+IR亚组及non-UO+IR亚组处理方法同方法“1.3”项下所述),再灌注24 h后取血及肾组织标本,检测HSP27干扰后UO对IR的影响。
1.6 检测指标
1.6.1 肾功能检测 再灌注后24 h,小鼠腹腔注射少量戊巴比妥钠溶液麻醉,腹主动脉采血,分离血清,用Siemens公司Dade behring dimension xpand自动分析仪检测Cr水平。1.6.2肾组织内HSP27表达的检测 采用蛋白质印迹法进行检测,以 β-actin为参照,检测肾组织内HSP27的相对表达量。实验重复3次。
1.6.3 肾组织内炎症介质TNF-α及IL-6 mRNA水平的检测 采用实时定量逆转录聚合酶链反应 (RT-PCR)法,以β-actin为参照,检测肾组织内TNF-α及IL-6 mRNA的相对表达量。重复3次。
1.6.4 肾组织内胱天蛋白酶3活性的检测 各组获取的肾组织样本均浆后,加入细胞裂解液,然后加入胱天蛋白酶3四肽荧光底物Ac-DEVDAMC,置于37℃下反应1 h,用荧光分光光度计分析荧光强度,激发光波长为380 nm,发射光波长为430~460 nm。
1.7 统计学方法
采用统计软件SPSS 11.0对实验数据进行分析,计量资料数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,行 t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 UO减轻IR后肾损伤及炎性反应
与空白对照组相比,UO+IR组和non-UO+IR组再灌注后24 h血清Cr水平均均明显增高,差异均有统计意义(P<0.05); 与non-UO+IR组相比,UO+IR组Cr水平显著下降(P<0.05,图1)。与Cr结果相似,UO预适应明显降低了IR后肾组织内炎症介质的表达,与non-UO+IR组相比,UO+IR组TNF-α及IL-6 mRNA的表达均明显减少(P<0.05,图2)。
2.2 UO预适应诱导肾组织内HSP27表达上调
经蛋白质印迹法检测发现,经UO预适应后小鼠肾组织内HSP27的蛋白表达水平显著上调,与non-UO组比较,差异均有统计学意义(P<0.05,图3)。
2.3 抑制肾组织内HSP27表达逆转UO的肾保护作用
HSP27干扰组小鼠在IR前无论是否进行了UO处理,其再灌注后24 h的血清Cr水平及炎症介质 (TNF-α和IL-6)mRNA 表达均无统计学差异(P>0.05,图4、5)。
2.4 HSP27抑制细胞凋亡
对照组小鼠IR前经UO预适应处理能够明显降低再灌注后胱天蛋白酶3的表达(P<0.05),而HSP27干扰组小鼠IR后无论是否经UO预适应处理胱天蛋白酶3的表达无明显变化(P>0.05,图6)。
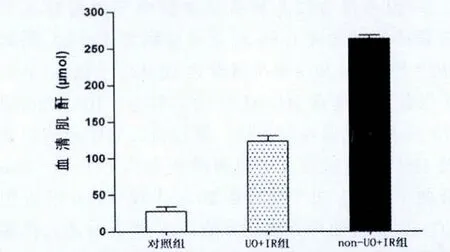
图1 再灌注24 h后各组血清肌酐水平
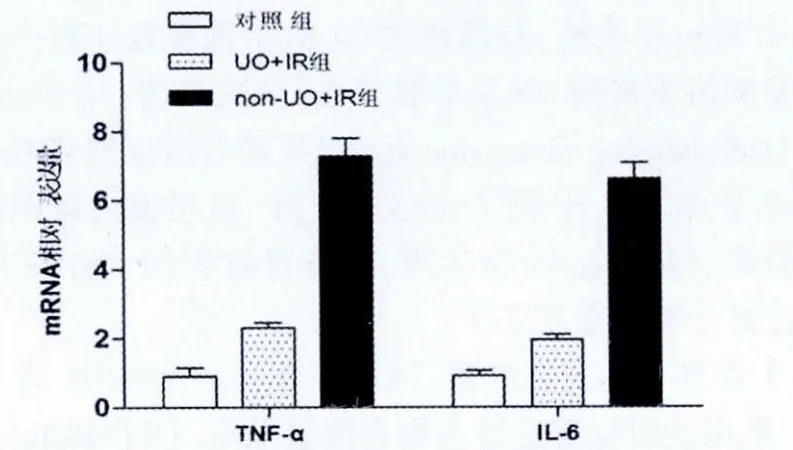
图2 再灌注24 h后各组炎症介质表达情况

图3 输尿管结扎预适应后肾组织热休克蛋白27表达情况
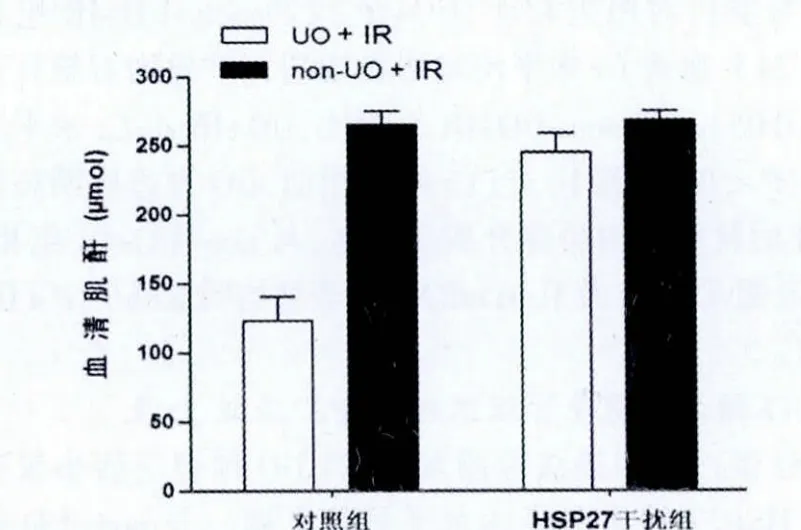
图4 热休克蛋白27干扰组与对照组经输尿管结扎及未经输尿管结扎后缺血再灌注24 h肌酐水平
3 讨论
缺血再灌注损伤是引起急性肾功能衰竭的重要原因之一,如何防治肾脏IR损伤是临床上迫切需要解决的问题[1-2]。肾脏IR损伤的发生机制比较复杂,目前主要可归结为内皮细胞功能受损、氧自由基增加、线粒体损伤、一氧化氮的损耗、炎症因子的释放及浸润等,均可导致器官功能障碍及细胞坏死、凋亡[2-5]。大量研究使用动物模型对肾脏IR损伤的预防及保护进行了广泛研究及重点阐述,并取得了显著进展[6]。
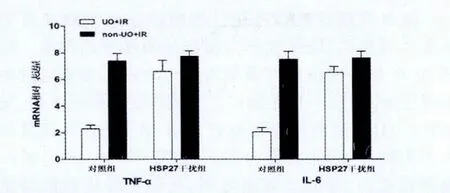
图5 热休克蛋白27干扰组与对照组经输尿管结扎及未经输尿管结扎后缺血再灌注24 h炎症介质表达情况
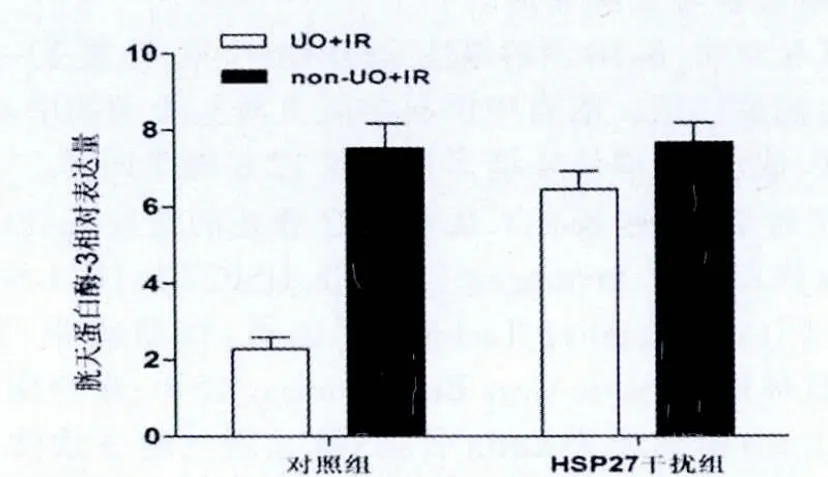
图6 热休克蛋白27干扰组与对照组经输尿管结扎及未经输尿管结扎后缺血再灌注24 h肾内胱天蛋白酶3活性比较情况
热休克蛋白(HSPs)是一组参与蛋白质折叠、修复、变性的应激激活蛋白[7],其中HSP-27在抗细胞凋亡中发挥重要作用[5-8],并可通过多种途径抑制炎性反应[9]。Kim等[10]使用肾脏高表达HSP-27的小鼠发现,相比于野生型小鼠,其肾脏缺血再灌注损伤明显减轻,并指出HSP-27可通过稳定细胞骨架发挥减轻内皮细胞损伤的作用。笔者既往研究发现,胆总管结扎预适应可减轻肾IR损伤,其保护作用可能是通过HSP-27表达上调介导的[11]。因此,笔者有理由推测HSP-27可能参与UO减轻肾脏IR损伤的过程。
本实验中,笔者通过蛋白质印迹技术发现经UO预处理后小鼠肾脏内HSP27表达明显上调,与笔者前期实验结果相符[12],表明UO介导的保护作用可能与HSP27有关;笔者进一步通过构建肾脏内靶向干扰HSP27表达的小鼠,检测其肾脏内HSP27被成功抑制后,予以UO和IR处理,发现UO减轻IR损伤的作用明显减弱,说明HSP27在UO减轻IR后肾损伤的过程中发挥重要作用。同时,笔者还发现UO能明显减轻IR后胱天蛋白酶3的表达,而这一效应在肾内HSP27抑制后明显减弱,提示HSP27可能通过减少细胞凋亡的途径参与UO介导的肾保护作用。尽管临床上通过输尿管结扎预适应来达到减轻肾脏缺血再灌注的目的并不可行,但是对其详细作用机制的研究能够为未来关于肾脏缺血再灌注损伤的防治提供新的思路,对其他器官缺血再灌注损伤的研究也具有重要意义。
[1]Liangos O.Drugs and AKI[J].Minerva Urol Nefrol,2012,64(1):51-62.
[2]Lameire N,Van BW,Vanholder R.Acute renal failure[J].Lancet,2005,365(9457):417-430.
[3]Park KM,Kramers C,Vayssier TM,et al.Prevention of kidney ischemia/reperfusion-induced functional injury,MAPK and MAPK kinase activation,and inflammation by remote transient ureteral obstruction[J].J Biol Chem,2002,277(3):2040-2049.
[4]Laskowska E.Small heat shock proteins--role in apoptosis,cancerogenesis and diseases associated with protein aggregation[J].Postepy Biochem,2007,53(1):19-26.
[5]Kaszaki J,Wolfard A,Szalay L,et al.Pathophysiology of ischemiareperfusion injury[J].Transplant Proc,2006,38(3):826-828.
[6]Wever KE,Menting TP,Rovers M,et al.Ischemic preconditioning in the animal kidney,a systematic review and meta-analysis[J].PLoS One,2012,7(2):e32296.
[7]Snoeckx LH,Cornelussen RN,Van FA,et al.Heat shock proteins and cardiovascular pathophysiology[J].Physiol Rev,2001,81(4):1461-497.
[8]Garrido C,Brunet M,Didelot C,et al.Heat shock proteins 27 and 70:anti-apoptotic proteins with tumorigenic properties[J].Cell Cycle,2006,5(22):2592-2601.
[9]Jones Q,Voegeli TS,Li G,et al..Heat shock proteins protect against ischemia and inflammation through multiple mechanisms[J].Inflamm Allergy Drug Targets,2011,10(4):247-259.
[10]Kim M,Park SW,Chen SW,et al.Selective renal overexpression of human heat shock protein 27 reduces renal ischemia-reperfusion injury in mice[J].Am J Physiol Renal Physiol,2010,299(2):347-358.
[11]Wang PL,Dong Y,Zhang M,et al.Commom bile duct ligation preconditioning alleviates renal ischemia reperfusion injury in mice[J].Chin J Organ Transplant,2012, 33(8):459-461.
[12]Zhang S,Han CH,Xia Q,et al.Transient ureteral obstruction prevents against kidney ischemia/reperfusion injury via hypoxia-inducible factor (HIF)-2alpha activation[J].PLoS One,2012,7(1):e29876.
