微生态制剂在新生儿窒息后喂养不耐受的应用及其对胃动素的影响
2013-09-14穆艳顺刘花玲宋冬梅刘红伟刘俊峰张冬婕刘燕春
穆艳顺 刘花玲 宋冬梅 刘红伟 刘俊峰 张冬婕 刘燕春
华北石油总医院儿科,河北任丘 062552
新生儿窒息是一种可造成多个系统器官损害的严重病理过程,由于窒息时导致胃肠道呈低灌注状态,胃肠动力差,胃肠激素水平较低,肠壁细胞代谢障碍及组织损伤,肠黏膜病理变化为肠壁水肿、坏死,肠功能改变为肠蠕动减弱,细菌繁殖及肠通透性改变,临床表现为呕吐、胃潴留、腹胀、胃食管反流等喂养不耐受现象。喂养不耐受会导致肠吸收延长、营养不良,还会使新生儿易患坏死性小肠炎、肝功障碍、胆汁淤积,从而影响新生儿的生长发育和存活[1]。对此笔者在胃肠外营养的基础上采用微生态制剂双歧杆菌三联活菌胶囊治疗取得了较好的临床疗效,现报道如下:

表1 两组患儿一般资料比较
1 资料与方法
1.1 一般资料
选择2009年9月~2012年8月华北石油总医院收治的窒息后喂养不耐受患儿58例为研究对象,所有患儿家长知情同意,其中男34例,女24例,患儿出生时孕龄37~42 周,生后 1 min Apgar 评分 3~7 分,窒息持续 5~10 min,开始喂奶时间≤48 h。将所选研究对象随机分为双歧杆菌治疗组与全胃肠外营养对照组,每组各29例;其中双歧杆菌治疗组男18例,女11例,全胃肠外营养对照组男16例,女13例,两组性别、孕龄、体重、窒息程度等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性。见表1。该研究获医院伦理委员会批准。
1.2 喂养不耐受病例选择标准
排除器质性疾病,出现如下情况之一者:①频繁呕吐每日≥3次;②胃残留量超过上次喂养量的1/2;③24 h 腹围增加1.5 cm;④胃残留物被胆汁污染;⑤胃内咖啡样物排除为咽下母血。
1.3 治疗方法
双歧杆菌治疗组与全胃肠外营养对照组均采用治疗原发病、纠正其他脏器功能衰竭、静脉营养等常规治疗。全胃肠外营养对照组在出现喂养不耐受后即停止经口喂养,用生理盐水洗胃后酌情微量喂养,并改为常规胃肠外营养的形式以保证营养物质的摄入,常规通便及防治感染,维持水、电解质平衡、对症及支持治疗。双歧杆菌治疗组在常规胃肠外营养的基础上口服或经鼻饲微生态制剂(晋城海斯制药有限公司,双歧杆菌三联活菌胶囊,生产批号:国药准字 S19993065,210 mg/粒),半粒/次,3 次/d,温开水喂用,疗程7d,观察患儿腹胀、呕吐、胃潴留情况,胃潴留指胃残余量超过喂养量的30%或胃内有咖啡色样物。
1.4 样本的采集与测定
双歧杆菌治疗组与全胃肠外营养对照组患儿分别于治疗前、治疗后3、4 d 采集静脉血,应用解放军总医院科技开发中心放射免疫所提供的胃动素(MOT)放免疫试剂盒进行MOT 检测。
1.5 疗效判定标准[2]
显效:治疗3~5 d,腹胀、呕吐症状消失,肠鸣音正常,鼻饲奶1次/2~3 h,能耐受,无胃内容物潴留;有效:治疗5~7d,腹胀、呕吐症状减轻,肠鸣音弱,鼻饲奶 1 次/(2~3)h,胃内容物潴留<1/3;无效:治疗>7d,腹胀呕吐症状无好转,肠鸣音弱,鼻饲奶 1 次/(2~3)h,胃内容物潴留>1/3。
1.6 统计学方法
采用统计软件SPSS 13.0对数据进行分析,正态分布的计量资料以均数±标准差(±s)表示,两独立样本的计量资料采用t检验;计数资料以率表示,采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床症状改善情况比较
双歧杆菌治疗组在呕吐、腹胀症状消失时间 [(3.03 ±1.14)d]优于全胃肠外营养对照组[(4.65 ±1.11)d],差异有统计学意义(P<0.05);治疗组恢复出生体质量时间[(7.68 ±1.73)d]优于全胃肠外营养对照组[(9.72 ±2.78)d],差异有统计学意义(P<0.05);双歧杆菌治疗组达全量肠内营养时间[(9.03±1.84)d]优于全胃肠外营养对照[(10.79±2.19)d],差异均有统计学意义(P<0.05)。见表2。
表2 两组症状改善情况比较(d,±s)
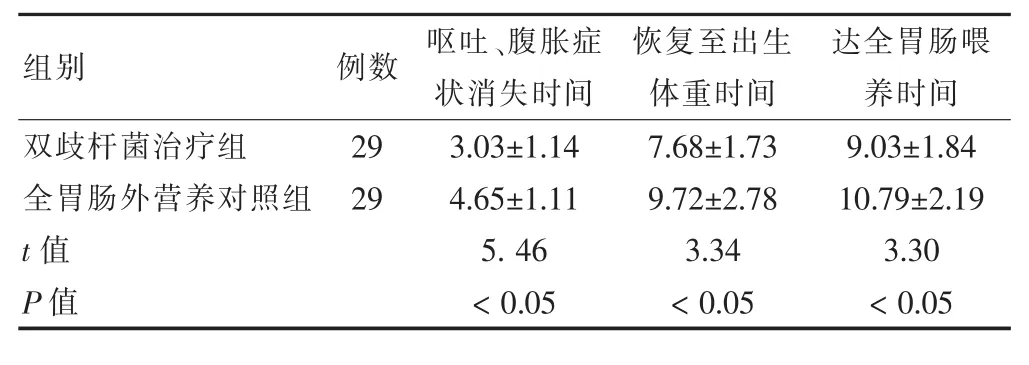
表2 两组症状改善情况比较(d,±s)
组别 例数 呕吐、腹胀症状消失时间恢复至出生体重时间达全胃肠喂养时间双歧杆菌治疗组全胃肠外营养对照组29 29 t值 P值3.03±1.14 4.65±1.11 5.46<0.05 7.68±1.73 9.72±2.78 3.34<0.05 9.03 ±1.84 10.79 ±2.19 3.30<0.05
2.2 两组临床疗效比较
双歧杆菌治疗组中显效20例,有效7例,无效2例,总有效率93.11%。全胃肠外营养对照组显效10例,有效11例,无效8例,总有效率72.41%。双歧杆菌治疗组总有效率显著高于全胃肠外营养对照组,差异有统计学意义(P<0.05),见表3。
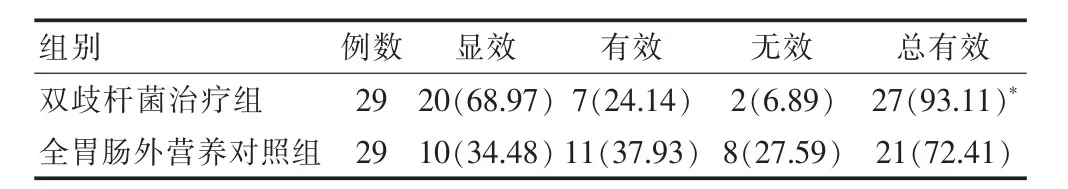
表3 两组治疗效果的比较[n(%)]
2.3 两组不同时间血MOT水平变化比较
两组治疗前血MOT 比较差异无统计学意义(P>0.05),治疗后3 d 双歧杆菌治疗组血MOT水平[(259.20±23.35)ng/L]高于全胃肠外营养对照组血 MOT水平[(221.37 ±18.51)ng/L],差异有统计学意义(P<0.05);治疗后 4 d 治疗组血 MOT 水平[(324.72 ±14.53)ng/L]高于对照组血浆 MOT 水平[(298.10±15.55)ng/L],差异有统计学意义(P<0.05)。见表4。
表4 两组不同时间血胃动素比较(ng/L,±s)

表4 两组不同时间血胃动素比较(ng/L,±s)
注:与全胃肠外营养对照组比较,bP<0.05
组别 例数 治疗前 治疗后3 d 治疗后4 d双歧杆菌治疗组全胃肠外营养对照组29 29 194.31 ±25.01 189.82 ±17.38 259.20±23.35b 221.37±18.51 324.72±14.53b 298.10±15.55
3 讨论
新生儿胃肠调节功能较差,胃肠激素分泌水平较低,胃动素是协调胃、十二指肠运动、分泌、吸收的主要激素,胃泌素能刺激胃酸、胃蛋白酶的分泌,促进胃肠道运动,同时还能促进胃肠粘膜生长[3]。新生儿窒息时脑的缺血缺氧使中枢神经系统对胃肠激素分泌的控制作用减弱,而胃肠道动力受中枢神经系统和肠道神经系统的双重控制,由于上述原因直接或间接地抑制了G 细胞分泌的胃泌素及小肠的M 细胞分泌的胃动素,血清胃泌素及血浆胃动素水平降低,造成早期喂养不耐受,易发生溢奶、反流、呕吐、腹胀及坏死性小肠结肠炎等。另外,窒息时其一氧化氮水平的明显增高,可使食管下括约肌和胃底肌张力降低,胃体和胃窦自发性收缩的频率减少、振幅下降,从而减慢了胃运动,是引起窒息后喂养不耐受的另一重要原因[4]。喂养不耐受影响肠道摄取热量和营养,导致蛋白质不足、体重不增,需长时间静脉营养。静脉营养可引起胆汁淤积、出血、高胆红素血症等并发症。研究发现早期微量喂养可刺激消化酶、胃肠激素分泌减轻喂养不耐受[5],因而尽早过渡为全胃肠内喂养,是防治静脉营养并发症的根本措施[6]。
微生态制剂的主要作用机制是使肠道内减少或缺乏的正常微生态菌群在数量上或种类上恢复其微生态平衡,从而利于人体营养吸收,维持消化道内环境相对稳定,以增强宿主的肠道屏障保护作用,促进优势菌的生长,建立健康的肠道菌群[7]。研究表明,大量生活在人类肠道中的益生菌可能帮助肠道内避免受伤害[8]双歧杆菌制剂,属于微生态制剂,它可产生大量酸性物质降低肠道内的pH值,使肠道pH 呈酸性,使致病菌不能定植、存活和繁殖,且酸性物质可以刺激肠道的蠕动,并减少致病菌在肠道内的滞留,这些生理菌群含有多种酶,能水解蛋白,分解碳水化合物,使脂肪溶化,溶解纤维素,从而促进食物消化、吸收和利用;代谢过程还产生大量有机酸,刺激肠壁蠕动,促进胃排空,从而改善喂养不耐受[9]。Sjg ren等[10]发现益生菌可降低肠道通透性,增强肠道特异性IgA 反应,还有助于提高肠道屏障功能,使肠道微生态环境恢复正常。口服微生态制剂可提高IgA的分泌,增加外周血细胞非常特异性吞噬功能,增加肠道局部免疫力[11]。因而服用双歧杆菌在促进胃肠道蠕动的同时,还能增加机体的免疫力。
本研究发现,双歧杆菌治疗组在呕吐、腹胀症状消失时间[(3.03±1.14)d]优于全胃肠外营养对照组[(4.65±1.11)d],差异有统计学意义(P<0.05);治疗组恢复出生体质量时间[(7.68±1.73)d]优于全胃肠外营养对照组[(9.72±2.78)d],差异有统计学意义(P<0.05);双歧杆菌治疗组达全量肠内营养时间[(9.03±1.84)d]优于全胃肠外营养对照[(10.79±2.19)d],差异均有统计学意义(P<0.05)。双歧杆菌治疗组总有效率(93.11%)显著高于全胃肠外营养对照组(72.41%),差异有统计学意义(P<0.05)。通过分阶段对患儿血MOT水平的检测,笔者发现喂养不耐受的窒息患儿其血MOT水平有明显升高的趋势,这表明了窒息后发生的喂养不耐受的确与血MOT的异常存在一定的相关性。经采用双歧杆菌三联活菌胶囊治疗后,患儿血MOT水平呈逐渐升高,相比传统治疗方案,治疗组疗效更明显,因此窒息新生儿发生喂养不耐受后,在常规胃肠外营养的基础上采用微生态制剂恢复微生态平衡,有利于营养吸收,满足机体对水和营养物质的供给,同时对胃肠道激索分泌水平恢复正常也能起到有效的促进作用,双歧杆菌三联活菌胶囊治疗新生儿喂养不耐受有效,值得临床推广。
[1]Ng E,Shah VS.Erythromycin for the prevention and treatment of feeding intolerance in preterm infants [J].Cochrane Database Syst Rev,2008,16(3):CD001815.
[2]李荷清,赵晓燕.双歧杆菌四联活菌片联合四磨汤口服液治疗早产儿喂养不耐受[J].国际护理学杂志,2010,29(7):1040-1041.
[3]Pimento HP,Moreira ME,Rocha AD.et aL.Efects of non-nutritive sucking and oral stimulation on breastfeeding rates for preterm,low birth weight infants,a randomized clinical trial[J].J pediatr(Rio j),2008,84(5):423-427.
[4]Schmitt EL,Baum VC.Nitrous oxide in pediatric anesthesia:friend or foe?[J].Curr opin Anaesthesiol,2008,21(3):356-359.
[5]Klein CJ,Revenis M,Kusenda C,et al.Parenteral nutrition--associated conjugated hyperbilirubinemia in hospitalized infants[J].J Am Diet assoc,2010,110(11):1684-1695.
[6]Cilieborg MS,Boye M,Thymann T, et al.Diet-dependent effects of minimal enteral nutrition on intestinal functionand necrotizing enterocolitis in preterm pigs [J].JPEN J Parenter Enteral Nutr,2011,35(1):32-42.
[7]Culliqan EP,HiII C,Sleator RD.Probiotics and gastrointestinal disease:successes,problems and future Prospects [J].Gut Pathog,2009,1(1):19.
[8]Hong YS,Hong KS,Park MH,et al.Metabonomic;understanding of probiotic effects in humans with irritable bowel syndrome[J].J Clin Gastmenterol,2011,45(5):415-425.
[9]Noqami K,Nishikubo T,Minowa H,et al.Itnravenous low-dose erythromycin administrationfor infants with feeding intolerance[J].PediatrInt,2001,43( 6 ):605-610.
[10]Sjo gren YM,Tomicic S, Lundberg A,et al.Influence of early gut microbiota on the maturation of childhood mucosal and systemic immune responses[J].Clin Exp Allergy,2009,39(12):1842-1851.
[11]Rinne M,Kalliomaki M,Arvilommi H,et al.Effect of probiotics and breastfeeding nn the bifidobacerium and lactohacillus/enterococcus microbiota and humoral immune responses[J].J Pediatr,2005,147(2):186-191.
