门冬氨酸鸟氨酸注射液细菌内毒素检查法的研究
2013-09-14许雷鸣
许雷鸣 武 谷 顾 倩
1.安徽省食品药品检验所,安徽合肥 230051;2.皖南医学院,安徽芜湖 241000
门冬氨酸鸟氨酸注射液为肝胆疾病辅助用药,临床上主要用于因急、慢性肝病(如各型肝炎、肝硬化、脂肪肝、肝炎后综合征)引发的血氨升高及治疗肝性脑病,尤其适用于治疗肝昏迷早期或肝昏迷期的意识模糊状态。国内市场上已有本品的进口药品,目前尚无国内药厂的门冬氨酸鸟氨酸注射液上市。门冬氨酸鸟氨酸注射液的国家食品药品监督管理局进口药品注册标准采用家兔法进行热原检查,本实验根据 《中国药典》2010年版二部 “细菌内毒素检查法”[1]99-101和“化学药品注射剂安全性检查法应用指导原则”[1]212-213,以及相关细菌内毒素检查的文献[2-12],对门冬氨酸鸟氨酸注射液应用鲎试剂进行细菌内毒素检查的可行性进行了研究并建立了门冬氨酸鸟氨酸注射液的细菌内毒素检查方法。
1 仪器与试药
1.1 仪器
VS-1300L-U 洁净工作台(苏净集团苏州安泰空气技术有限公司),S648 恒温水浴锅(上海医疗器械七厂),XW-80A 混旋仪(上海沪西分析仪器厂有限公司),微量取液器(50~250 μL,上海荣泰生化工程有限公司),细菌内毒素检查用具(湛江博康海洋生物有限公司),智能热原仪(天津大学无线电厂精密仪器厂,ZRY-2D型)。
1.2 细菌内毒素检查用水
细菌内毒素检查用水(福州新北生化工业有限公司,批号:11102021,规格:100 mL/瓶)。
1.3 细菌内毒素工作标准品(冻干品)
细菌内毒素工作标准品(冻干品)(中国食品药品检定研究院,效价:120 EU/支,批号:150601-201072)。
1.4 鲎试剂与家兔
鲎试剂(福州新北生化工业有限公司,批号:11091912,灵敏度:0.25 EU/mL,规格:0.1 mL/支;湛江博康海洋生物有限公司,批号:1112010,灵敏度:0.25 EU/mL,规格:0.1 mL/支);新西兰兔,普通级,体重1.7 kg 以上,购自南京青龙山动物繁殖场,生产许可证号为SCXK(苏)2007-0008。
1.5 药品
门冬氨酸鸟氨酸注射液(规格:10 mL∶5 g,批号:110901,110902,110903, 由合肥一公司生产; 规格:10 mL∶5 g,批号:010571,010581,010591,由德国麦氏大药厂生产)。
2 方法与结果
2.1 鲎试剂灵敏度复核试验
按《中国药典》2010年版二部附录细菌内毒素检查法[1]对两个厂家的鲎试剂进行灵敏度复核试验,结果见表1。由结果可知,2λ管均为阳性,0.25λ管和阴性对照管均为阴性,两个不同厂家的2 批鲎试剂灵敏度测定值均在0.5λ~2.0λ范围内,符合要求,可用于细菌内毒素检查,并以标示灵敏度λ为该批鲎试剂的灵敏度。
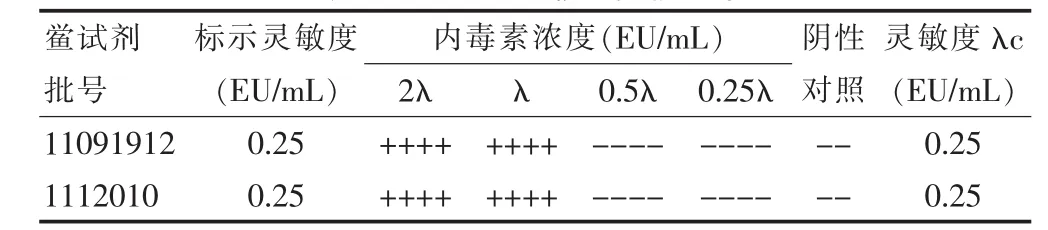
表1 鲎试剂灵敏度复核结果
2.2 内毒素限值(L)的确定[1-4]
参照药品说明书,门冬氨酸鸟氨酸注射液临床用法用量如下:在使用前应该用注射用溶液稀释,然后经静脉输入。由于静脉耐受方面的原因,每500 毫升溶液中不要溶解超过6 安瓿该药物,输入速度最大不要超过每小时1 安瓿该药物。根据公式 L=K/M,注射剂 K=5 EU/(kg·h),式中M 为人用每千克体重每小时的最大供试品剂量,人均体重按60 kg 计算,则 L=30 EU/mL,根据《中国药典》2010年版二部“化学药品注射剂安全性检查法应用指导原则”[2],由于药物和适应证(如抗感染、抗肿瘤、心血管药等急重病症用药、儿童老人用药、复合用药、大输液等)的不同,限值可适当严格,至计算值的1/3~1/2,以保证安全用药,所以最终确定限值(L)为 1/3×30 EU/mL=10 EU/mL。
2.3 干扰试验预试验
根据公式MVD=C×L/λ,目前市售鲎试剂λ通常在0.50~0.03 EU/mL,则门冬氨酸鸟氨酸注射液对应的最大有效稀释倍数分别为 20、40、80、160、320 倍。取样品一批(批号:110901),将门冬氨酸鸟氨酸注射液用细菌内毒素检查用水分别配制成为原液、10、20、40、80倍稀释液,将此系列溶液记为NPC。同法制备上述系列溶液,在其中加入细菌内毒素标准溶液,使每一浓度的溶液中均含有2λ(0.50 EU/mL)浓度的细菌内毒素,记此系列溶液为PPC。取2个厂家的鲎试剂分别与上述NPC 和PPC 进行反应,混匀后封口,置37℃恒温水浴60 min。每一浓度重复2 管,并设阴性对照(NC)和阳性对照(PC)。干扰试验预试结果见表2。预试结果表明,样品在20倍以下稀释倍数时可能对反应有抑制性干扰作用;样品的20倍以上稀释倍数可能对反应无干扰作用。
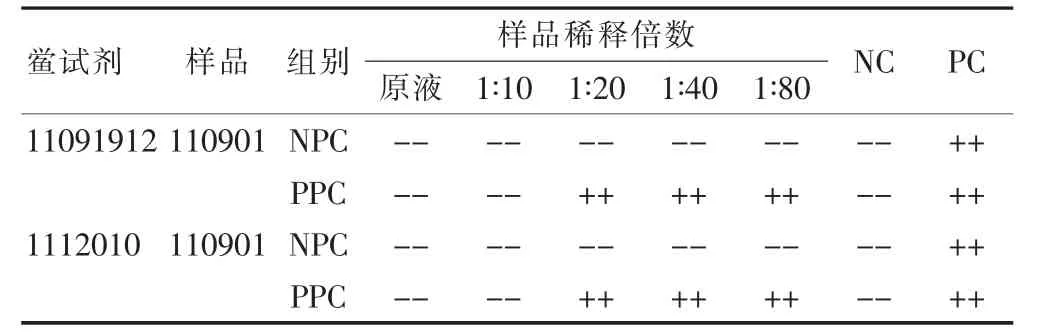
表2 门冬氨酸鸟氨酸注射液干扰试验预试结果
2.4 干扰试验
为了最终确认是否存在干扰因素的影响,取门冬氨酸鸟氨酸注射液用细菌内毒素检查用水分别进行稀释,使其正式干扰试验稀释倍数为20倍,按《中国药典》2010年版二部附录ⅪE“细菌内毒素检查法”凝胶法干扰试验项进行试验,结果见表3。正式干扰试验结果表明,采用福州新北生化工业有限公司和湛江博康海洋生物有限公司生产的灵敏度均为0.25 EU/mL的鲎试剂进行试验,Es均在0.5λ~2.0λ 内且Et/Es均在0.5~2.0 之间,确认样品稀释20倍后对细菌内毒素检查无干扰。

表3 门冬氨酸鸟氨酸注射液干扰试验结果
2.5 质量标准起草
取本品,依法检查(《中国药典》2010年版二部附录XIE),每1 毫升中含内毒素的量应小于10 EU。
2.6 样品细菌内毒素检查与家兔热原检查的对比试验
根据“2.4”项下结果,取两个厂家6 批样品用细菌内毒素检查用水稀释20倍后,分别用两个不同厂家灵敏度为0.25 EU/mL的鲎试剂按本研究起草的标准和 《中国药典》2010年版二部附录ⅪE“细菌内毒素检查法”凝胶限度试验对样品进行细菌内毒素检查,结果6 批样品的细菌内毒素检查结果均符合起草的质量标准要求。另取此6 批样品,按照门冬氨酸鸟氨酸注射液的进口药品注册标准JX20020348,每1 千克家兔体重注射1.0 mL,分别按《中国药典》2010年版二部附录ⅪD“热原检查法”进行热原检查,结果6 批样品均符合规定。对比试验表明门冬氨酸鸟氨酸注射液的细菌内毒素检查法与家兔热原检查法的检查结果一致。
3 讨论
目前,常见的热原检查方法为家兔法和鲎试剂法。与传统的家兔热原检查法相比,细菌内毒素检查法具有操作简便,检验周期短,结果准确,检测灵敏度高,符合对实验动物减少、替代、优化的3R 原则等优点。鲎试剂法关键内容是确定药品的细菌内毒素检查限值,建立细菌内毒素检查方法。不同厂家的鲎试剂在工艺、质量等方面有一定差异,其抗干扰能力也存在差异,通过采用2个不同厂家的鲎试剂对2个厂家共6个批号的门冬氨酸鸟氨酸注射液样品进行试验,可客观地评价样品浓度对鲎试剂与内毒素发生凝集反应的干扰程度,确定对细菌内毒素检查无干扰的样品浓度范围。结果表明:本品稀释20倍以后对内毒素检查无干扰,可进行细菌内毒素检查。根据试验结果和临床实际应用情况,可以确定门冬氨酸鸟氨酸注射液细菌内毒素检查方法如下:取本品,依法检查(《中国药典》2010年版二部附录XIE),每1 毫升中含内毒素的量应小于10 EU。此可为门冬氨酸鸟氨酸注射液的细菌内毒素检查质量标准,细菌内毒素检查法可代替家兔热原检查法用于门冬氨酸鸟氨酸注射液的质量控制。
[1]国家药典委员会.中国药典[S].二部.北京:中国医药科技出版社,2010.
[2]尚博扬,翟宇,薛瑞,等.异甘草酸镁注射液细菌内毒素检查法的研究[J].宁夏医学杂志,2012,34(11):1101-1102.
[3]中国药品生物制品检定所.中国药品检验标准操作规程[S].北京:中国医药科技出版社,2010:310-325.
[4]肖贵南,孙清萍,盛英美.如何建立新药的细菌内毒素检查方法[J].中国医药导报,2011,8(32):159-162.
[5]刘春,赵毓梅.注射用法莫替丁细菌内毒素检查法研究[J].中国热带医学,2009,9(12):2308-2310.
[6]程春雷,高天勤,曹珍艳.注射用盐酸丙帕他莫的细菌内毒素检查[J].中国医药工业杂志,2011,42(3):219-221.
[7]刘雪莉,张敏,陈汝红,等.苄星青霉素细菌内毒素检查法的标准修订[J].中国医药导报,2012,9(10):141-142.
[8]郭玉东,王志斌,王碧松,等.细菌内毒素鞘内注射致热阈值的研究[J].药物分析杂志,2011,31(2):352-355.
[9]陈琪.注射用双嘧达莫细菌内毒素检查法研究[J].中国医药导报,2012,9(12):31-32.
[10]祝清芬,国明,魏霞,等.米力农注射液细菌内毒素检查法标准修订[J].中国药事,2012,26(5):456-458.
[11]李琳.注射用盐酸克林霉素细菌内毒素的检查方法[J].中国医药指南,2012,10(30):455-456.
[12]王宗春,刘红,姜俊勇,等.高三尖杉酯碱注射液细菌内毒素检查法的建立[J].西北药学杂志,2012,27(6):574-576.
