口腔癌患者血清核磁共振代谢组学研究
2013-09-14黄奇骏黎玉君翁合妹龚嘉欣丘翠环杨永霞
黄奇骏 姚 婕 黎玉君 翁合妹 龚嘉欣 丘翠环 杨永霞
广东药学院基础学院物理与电子学教研室,广东广州 510006
口腔癌是一类发生于唇、腭、舌、口底和牙龈等部位的上皮源性恶性肿瘤。目前口腔癌多采用以手术为主的治疗方法,但术后患者5年生存率只有50%左右,同时还具有较高的复发风险[1]。核磁共振1H 谱(nuclear magnetic resonance1H,NMR1H)是研究生物样品代谢变化的一种常用手段,近年来基于核磁共振的代谢组学方法已经得到广泛应用[2-6]。本文应用核磁共振1H 谱并结合多变量分析方法研究口腔癌患者血清的代谢组特征,寻找与癌变相关的血清代谢标志物,阐明口腔癌患者血清生化过程的改变。
1 材料与方法
1.1 样品收集
于广东药学院附属第一医院收集口腔癌患者血清样本10例和健康人血清10例(收集时间:2011年11月~2012年4月),置-80℃超低温冰箱贮存。
1.2 样品预处理
采样前,将所有血清样本解冻,在4℃下,10 000 g 离心10 min。取400 μL 上层血清加至5 mm NMR 测试管中,后加入100 μL 0.2 mol/L 磷酸缓冲溶液(0.2 mol/L Na2HPO4-0.2 mol/L NaH2PO4,pH=7.4)和 50 μL 重水,振荡混匀。
1.3 NMR 实验
每一个样品均采集 Carr-Purcell-Meiboom-Gill(CPMG,relaxation delay-90-(τ-180-τ)n-acquisition) 氢谱,总回波时间为100 ms,3 s 延迟时间,64k 数据点, 采集次数为128。化学位移定标为乳酸甲基双重峰δ1.33。
1.4 数据预处理
采用软件TOPSPIN 2.0对所有1H CPMG 谱进行自动积分,积分区间δ0.5~4.6,积分间隔0.01。主成分分析前对每一个谱的积分值进行归一化处理,后将归一化值导入软件 Simca-P 12.0(Umetrics,Sweden)中进行主成分分析。
1.5 统计学方法
采用 SPSS(Version 13.0,SPSS Inc.,USA)软件对正常人和口腔癌患者血清代谢物的归一化积分值做独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 健康人与口腔癌患者血清CPMG1H 谱比较
由图1 可清楚地观察到亮氨酸、异亮氨酸、缬氨酸、乳酸、丙氨酸、糖蛋白、谷氨酸、乙酰乙酸、谷氨酰胺、甲胺、二甲胺、酪氨酸、苯丙氨酸、组氨酸、胆碱和葡萄糖等信号峰。对比健康人与口腔癌病人血清CPMG1H 谱,可以发现胆碱、葡萄糖和乳酸有明显的变化[7]。为了能够筛选出具有显著性差异的代谢标志物,将利用主成分分析和统计分析对两组样本的血清代谢组数据进行分析。图1 为代表性的健康人与口腔癌患者CPMG1H 谱。

图1 健康者(a)与口腔癌患者(b)血清CPMG1H 谱
2.2 多变量分析
为了筛选出口腔癌患者血清代谢标志物,本文采用代谢组学常用的多变量分析-主成分分析方法对上述得到的CPMG1H的归一化积分数据进行分析。主成分分析方法能够根据样本代谢图谱的特征给出样本间的分类,同时还可以筛选出对区分有较大贡献的代谢物(即化学位移区间)。对健康者(○)和口腔癌患者(●)血清CPMG1H 谱的主成分分析结果见图 2(PC1 比 PC2,R2=82.5%)。可以得到口腔癌患者血清中氨基酸(亮氨酸、异亮氨酸、缬氨酸、酪氨酸、苯丙氨酸、组氨酸),谷氨酸、糖蛋白、甲胺和二甲胺、葡萄糖的含量是升高的,而乳酸和胆碱的含量降低。
3 讨论
通过得分图(图2a)可以看到,健康人和口腔癌患者血清样本在PC2 维可以完全区分开,通过对PC2值进行统计分析,结果表明这两类样本在PC2 维具有显著性差异(P<0.01)。负载图(图2b)给出了两类样本中主要的代谢物变化,口腔癌患者血清中氨基酸(亮氨酸、异亮氨酸、缬氨酸、酪氨酸、苯丙氨酸、组氨酸),谷氨酸、糖蛋白、甲胺和二甲胺、葡萄糖的含量是升高的,而乳酸和胆碱的含量降低。进一步通过统计分析发现这些代谢物均具有显著性差异(P< 0.05)。
口腔癌患者血清中乳酸含量是降低的,这可能表明在口腔癌患者血清代谢中无氧糖酵解过程减少,这与鼻咽癌血清代谢中乳酸变化一致[8]。磷脂胆碱和胆碱是存在于细胞膜上的磷脂,而口腔癌患者血清胆碱含量的降低可能与细胞膜破坏,细胞凋亡过程出现了失衡状态有关。
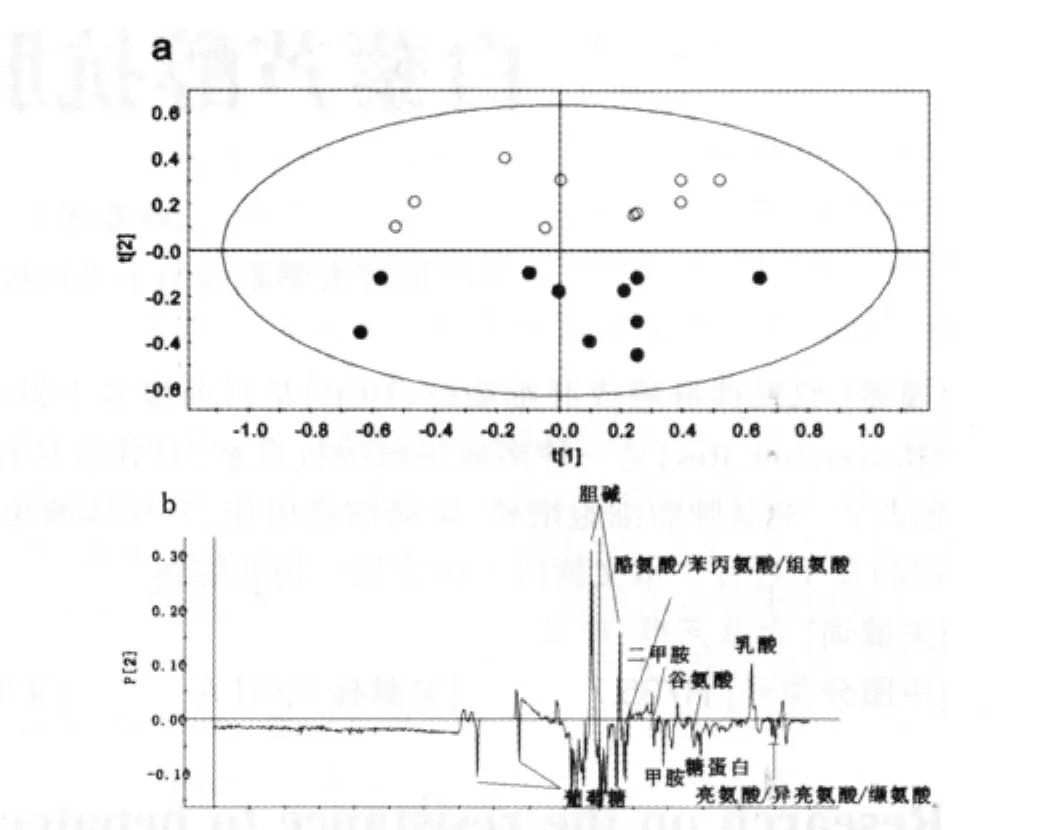
图2 健康者(○)和口腔癌患者(●)血清CPMG1H 谱主成分分析(a)得分图(b)负载图
此外,亮氨酸、异亮氨酸、缬氨酸、酪氨酸、苯丙氨酸和组氨酸在口腔癌患者血清中含量是明显增加的。糖蛋白和谷氨酸对免疫功能的维持有重要作用,如提高机体代谢和改善机体免疫状况等。糖蛋白和谷氨酸含量的增加表明其代谢过程受到调控,相应的调控功能受到影响[9]。
总之,通过对口腔癌患者血清代谢组的研究,并结合主成分分析方法筛选出了口腔癌患者血清代谢标志物,这将为口腔癌诊断提供可靠的分子水平上的代谢证据。
[1]Brandwein GM,Teixeira MS,Lewis CM,et al.Oral Squamous Cell Carcinoma: Histologic Risk Assessment, but Not Margin Status, Is Strongly Predictive of Local Disease-free and Overall Survival[J].Am J Surg Pathol,2005,29(2):167-178.
[2]杨永霞,杨生义,梁敏锋,等.基于核磁共振波谱的乙肝患者血清代谢组研究[J].第二军医大学学报,2010,31(3):288-291.
[3]高岗,杨根金,娄子洋.肾虚证大鼠尿液的核磁共振谱代谢组学研究[J].第二军医大学学报,2009,30(5):565-568.
[4]Lehnhardt FG,Bock C,Rohn G,et al.Metabolic differences between primary and recurrent human brain tumors:a 1H NMR spectroscopic investigation[J].NMR Biomed,2005,18(6):371-382.
[5]陶晓峰,杨根金,王晓钧,等.离体眼眶肿瘤及正常组织超高场磁共振波谱特点的比较[J].第二军医大学学报,2006,27(8):882-884.
[6]杨永霞,陈阿丽,梁敏锋,等.慢性乙肝与重症乙肝患者血清代谢组比较[J].中国医药导报,2010,7(18):27-28.
[7]杨永霞,梁敏锋,陈阿丽,等.应用核磁共振代谢组学方法分析食管癌患者血清代谢物[J].江苏医药,2010,36(16):1867-1868.
[8]符方方,姜苗苗,王希成,等.基于核磁共振波谱的鼻咽癌患者血清代谢组研究[J].广东药学院学报,2011,27(3):312-315.
[9]Fowler A,Rappas A,Holder J,et al.Differentiation of human prostate cancer from benign hypertrophy by in vitro1H NMR[J].Magn Reson Med,1992,25(1):140-147.
