杜仲中松脂醇二葡萄糖苷的测定
2013-09-14周修腾颜慷祺
周修腾, 何 伟, 李 勇, 颜慷祺
(1.广东药学院药物研究所广东省药物新剂型重点实验室,广东广州510006;2.国家中医药管理局“高脂血症调肝降脂重点研究室”国家中医药管理局脂代谢实验室 (三级)广东省代谢性疾病中医药防治重点实验室广东药学院中医药研究院,广东广州510006)
杜仲系杜仲科植物杜仲Eucommia ulmoides Oliv.的干燥树皮,具补肝肾强筋骨、安胎之功效[1],主要化学成分有松脂醇二葡萄糖苷、绿原酸、桃叶珊瑚苷、京尼平苷酸、杜仲胶等[2-4],松脂醇二葡萄糖苷为主要特征性成分[5]。因此,松脂醇二葡萄糖苷的含有量高低是评价杜仲药材质量的重要依据[6]。
杜仲含有大量的杜仲胶,是影响杜仲松脂醇二葡萄糖苷定量测定的主要因素之一[5]。因此,《中国药典》2010年版一部杜仲项下含量测定方法,首先以三氯甲烷为溶剂,采用索氏回流提取法处理杜仲药材,以除去杜仲胶,但提取时间长达12 h,且三氯甲烷属于中等类有毒溶剂,对人体损害大[7]。故本研究采用“石油醚除胶-甲醇提取”法测定杜仲松脂醇二葡萄糖苷,并进行了方法学研究。
1 仪器与试剂
1.1 仪器 DIONEX Ultimate 3000高效液相色谱仪,含四元梯度泵、柱温箱、自动进样器、DAD二极管阵列检测器,Chromeleon 6.8色谱工作站(美国戴安公司);BT—224S型万分之一电子分析天平 (北京Sartorius);BT—125D型十万分之一电子分析天平 (北京Sartorius);DFY—500型摇摆式高速中药粉碎机 (温岭市林大机械有限公司);UNIPREP 24(德国 UNIEQUIP),ULTRA-GE-MK2纯水仪。
1.2 试剂 松脂醇二葡萄糖苷对照品 (批号:110807-200205,定量测定用),购于中国药品生物制品检定所;杜仲购于广州致信药业有限公司(批号分别为111001-111005),经广东药学院中药学院李书渊教授鉴定,符合2010年版《中国药典》一部杜仲项下规定;液相用甲醇为色谱纯,其余试剂为分析纯,超纯水自制。
2 方法与结果
2.1 色谱条件 Agilent TC-C18色谱柱 (250 mm×4.6 mm,5μm);流动相为甲醇-水 (25∶75);检测波长277 nm;柱温30℃;体积流量 1.0 mL/min;进样量10μL。在此色谱条件下,松脂醇二葡萄糖苷峰与其它组分峰达到基线分离。
2.2 对照品溶液的制备 精密称取松脂醇二葡萄糖苷对照品12.49 mg,置10 mL量瓶中,加流动相溶解并稀释至刻度,即得质量浓度为1.249 mg/mL的对照品贮备液;精密吸取贮备液1.0 mL于5 mL量瓶中,用流动相稀释至刻度,摇匀,作为对照品溶液。
2.3 供试品溶液制备
2.3.1 除杜仲胶方法考察 取杜仲药材约3 g,粉碎成絮状,精密称定质量,加入石油醚30 mL,80℃水浴加热回流2次,每次2 h,趁热滤过,滤液冷至室温,置-20℃冰箱中冷藏1 h,析出杜仲胶沉淀,滤过,弃去滤液,沉淀挥干石油醚,精密称定质量,计算杜仲胶得率。
2.3.2 提取时间考察 参考相关文献[8]及预实验结果表明,当提取温度为80℃时,杜仲胶在石油醚中的溶解度最大,故固定石油醚提取温度为80℃,料液比为1∶10,提取次数为2次,考察提取时间分别为1 h、2 h、3 h时杜仲胶得率。从表1可以看出,提取1 h,杜仲胶得率较低;提取时间超过2 h后,杜仲胶得率变化不明显,故将提取时间确定为2 h。
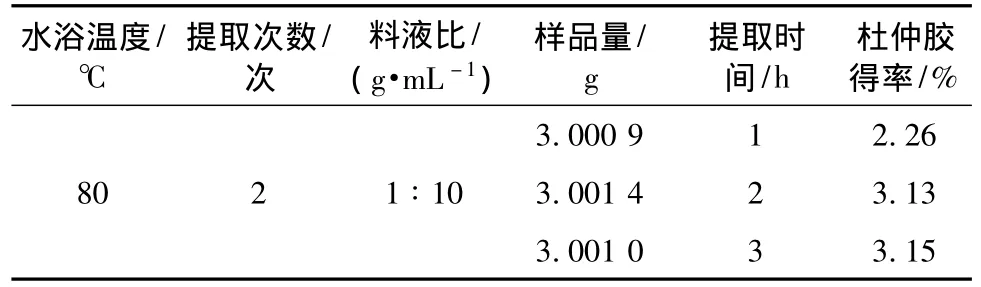
表1 提取时间对杜仲胶回收率的影响Tab.1 Effects of extraction time to solvent on extraction yield of the gum
2.3.3 料液比考察 固定提取时间为2 h,提取次数为2次,水浴提取温度为80℃,考察料液比分别为1∶8、1∶10、1∶12时杜仲胶得率 (见表2)。从表2可以看出,料液比为1∶10时,杜仲胶得率最高。
结果表明,以石油醚为溶剂,80℃回流提取2次,每次2 h,料液比为1∶10时,杜仲胶得率较高,在该条件下除杜仲胶较为理想。
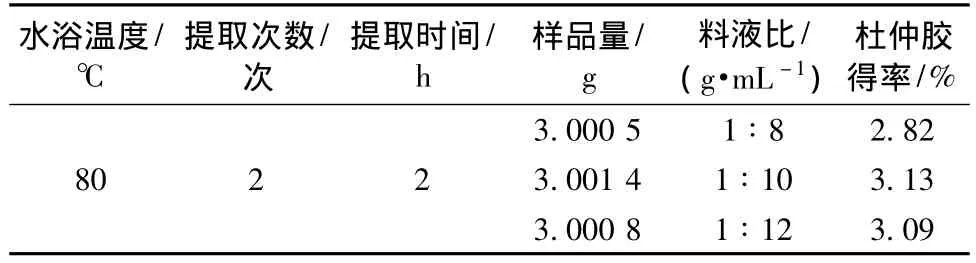
表2 料液比对杜仲胶回收率的影响Tab.2 Effects of radios of raw material to solvent on extraction yield of the gum
2.3.4 松脂醇二葡萄糖苷提取工艺条件考察 取杜仲药材约3 g,粉碎成絮状,精密称定质量,加入石油醚30 mL,80℃水浴加热回流2次,每次2 h,趁热滤过,弃去滤液,药渣加甲醇提取,采用正交试验设计对影响松脂醇二葡萄糖苷提取率的主要因素:甲醇体积分数 (A)、提取时间 (B)、提取次数 (C)、甲醇用量 (D)进行考察。每个因素选取3个水平,因素水平见表3。以松脂醇二葡萄糖苷量为评价指标,并采用SPSS软件对试验结果进行直观分析和方差分析,结果见表4、5。

表4 正交实验结果Tab.4 Results of orthogonal tests
由极差、方差分析可知,影响松脂醇二葡萄糖苷提取效果因素大小顺序排列为:甲醇体积分数(A)>提取时间 (B)>甲醇用量 (D) >提取次数 (C),其中 C为误差项;经F检验可知,A相对于误差项C有显著性差异 (P<0.05),而B、D差异并不显著 (P>0.05),其中A1>A2>A3,B2>B1>B3,C2>C3>C1,D2>D3>D1,因此,松脂醇二葡萄糖苷最佳提取条件为A1B2C2D2,即15倍量纯甲醇提取2次,每次2 h。

表5 方差分析结果Tab.5 Analysis of variance
按优选工艺,取同一批次的药材,平行三份,重复操作,在2.1项下色谱条件进行检测。结果,杜仲中松脂醇二葡萄糖苷的平均质量分数为1.326 8 mg/g。
2.4 线性关系考察 精密吸取对照品溶液2、5、10、15、20、30μL,注入液相色谱仪中,按2.1项下色谱条件进行分析,测定峰面积积分值,以松脂醇二葡萄糖苷微克数为横坐标,以峰面积积分值为纵坐标,绘制标准曲线,计算回归方程为:Y=9.577 0X-0.113 5,r=0.999 9,表明松脂醇二葡萄糖苷在0.499 6μg~7.494μg范围内线性关系良好。
2.5 精密度试验 精密量取松脂醇二葡萄糖苷对照品溶液10μL,按2.1项下色谱条件进行测定,同法平行操作6次,测定松脂醇二葡萄糖苷峰面积,其RSD为0.73%(n=6),表明仪器精密度良好。
2.6 稳定性试验 精密称取同一批次样品 (批号111001)3 g,按优选提取条件制备供试品溶液,按2.1项下色谱条件进行测定,分别于0、2、4、8、12、24 h各进样10μL,测定松脂醇二葡萄糖苷峰面积,其RSD为1.55%(n=6),表明供试品溶液在本试验条件下24 h内稳定。
2.7 重复性试验 精密称取同一批次样品 (批号111001)3 g,平行6份,按照2.3.4项下条件制备供试品溶液,精密吸取10μL,注入液相色谱仪中,按2.1项下色谱条件进行测定,所得RSD为1.93%(n=6),表明该方法重复性良好。
2.8 回收率试验 采用加样回收法,精密称取已知含有量的杜仲药材絮状粉末,加入松脂醇二葡萄糖苷对照品溶液2 mL(质量浓度0.249 8 mg/mL),按2.3.4项下条件制备供试品溶液,精密吸取10μL,注入液相色谱仪中,测定松脂醇二葡萄糖苷峰面积,计算含有量及回收率。见表6。

表6 加样回收率实验结果 (n=6)Tab.6 Results of recovery tests(n=6)
2.9 改进法与药典法[1]比较 结果见表7。
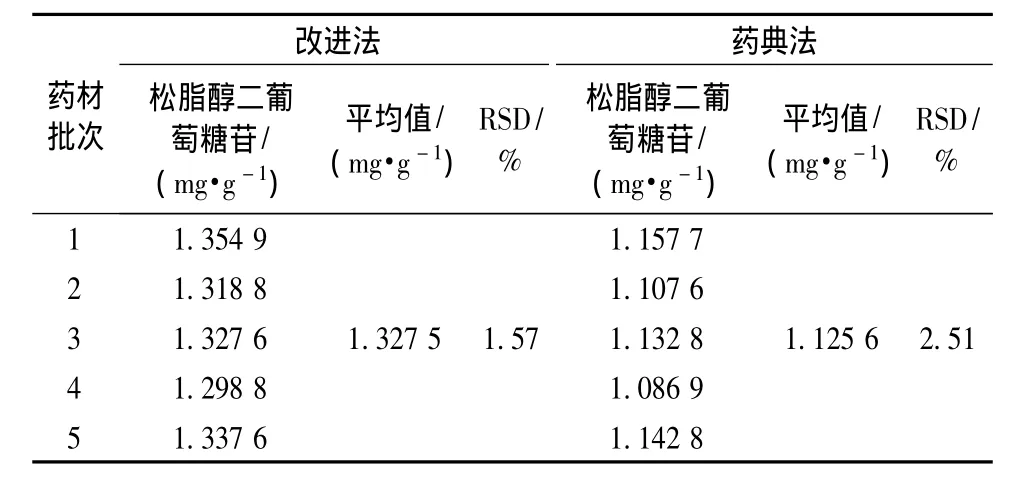
表7 改进法与药典法测定结果Tab.7 Com parison of the determ ination of improved methods and China pharmacopoeia(2010)
3 讨论
3.1 改进法测得杜仲药材中松脂醇二葡萄糖苷含有量高于药典法,究其原因可能是石油醚除杜仲胶效果更好。杜仲胶是一种反式-聚异戊二烯结构[9],主要以两种晶体结构共存形式存在,α晶型的熔点为65℃,β晶型为55℃,加热可使结晶态的杜仲胶破坏其晶格而溶解在溶剂中,且杜仲胶晶体完全熔融的温度需达65℃以上,但三氯甲烷沸点61.15℃,小于杜仲胶的熔融温度,石油醚 (60~90℃)具有与杜仲胶晶体熔点相一致的温度范围,能够更彻底地除去杜仲胶[8]。前期预实验结果也表明,采用石油醚提取杜仲胶的得率高于三氯甲烷,很好地证明了石油醚是提取杜仲胶非常理想的溶剂[8,10],除胶更完全。
3.2 测定杜仲胶得率时,石油醚提取液需在-20℃冷冻1 h杜仲胶才能沉淀完全,原因是杜仲药材粉碎后得到的杜仲胶在较低温度下溶解度低,胶析出更彻底[11]。
3.3 按《中国药典》2010年版杜仲含量测定项下条件,松脂醇二葡萄糖苷对照品和供试品用甲醇稀释后注入色谱仪其峰形出现了拖尾现象,故改进法中将松脂醇二葡萄糖苷对照品及供试品采用流动相进行稀释,其峰形较好,且分离度高。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:154.
[2]Sih C J,Ravikumt PR,Huang FC,et al.Isolation and synthesis of pinomsinol dighcosiae,a major antihyperten-sive principle of Tu-Chung[J].JAm Chem Soc,1976,98(17):5412-5413.
[3]叶文峰.杜仲叶中化学成分、药理活性及应用研究进展[J].林产化工通讯,2004,38(5):40-44.
[4]彭密军,周春山,雷启福,等.杜仲中京尼平苷酸的提取工艺研究及应用[J].中国中药杂志,2004,29(3):229-231.
[5]姜新义,杨中林,李 萍.杜仲中松脂醇二葡萄糖苷含量测定的样品处理方法优化[J].药学进展,2009,33(1):30-33.
[6]李 伟,孙素琴,覃洁萍,等.近红外漫反射法测定杜仲中松脂醇二葡萄糖苷的含量[J].中国中药杂志,2010,35(24):3318-3321.
[7]程能林.溶剂手册[M].4版.北京:化学工业出版社,2007:255-258.
[8]张学俊,王庆辉,宋 磊,等.不同温度条件下溶剂循环溶解-析出提取杜仲胶[J].天然产物研究与开发,2007,19(6):1062-1066.
[9]周莉英,刘晓利.杜仲胶的研究现状[J].陕西中医学院学报,2004,27(4):55-57.
[10]李学锋,闰 晗,哪华兴,等.杜仲胶的提取与热记忆材料制备的研究[J].塑料科技,1999,(2):18-22.
[11]何国菊.杜仲籽中油和杜仲胶的提取工艺研究[J].贵阳学院学报,2010,6(1):14-18.
