新疆蜂胶提取物抗氧化活性及槲皮素和白杨素含量测定
2013-09-13布威海丽且姆阿巴拜科日木塔力甫艾买提阿米尼姑丽买买提
布威海丽且姆·阿巴拜科日 木塔力甫·艾买提 阿米尼姑丽·买买提
尼砸木·艾海提 依米提·热合曼
蜂胶的化学组分非常复杂,生物学活性多样[1]。现代药理研究表明,蜂胶总黄酮具有抗病毒、抗肿瘤、抗氧化、降血脂、调节机体免疫功能等多种生物活性作用[2]。国内外大量的科学研究证明,蜂胶对机体的诸多保健功效与其抗氧化活性有着密切的关系[1]。蜂胶中含有丰富的黄酮类化合物,其品种和含量之丰富,非植物药所能相比,目前世界各地蜂胶样品中分离出来的黄酮类化合物已有70多种[3]。新疆大学实验室从新疆伊犁蜂胶的95%乙醇提取物中采用GC-MS法已鉴定了23种化合物,其主要成分为黄酮类物质[4]。蜂胶中的黄酮类化合物主要包括黄酮醇类、黄酮类和黄烷酮类。常见的黄酮醇类有槲皮素、良姜素、芦丁等;黄酮类主要有芹菜素、白杨素等;二氢黄酮类主要有松属素等;异黄酮有后莫紫檀素等[5-7]。多种药用植物中的现有研究已表明,槲皮素具有抗氧化、抗炎、抗过敏、抗菌、抗病毒、抑制恶性肿瘤生长和转移等多方面药理作用,能提高免疫能力、对冠心病及高血压患者也有辅助治疗作用,成为近年来国内外学者研究的热门课题[8]。大量研究表明,白杨素还具有抗病毒[9]、抗高血压[10]、抗糖尿病[11]、抗菌抗过敏[12]等作用。由于白杨素对常见病、多发病所具有的重要的生理作用,也引起了人们的广泛关注。目前,对蜂胶成分的分析主要采用高效液相色谱法[13-15]。蜂胶中的黄酮类化合物、咖啡酸酯类等成分都具有较强的清除自由基和抗氧化能力[16]。蜂胶抗氧化活性的测定方法,包括清除羟自由基和氧自由基能力测定法、β-胡萝卜素一亚油酸法、清除1,1-二苯基苦基苯肼(1,1-Diphenyl-1-picrylhydrazyl,DPPH)自 由 基 法、2-连氮-双(3-乙基苯并噻唑-6-磺酸)[2,2-azinobis(3-ethly-binzothiazoline-6-sulfonic acid),ABTS2] 阳离子脱色法、铁还原抗氧化能力测试法(ferric reducing antioxidant power,FRAP)、氧化自由基吸收能力测定法(oxygen radical absorption capacity,ORAC)等[17]。蜂胶的化学成分及其各种生物学活性取决于其收集产地[18],因此,产地是影响蜂胶抗氧化活性的重要因素之一。有关研究证明,澳大利亚、中国、匈牙利、新西兰的蜂胶清除DPPH自由基的能力较强,清除能力达60%以上。不同蜂胶样品中清除DPPH自由基活性和总多酚含量之间呈正相关R2=0.762。多酚含量与抗氧化作用具有显著性相关R2=0.671[19]。可见,清除DPPH自由基法是检测抗氧化活性的有效、快速方法。
王小平等[20]对河南、山东、甘肃、内蒙产的蜂胶中的槲皮素含量进行测定分析,由于新疆所处的特殊地理位置和气候条件,就药用植物的种类与其他省、自治区相比有较大的差异,很多种类属新疆特有种,蜜源植物是蜜蜂赖以生存,及蜂腊、蜂胶等各种蜂产品的物质基础。新疆野生蜜源植物比较丰富,约有200种。由于受生态系统和气候条件的影响,植物渗出物和分泌物的不同导致了不同地区采集的蜂胶化学成分的差异,生物学活性也因此有所变化,所以新疆产蜂胶的化学成分与生物学活性与其他种类也必然存在较大的差异。就这一科研领域,尚未见有关基于新疆产蜂胶进行抗氧化活性及其活性成分槲皮素和白杨素含量测定研究的报道。本研究首先从新疆产蜂胶有效成分的提取及其抗氧化作用着手,采用超声波提取法和不同有机溶剂提取蜂胶,检测其对DPPH自由基的清除能力和抗亚油酸过氧化能力,进一步检测其生物活性物质——黄酮类化合物,将其开发成天然抗氧化物质;其次利用比较先进的研究方法对新疆产蜂胶活性成分槲皮素和白杨素的含量进行分析,旨在对新疆产蜂胶产品产业化、标准化提供依据。
1 材料与方法
1.1 材料
1.1.1 原料及来源 蜂胶取自新疆伊犁尼勒克县和阿克苏库车县养蜂场,采集时间:秋季。纯度均为98%的槲皮素对照品和白杨素对照品(金测分析技术天津有限公司)。
1.1.2 仪器和试剂 筛子(60-120目);PYX-DHS-40X50-B型隔水式电热恒温培养箱;λ-17型紫外可见光谱仪(PE美国,波长范围190-900nm,准确度±0.3);HP1100高效液相色谱仪(安捷伦科技公司,原惠普公司);JY92-2D型超声波细胞破碎仪(宁伯新芝生物科技股份有限公司);2GKC14型控温水浴锅、冷柜、定量滤纸、容量瓶、电子天平、烧杯、移液管;DPPH(1,1-二苯基苦基苯肼,C18H12N5O6,相对分子质量394.3,Fluka公司)、硫代巴比妥酸(2-Thiobarbituric acid,TBA)、亚油酸、无水乙醇、茶多酚、乙酸乙酯、正丁醇、三氯乙酸、醋酸钾、丙酮等试剂均为国产分析纯。
1.2 方法
1.2.1 蜂胶的提取
1.2.1.1 预处理 将原料蜂胶放入冰箱冷冻5h(蜂胶在15℃以下变硬变脆,在此温度以上具有黏性,不便粉碎),粉碎,过40目筛。分别标准称取3g伊犁和库车原蜂胶并加上150mL蒸馏水,在65℃放置4h后抛弃蜂蜡和滤杂,备用。
1.2.1.2 蜂胶的各溶剂提取 分别称取预处理过的蜂胶→分别加入15倍体积的各溶剂(80%乙醇、丙酮、乙酸乙酯和正丁醇)→在超声波细胞粉粹机处理20min(20℃)→过滤→放65℃水浴锅,干燥→称重(计算提取率)→避光处保存,备用。1.2.2 清除DPPH自由基能力的测定
1.2.2.1 测定原理 DPPH自由基在有机溶剂中是一种稳定的自由基,其孤对电子在517nm附近有强吸收(显深紫色)。当有机清除剂存在时,孤对电子被配对,吸收消失或减弱,通过测定吸收减弱的程度,可评价自由基清除剂的活性。
1.2.2.2 测定方法 秤取将茶多酚和已提取备用的蜂胶用80%乙醇配制成质量浓度为10、20、40、60、80和100μg/mL的系列样品。准确称取DPPH试剂0.098 6g,用无水乙醇溶解定容至500mL容量瓶中,得到DPPH贮备液浓度为197.2mg/mL,摇匀置于冰箱中冷藏备用。使用时,将DPPH贮备液稀释成浓度为39.44mg/mL DPPH溶液。
取2mL DPPH溶液溶解待测物,充分混合,静置40min。在517nm处测定其吸光度。每个样品平行做3次。各待测物对DPPH的清除率K,可由下列公式:
K=[1-(Ai-Aj)]/Ac×100%
其中,K为样品对DPPH自由基的清除率;Ai为2mL DPPH溶液+ 2mL待测试液的吸光度;Aj为2mL待测试液+2mL乙醇的吸光度;Ac为2mL DPPH溶液+2mL乙醇的吸光度。
1.2.3 抗油脂过氧化力的测定[21]
1.2.3.1 测定原理 油脂发生过氧化反应从其化学本质来讲,主要是油脂中含有不饱和脂肪酸。尤其是亚油酸和亚麻酸上含有的1,4戊二烯结构使它们对氧化的敏感性远远超过油酸中丙烯体系,这种氧化作用又受到金属离子如Fe2+、Cu2+的催化,氧化反应一旦被启动,很容易形成链式反应,加速油脂的氧化酸败。抗氧化剂作为氢给予体和自由基接受体起着抑制链式反应的作用,从而使油脂过氧化反应的发生受到一定的限制。该方法的原理是[22]:丙二醛是油脂被氧化后的产物,它可以与TBA反应生成有色产物可在532nm下测定出其吸光值,吸光度值表示油脂氧化程度,其值越大,氧化程度越严重,当油脂中加入抗氧化剂时,就会减少氧化反应的发生从而降低丙二醛的含量。
1.2.3.2 测定方法[23]秤取将已提取备用的伊犁和库车蜂胶用95%乙醇配制成质量分数为0.2%的蜂胶提取液。配制2.5%的亚油酸和95%乙醇溶液作底物溶液,分别加入已配好的0.2%蜂胶和95%乙醇提取物(1∶1),蜂胶的终质量分数为0.1%,向空白组不加蜂胶提取液。混匀后置于培养箱中于(40±1)℃下培养,定时取待测样品1mL,加入1mL 25%的三氯乙酸,混匀,放置,终止反应。然后加入1mL0.67% TBA,于沸水浴中加热10min。取出冷却后加入4mL正丁醇,摇匀,于4000r/min离心10min,取上层正丁醇液,于532nm处测定光吸收值A,同时测定不加抗氧化物(蜂胶提取液)空白组的光吸收值A,吸光值越小表明抗氧化能力越强。
1.2.4 高效液相色谱(High performance liquid chromatography,HPLC)法分析蜂胶提取液的活性成分槲皮素和白杨素的含量
1.2.4.1 测定原理 当流动相(液体)中携带的混合物流经固定相时,其与固定相发生相互作用。由于混合物中各组分在性质和结构上的差异,与固定相之间产生的作用力的大小、强弱不同,随着流动相的移动,混合物在两相间经过反复多次的分配平衡,使得各组分被固定相保留的时间不同,从而按一定次序由固定相中流出。与适当的柱后检测方法结合,实现混合物中各组分的分离与检测。
1.2.4.2 测定方法
(1)测定波长的选择:取一定浓度的槲皮素对照品溶液和白杨素甲醇溶液分别置于190-400nm和200-600nm波长范围内进行光谱扫描,结果分别在370nm和268nm波长处有最大特征光吸收,此时检测基线稳定,槲皮素峰和白杨素峰前后杂质峰干扰小,因此,对于槲皮素选择370nm、对于白杨素选择268nm作为测定波长。
(2)原料预处理:将原料伊犁蜂胶放入冰箱冷冻5h(蜂胶在15℃以下变硬变脆,在此温度以上具有黏性,不便粉碎),取原蜂胶5g,用研钵磨碎,过40目筛,加入50mL水,放入65℃水浴中4h,充分搅拌,除去蜂蜡和杂质,置于顺风处,以便干燥备用。
(3)蜂胶的提取:准确称取干燥并恒重的伊犁蜂胶样品2g于烧杯中,分别精密加入50mL的70%乙醇和甲醇,称定重量,超声处理30min(20℃,600W),冷却,再称定重量,分别用70%乙醇和甲醇补足减失的重量,摇匀,滤过。精密量取滤液25mL,置于分液漏斗中,加石油醚(60-90℃)萃取2次,每次25mL。弃去石油醚液,分别取70%乙醇和甲醇液,置水浴上蒸干。将粉碎的伊犁蜂胶称2.5g分别加入5倍的一定浓度的70%乙醇和甲醇提取溶液中,超声处理30min(20℃,600 W)。30℃浸渍 48h,提出浸液,减压回收70%乙醇和甲醇。
(4)供试品溶液的制备:精密称取槲皮素和白杨素样品0.2g,分开置于50mL 容量瓶中分别加70%乙醇和45mL甲醇使溶解,分别用70%乙醇和甲醇定容至划度,摇匀,用微孔滤膜(0.45μm)滤过,滤液作为供试品溶液,注入HPLC色谱仪,测定。
(5)对照品溶液的制备:精密称取槲皮素对照品5.0mg,置200mL容量瓶中,加70%乙醇166mL并摇匀,即得槲皮素对照品(浓度为30μg/mL)。精密称取白杨素对照品5.0mg,置125mL 容量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得白杨素对照品溶液(浓度为 40μg/mL)。
(6)色谱条件:测定槲皮素的色谱条件-色谱柱 :Spherisorb(5μm,250mm×4.6mm);流动相 :甲醇-16.7%四氢呋喃的0.4%磷酸溶液(38∶62);流速:1.0mL/min;检测波长:370nm;柱温:40℃。测定白杨素的色谱条件-色谱柱:Diamonsil CL8(5μm,4.6mm×200mm);流动相:甲醇 - 水(35:25);流速1.0mL/min;检测波长:268nm;柱温为25℃。
(7)标准曲线的制定:在选定的色谱条件下,分别精密吸取槲皮素对照品溶液(0.03mg/mL)4、8、12、16、20μL 和白杨素对照品溶液(0.04mg/mL)2.5、5.0、10.0、15.0、20.0μL,以依次注入 HPLC 色谱仪进行测定,记录其色谱峰的峰面积积分值。以进样量浓度(μg/mL)为横坐标,相应的峰面积为纵坐标,绘制标准曲线。
(8)精密度试验:精密度是指在规定的测试条件下,同一个均匀供试品,经多次取样测定所得结果之间接近的程度[24],一般用相对标准偏差(Relative standard deviation,RSD)表示,其数值一般不大于2.0%。RSD越小说明精密度越高,公式:
RSD=标准偏差/平均值×100%
本试验分别精密吸取槲皮素和白杨素对照品溶液,重复进样5次,每次10μL,测定峰面积,记录色谱,计算其RSD值。
(9)稳定性试验:精密吸取各样本供试品溶液,进样量为10μL,每隔4h测定一次,总共测24h,记录色谱,计算结果。
1.2.5 统计学处理 各组数据以Microsoft Excel和SPSS 10.0版统计分析程序对各组数据进行相对标准偏差分析。
2 结果
2.1 不同提取方式对蜂胶提取率的影响
各溶剂提取物分别加入已准确称重的干燥空烧杯中,放在65℃水浴锅,待干燥后称重,减去空烧杯的重量,所得的蜂胶提取率结果如表1所示。
由表1可知,库车蜂胶的提取率高于伊犁蜂胶,对伊梨蜂胶正丁醇提取法的提取率(26%)最高,正丁醇可做为最佳提取溶剂;对库车蜂胶丙酮提取法的提取率(36%)最高,丙酮可做为最佳提取溶剂。

表1 蜂胶在不同提取法中的提取率
2.2 不同蜂胶提取物对DPPH自由基的清除作用
当伊犁和库车蜂胶各溶剂提取物系列浓度为10-100μg/mL时,对DPPH自由基的清除能力结果(表2)显示,伊犁和库车蜂胶各溶剂提取物和茶多酚的各浓度液对DPPH清除率的均值比较,蜂胶在有机溶剂正丁醇里溶解成分的抗氧化能力最强。从表中可以看出伊梨蜂胶各溶剂提取物浓度为10-100μg/mL时对DPPH自由基的清除能力为:80%乙醇>正丁醇>丙酮>乙酸乙酯,清除率越高就表明抗氧化能力越强;结果表明在此浓度的4种提取溶剂里80%乙醇提取物的抗氧化能力最强;与对照品(茶多酚)相比,80%乙醇提取物的抗氧化能力在6种浓度梯度下都高于茶多酚。库车蜂胶各溶剂提取物系列浓度为10-100μg/mL时对DPPH自由基的清除能力为:正丁醇>丙酮>乙酸乙酯>80%乙醇,结果表明在此浓度的4种提取溶剂里正丁醇提取物的抗氧化能力最强,与对照品(茶多酚)相比正丁醇提取物的抗氧化能力在6种浓度梯度下都高于茶多酚。
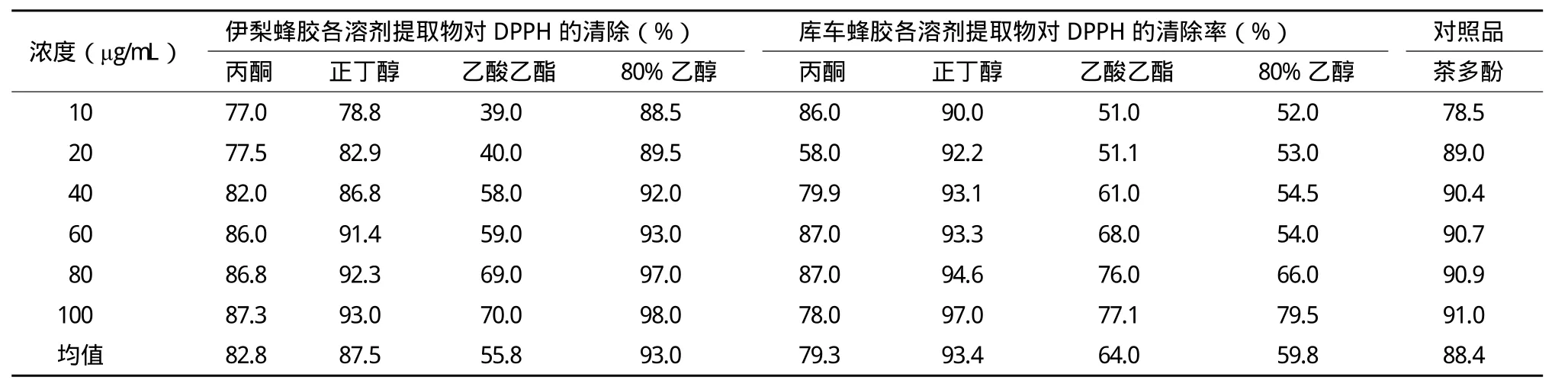
表2 伊梨蜂胶和库车蜂胶各溶剂提取物及茶多酚对DPPH自由基的清除率
2.3 蜂胶的抗油脂过氧化作用
如图1所示,532nm处吸光值随油样作用时间的延长而升高。0.1%蜂胶+95%乙醇提取物作为抗氧化剂添加到油样中,提高了油样的抗氧化性,吸光值低于未加抗氧化剂组(空白)。
从图1可知在第6天时亚油酸氧化达到最高值,伊犁蜂胶提取物的A值比库车蜂胶提取物的A低,表明其抗氧化效果较好。随着氧化的后期,由于分解的醛类物质受到再氧化生成酸,因此油脂酸败至一定程度时,其丙二醛物质生成减少,TBA值有下降的趋势,即测得的A值下降,表明油脂已剧烈酸败。

图10.1%蜂胶+95%乙醇提取物对亚油酸抗氧化作用
2.4 HPLC法测定蜂胶提取液的活性成分槲皮素和白杨素的含量
2.4.1 标准曲线的制定 在选定的色谱条件下,分别精密吸取槲皮素对照品溶液(0.03mg/mL)4、8、12、16、20μL和白杨素对照品溶液(0.04mg/mL)2.5、5.0、10.0、15.0和 20.0μL,以依次注入 HPLC色谱仪,进行测定,分别记录其色谱峰的峰面积积分值。浓度与峰面积线性关系见表3。
分别以浓度(μg/mL)为横坐标,相应色谱峰峰面积积分值为纵坐标,绘制标准曲线。槲皮素回归方程:y=15.464x+2.7166,R2=0.9994;白杨素回归方程:y=5.9351x-9.7648,R2=1,式中 x为浓度(μg/mL),y为峰面积。槲皮素和白杨素含量分别在1.91-19.11μg/mL和37.24-372.40μg/mL范围内显示良好的线性关系,其标准曲线如图2所示。

表3 槲皮素、白杨素浓度与峰面积线性关系
2.4.2 槲皮素及白杨素样品含量的测定 按“供试品溶液的制备”方法制备供试品溶液。精密吸取各供试品溶液20μL,注入HPLC色谱仪,测定。结果(表4)表明,伊犁蜂胶中与槲皮素相比白杨素的含量较高;对槲皮素而言,与乙醇提取剂相比,以甲醇为提取溶剂时蜂胶中槲皮素的含量较高、样品提取率高、提取效果好;而对白杨素而言,与未经脱脂的甲醇提取液相比未经脱脂的乙醇提取液里样品中白杨素的含量较高;分别将乙醇和甲醇提取液直接注入HPLC色谱仪进行分析,样品中槲皮素和白杨素含量较低。但经采用石油醚萃取,脱脂,除去脂溶性杂质,此时样品中槲皮素和白杨素含量都比未经脱脂的高,分离效果最佳。

图2 槲皮素(A)和白杨素(B)标准曲线
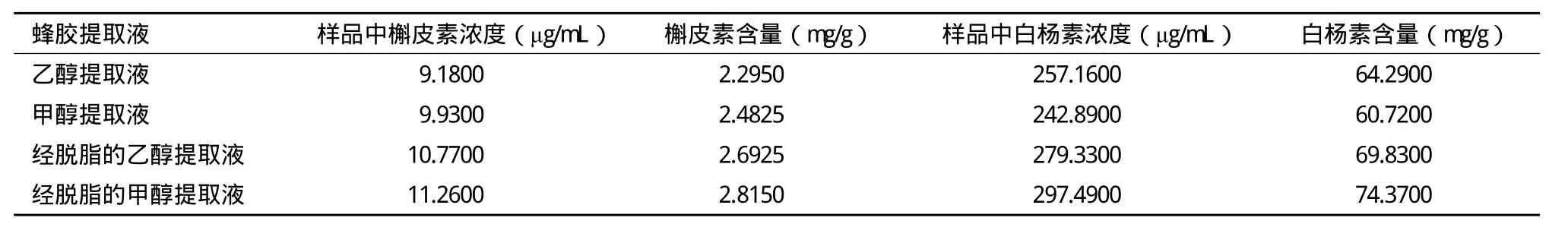
表4 槲皮素、白杨素样品含量测定
2.4.3 对照品的HPLC分析 按以上选定色谱条件,分别精密吸取槲皮素和白杨素对照品溶液20μL注入HPLC色谱仪,测定。槲皮素和白杨素的保留时间分别为t=3.983min、t=10.374min,结果如图3、图4所示。
2.4.4 样品的HPLC色谱分析 分别精密吸取未经脱脂的乙醇蜂胶提取液、未经脱脂的甲醇蜂胶提取液、经脱脂的乙醇蜂胶提取液、经脱脂的甲醇蜂胶提取液各吸取20μL,注入HPLC色谱仪,测定结果如图5 -图8所示,相应的保留时间见表5。

图 3 槲皮素对照品的HPLC分析图

图4 白杨素对照品的HPLC分析图
由图5-图8可以看出,各蜂胶提取液中有很多成分,此结果与槲皮素和白杨素对照品的HPLC色谱分析图相比,未经脱脂的乙醇蜂胶提取液、未经脱脂的甲醇蜂胶提取液、经脱脂的乙醇蜂胶提取液、经脱脂的甲醇蜂胶提取液都包含槲皮素和白杨素。表5说明蜂胶经过脱脂,除去脂溶性杂质以后,缩短了出现槲皮素峰和白杨素峰的保留时间。

图 5 未经脱脂的乙醇提取液的HPLC分析图

图 6 经脱脂的乙醇提取液的HPLC分析图

图 7 未经脱脂的甲醇提取液的HPLC分析图

图 8 经脱脂的甲醇提取液的HPLC分析图
2.4.5 精密度试验 精密吸取槲皮素和白杨素对照品溶液,重复进样5次,每次的进样量均为10μL注入HPLC色谱仪进行分析,记录色谱,结果(表6)显示,槲皮素峰的平均峰面积值为60.96,RSD为0.86%;白杨素峰的平均峰面积值为431.16,RSD为0.26%。试验结果表明,该法测定蜂胶中槲皮素和白杨素含量的重复性良好,仪器的精密度较高。

表 5 样品的HPLC色谱分析表

表 6 精密度试验结果
2.4.6 稳定性试验 精密吸取槲皮素和白杨素供试品溶液,进样量均为10μL,注入HPLC色谱仪进行分析,每隔4h测定一次,总共测24h,记录色谱。测定结果(表7)显示,槲皮素峰平均峰面积值为169.03,RSD为1.89%;白杨素峰的平均峰面积值为1631.73,RSD为1.11%。试验结果表明,本品溶液在24h内基本稳定,其峰面积基本不变。
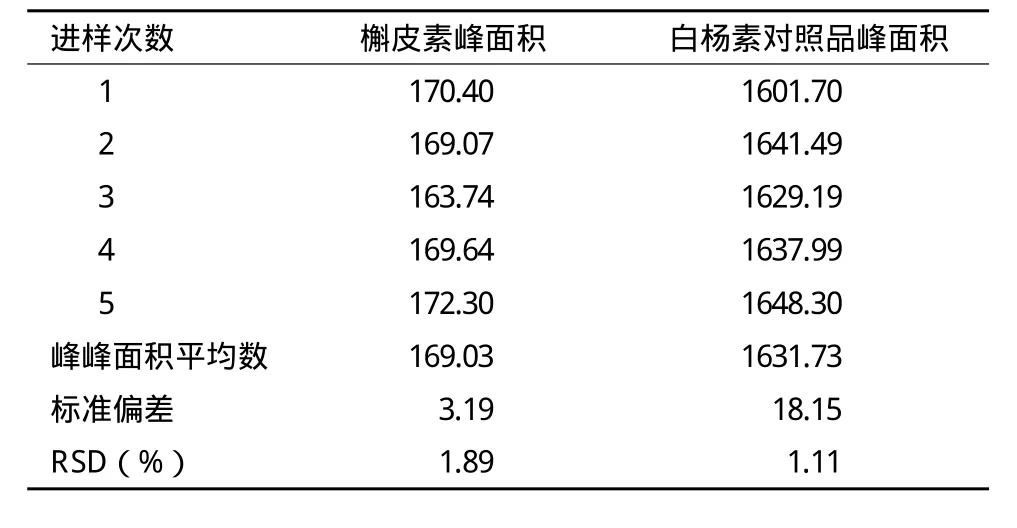
表 7 稳定性试验结果
3 讨论
蜂胶的化学成分复杂,迄今已发现300多种成分[18]。随着人们对蜂胶的认识和研究的深入,经过充分的考核考察,蜂胶有可能因其资源丰富、效果显著、提取方便等优点而成为具有前途的天然抗氧化剂新资源[25]。
蜂胶的功效成分主要是黄酮类化合物,如槲皮素、白杨素等和酚类化合物,本研究首先针对新疆伊犁和库车蜂胶采用4种不同溶剂进行提取得到一系列蜂胶提取物,对其进行了抗氧化活性的测定,并进一步定性分析了黄酮类物质;其次采用高效HPLC色谱法对新疆伊梨蜂胶中槲皮素和白杨素的含量进行了测定。新疆伊犁蜂胶和库车蜂胶的提取率具有一定的差异,即库车蜂胶的提取率较高,但它们的抗氧化活性之间无明显差异,表明蜂胶提取率和抗氧化活性之间没有相关性,原蜂胶的杂质成分可能影响了其提取率。蜂胶的收集产地和原蜂胶的不同溶剂法提取可能会引起蜂胶提取物在活性成分含量的差异,很可能正是这种差异影响了其抗氧化能力。本次试验中新疆两个地区蜂胶抗氧化活性之间无明显差异,而且这两个地区的地理环境和植被分布很相似,表明其蜂胶活性成分也很相近。
蜂胶是含有树脂状物的黏性物质,不溶于水,易溶于甲醇、乙醇和甘油等有机溶剂。本试验用70%乙醇和甲醇作为提取溶剂从新疆伊犁蜂胶中提取槲皮素和白杨素。结果表明,伊犁蜂胶中与槲皮素相比白杨素的含量较高;对槲皮素而言,与乙醇提取剂相比,以甲醇为提取溶剂时蜂胶中槲皮素的含量较高、样品提取率高、提取效果好;而对白杨素而言,与未经脱脂的甲醇提取液相比未经脱脂的乙醇提取液里样品中白杨素的含量较高。经过HPLC分析,活性成分槲皮素和白杨素从新疆伊梨蜂胶样品中可被检测出,而二者在本研究的色谱条件下,分离度、重现性、稳定性好等优点,并且峰形对称,无拖尾现象,杂质也无干扰。通过稳定性及回收率试验,显示本方法操作简便,重现性好。用不同的方法提取的蜂胶中槲皮素和白杨素的含量也不同,即分别将乙醇和甲醇提取液直接注入HPLC色谱仪进行分析,样品中槲皮素和白杨素含量较低,但经采用石油醚萃取、脱脂、除去脂溶性杂质,此时样品中槲皮素和白杨素含量都比未经脱脂的高,分离效果最佳,并缩短了出现槲皮素峰和白杨素峰的保留时间。
新疆具有丰富的蜂胶资源,蜂胶的生物学活性与化学成分受生态系统和气候条件的影响。蜂胶成分主要取决于其收集产地,对新疆产蜂胶抗氧化活性及活性成分槲皮素和白杨素的含量分析研究,以及开发具有医疗营养保健功能的蜂胶产品及其制品,尽快实现新疆蜂胶产品产业化、标准化,将具有理论意义和现实意义。
4 结论
通过对蜂胶中活性物质的提取与其抗氧化作用的初步研究表明,采用超声波提取的蜂胶各溶剂提取物具有比较强的抗氧化能力,能明显清除DPPH自由基;蜂胶的采样地点和提取溶剂不同,其抗氧化能力也有所不同,待进一步进行新疆蜂胶新活性成分的分离纯化和产业化。测定波长分别为370nm和268nm时,经过HPLC分析活性成分槲皮素和白杨素从新疆伊犁蜂胶样品中可被检测出;槲皮素和白杨素浓度分别在1.91-19.11μg/mL和37.24-372.40μg/mL范围内浓度与峰面积呈良好的线性关系,其相应的R2值为0.9994和1。
[1] 胡福良.蜂胶药理作用研究[M].杭州:浙江大学出版社,2005.
[2] 胡福良, 玄红专.蜂胶的生物学活性及毒性和过敏反应[J].科技通报, 2003, 19(2):166-169.
[3] 郭伽, 周立东.胶的化学成分研究进展[J].中国养蜂, 2000,51(2):21-22.
[4] Mamet A, Amet M, 等.新疆产蜂胶提取物对农作物病原真菌的抗性作用[J].新疆农业科学, 2011, 48(9):1716-1722.
[5] 赵玉娟.高效液相色谱法测定蜂胶中的黄酮成分[J].现代仪器 , 2000(4):22-24.
[6] Alcncar SM, Oldoni TLC, Castro ML, et al.Chemical composition and biological activity of a new type of Brazilian pmpolis:Red propolis[J].Journal of Ethnopharmacology, 2007(113):278-283.
[7] 宋爱清, 刘杰.HPLC法测定蜂胶中黄酮类化合物的含量[J].中国养蜂, 2001(3):10-11.
[8] 王艳芳, 王新华, 朱宇同.槲皮素药理作用研究进展[J].天然产物研究与开发, 2003, 15(2):171-173.
[9] Emepyanov AV, Kovac CR, Sepulveda MA, et al.The interaction of Pax5(BSAP)with Daxx can result in tarnscriptional activation in B cells[J].J Biol Chem, 2002, 277(13):11156-11164.
[10] Maul GG, Negorev PB, Ishov AM.Review :properties and assemblymechanisms of ND10, PML bodies, or PODs[J].J Struc Biol, 2000, 129:278-287.
[11] Sternsdorf T, Grotzinger T, Jensen K, et al.Nuclear dots:actors onmany stages[J].Immuno, 1997, 198(1-3):307-331.
[12] Harborne JB, Williams CA.Advances in flavonoid research since 1992[J].Phytochemistry, 2000, 55(6):481-483.
[13] Ahn MR, Kumazawa S, Hamasaka T, et al.Antioxidant activity andconstituents of propolis collected in various areas of Korea[J].Agric Food Chem, 2004, 52(24):7286-7292.
[14] Kumazawa S, Hamasaka T, Nakayama T.Antioxidant activity of propolis of various geographic origins[J].Food Chemistry, 2004,84(3):329-339.
[15] Kumazawa S, Hayashi K.Studies of the constituents of Uruguayan propolis[J].Agric Food Chem, 2002, 50(17):4777-4782.
[16] 林贤统, 朱威, 胡福良.不同溶剂提取蜂胶的得率及其提取物的抗氧化性[J].蜜蜂杂质, 2008(7):3-5.
[17] 续洁琨, 姚新生, 等.抗氧化能力指数(ORAC)钡O定原理及应用[J].中国药理学通报, 2006, 22(8):1015-1021.
[18] Jasprica I, Momar A, Debeljak Ž, et al.In vivo study of propolis supplementation effects on antioxidative status and red blood cells[J].Ethnopharmacol, 2007, 110(3):548-549.
[19] 玄红专, 胡福良.不同地区蜂胶抗氧化活性与化学组分的研究进展[J].蜜蜂杂志, 2009(2):7-10.
[20] 王小平, 林励, 白吉庆.HPLC法测定不同产地蜂胶中槲皮素的含量[J].云南中医学院学报, 2009, 32(3):30-32.
[21] 沈建福, 张英.竹叶黄酮糖苷的水解及其苷元的抗氧化性能研究[J].中国粮油学报, 2001, 16(4):14-16.
[22] 杨淑珍, 张友胜, 彭丽桃, 等.二氢杨梅树皮素的抗氧化效果研究[J].中国粮油学报, 2004, 19(2):82-84.
[23] 孟浩, 杭瑚.柯子抗氧化作用的研究[J].食品科学, 2002,21(2):9-12.
[24] 张燕, 林松毅, 刘静波, 等.反高效液相色谱法测定笃斯越桔叶片中槲皮素含量[J].食品科学, 2007, 28(11):404-406.
[25] 乞永艳, 骆尚骅, 刘富海.蜂胶抗氧化作用研究进展[J].蜜蜂杂志, 2000(12):3-5.
